Слайд 2 Известно несколько кислот, содержащих фосфор. В зависимости от условий при которых

протекает растворение Р2О5 в воде можно получить
Метафосфорную кислоту НРО3
Дифосфорную кислоту Н4Р2О7
Ортофосфорную (фосфорную) кислоту Н3РО4.
Наибольшее практическое значение имеет фосфорная кислота, так как ее соли используются в качестве удобрений.
Слайд 3Цель исследования
Изучить состав и строение фосфорной кислоты;
Исследовать физические и химические свойства характерные

для фосфорной кислоты;
Рассмотреть состав солей фосфорной кислоты.
Слайд 4Состав молекулы
Н-О +5 Н О
Н-О – Р О

Н О Р О
Н-О Н О
структурная электронная
формула формула
Фосфорная кислота не является окислителем и не разлагается при нагревании, что объясняется наибольшей устойчивостью степени окисления +5 из всех возможных для фосфора.
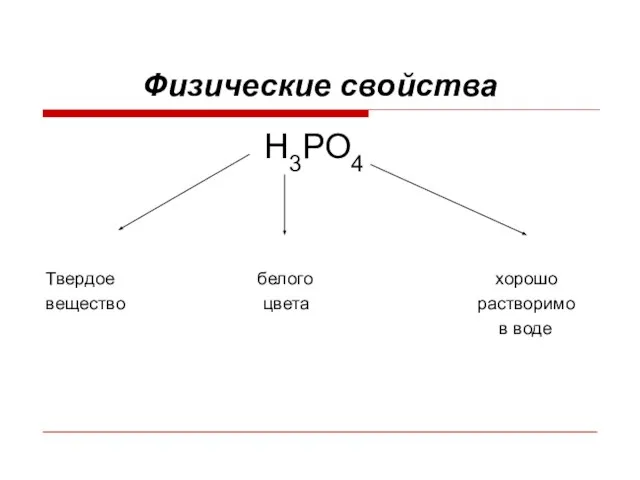
Слайд 5Физические свойства
Н3РО4
Твердое белого хорошо
вещество цвета растворимо
в воде
Слайд 6Химические свойства
Общие с другими кислотами
1) Водный раствор кислоты изменяет окраску индикаторов. Диссоциация

происходит ступенчато:
Н3РО4 Н+ + Н2РО4-
Н2РО4- Н+ + НРО42-
НРО42- Н+ + РО43-
Легче всего идет диссоциация по первой ступени и труднее всего по третьей. Лакмус приобретает красную окраску.
2) Реагирует с металлами, расположенными в электрохимическом ряду до водорода:
6Na + 2Н3РО4 2Na3РО4 + 3H2
3) Реагирует с основными оксидами:
3CaO + 2Н3РО4 Ca3(РО4)2 + 3H2O
Слайд 7Химические свойства
4) Реагирует с основаниями и аммиаком; если кислота взята в избытке,
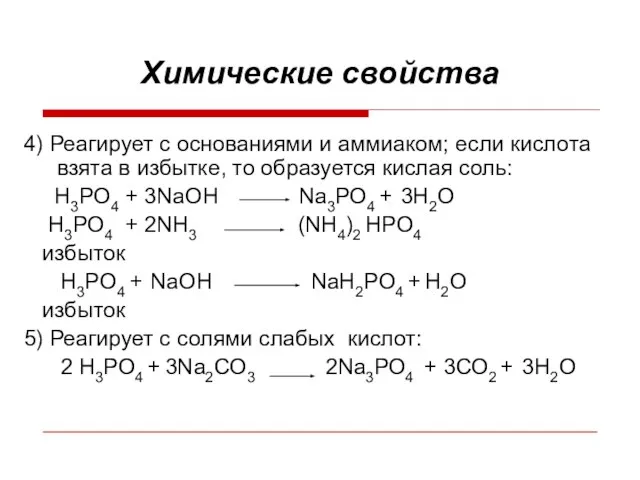
то образуется кислая соль:
H3PO4 + 3NaOH Na3РО4 + 3H2О
H3PO4 + 2NH3 (NH4)2 HPO4
избыток
H3PO4 + NaOH NaH2PO4 + H2О
избыток
5) Реагирует с солями слабых кислот:
2 H3PO4 + 3Na2СО3 2Na3РО4 + 3СО2 + 3H2О
Слайд 8 Специфические
1) При нагревании постепенно превращается в метафосфорную кислоту:
2H3PO4 t H4P2O7

+ H2О
Двуфосфорная
кислота
H4P2O7 t 2HPO3 + H2О
2) При действии раствора нитрата серебра ( I ) появляется желтый осадок (качественная реакция на ион РО43-):
H3PO4 + 3AgNO3 Ag3PO4 + 3HNO3
желтый осадок
3) Ортофосфорная кислота играет большую роль в жизнедеятельности животных и растений.
Ее остатки входят в состав аденозинтрифосфорной кислоты - АТФ. При разложении АТФ выделяется большое количество энергии.
Слайд 9 Получение
1) Взаимодействием оксида фосфора (v) c водой при нагревании:
Р2О5

+ 3H2О t 2H3PO4
2) Взаимодействием природной соли – фосфата кальция с серной кислотой, при нагревании:
Ca3(PO4)2 + 3H2SO4 t 3CaSO4 + 2 H3PO4
Слайд 10 Соли фосфорной кислоты
Будучи трехосновной кислотой она образует три ряда солей:
*фосфаты

замещены все атомы водорода в фосфорной кислоте.
К3РО4 - фосфат калия
(NH4)3PO4 - фосфат алюминия
3КОН + H3PO4 К3РО4 + 3H2О
Растворимыми в воде являются только фосфаты щелочных металлов.
*гидрофосфаты
Замещены два атома водорода кислоты
К2НРО4 – гидрофосфат калия
(NН4)2НРО4 – гидрофосфат аммония
2КОН + Н3РО4 К2НРО4 + 2Н2О
избыток
Мало растворимы в воде (кроме фосфатов натрия, калия и аммония).
Слайд 11Соли фосфорной кислоты
*дигидрофосфаты
замещен один атом водорода кислоты
КН2РО4 – дигидрофосфат калия

NН4Н2РО4 – дигидрофосфат аммония
КОН + H3PO4 КН2РО4 + H2О
избыток
Большинство дигидрофосфатов хорошо растворимы в воде.
Слайд 12 Выводы
Фосфорная кислота – белое, кристаллическое вещество, смешивающееся с водой в

любых соотношениях.
Проявляет общие свойства характерные для всех кислот.
Обладает специфическими свойствами.
Образует три ряда солей: фосфаты, гидрофосфаты, дигидрофосфаты.











 Изучение особенностей агрессивного поведения у подростков
Изучение особенностей агрессивного поведения у подростков Новости современной медицинской науки
Новости современной медицинской науки Культурно-визуальная составляющая события
Культурно-визуальная составляющая события Человек – житель биосферы
Человек – житель биосферы АСВ-Техникс
АСВ-Техникс Православная икона
Православная икона Я ЧЕЛОВЕК – У МЕНЯ ЕСТЬ ПРАВА!
Я ЧЕЛОВЕК – У МЕНЯ ЕСТЬ ПРАВА! Импульс тела. Закон сохранения импульса
Импульс тела. Закон сохранения импульса Добро пожаловать!
Добро пожаловать! Дисциплинарная ответственность судей, предусмотренная за совершение дисциплинарного проступка . Механизм наложения взыскания
Дисциплинарная ответственность судей, предусмотренная за совершение дисциплинарного проступка . Механизм наложения взыскания Журнальный столик
Журнальный столик Портативные анализаторы для мобильной лаборатории
Портативные анализаторы для мобильной лаборатории Исламский мир
Исламский мир «Моя территория»
«Моя территория» ГОУ НПО ПУ-8 города Шагонара.Профессия: «Слесарь по ремонту автомобилей»,на базе основного общего образования без получения средн
ГОУ НПО ПУ-8 города Шагонара.Профессия: «Слесарь по ремонту автомобилей»,на базе основного общего образования без получения средн Basics of marketing
Basics of marketing Алые паруса мечты Александра Грина
Алые паруса мечты Александра Грина Бутерброд
Бутерброд Презентация на тему Комменсализм
Презентация на тему Комменсализм 1
1 ПРЕЗЕНТАЦИЯ концессионного проекта АО «Батыс транзит»: Строительство и эксплуатация межрегиональной линии электропередачи «Се
ПРЕЗЕНТАЦИЯ концессионного проекта АО «Батыс транзит»: Строительство и эксплуатация межрегиональной линии электропередачи «Се Презентация на тему Жизненный цикл клетки. Митоз. Амитоз (10 класс)
Презентация на тему Жизненный цикл клетки. Митоз. Амитоз (10 класс) Растительный мир родного края (4 класс)
Растительный мир родного края (4 класс) Переход права на земельный участок при переходе права собственности на здание, сооружение
Переход права на земельный участок при переходе права собственности на здание, сооружение I mobili della casa
I mobili della casa KEROPUR® Многофункциональные пакеты присадок к бензину
KEROPUR® Многофункциональные пакеты присадок к бензину англ2
англ2 Из истории физической культуры. Развитие физической культуры в России XVII – XIX веков
Из истории физической культуры. Развитие физической культуры в России XVII – XIX веков