Содержание
- 2. Оглавление Аллотропия. Аллотропные модификации кислорода. История открытия кислорода и озона. Нахождение в природе. Строение молекулы. Физические
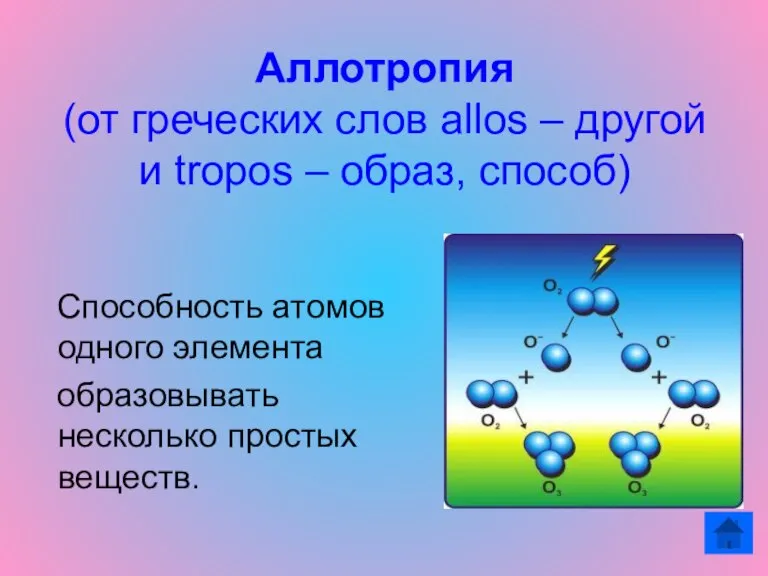
- 3. Аллотропия (от греческих слов allos – другой и tropos – образ, способ) Способность атомов одного элемента
- 4. Аллотропные модификации кислорода. О2 кислород (простое вещество) К. В. Шееле 1772 г. Дж. Пристли 1774 г.
- 5. 1772 год. Карл Вильгельм Шееле (шведский учёный) хотел раскрыть загадку огня и при этом неожиданно обнаружил,
- 6. 1774 год. Джозеф Пристли, изучая состав воздуха, пытался выяснить, какие его составляющие могут выделиться из химических
- 7. Впервые количественный состав воздуха установил французский ученый Антуан Лоран Лавуазье ( 1775 г. ) По результатам
- 8. Впервые озон обнаружил в 1785 голландский физик М. ван Марум по характерному запаху (свежести) и окислительным
- 9. ( 1799 – 1868 ) Кристиан Фридрих Шёнбей Термин озон предложен немецким химиком X.Ф. Шёнбейном в
- 10. Нахождение в природе. О2 Воздух – 21% по объёму 23% по массе. О3 Атмосфера (верхний слой)
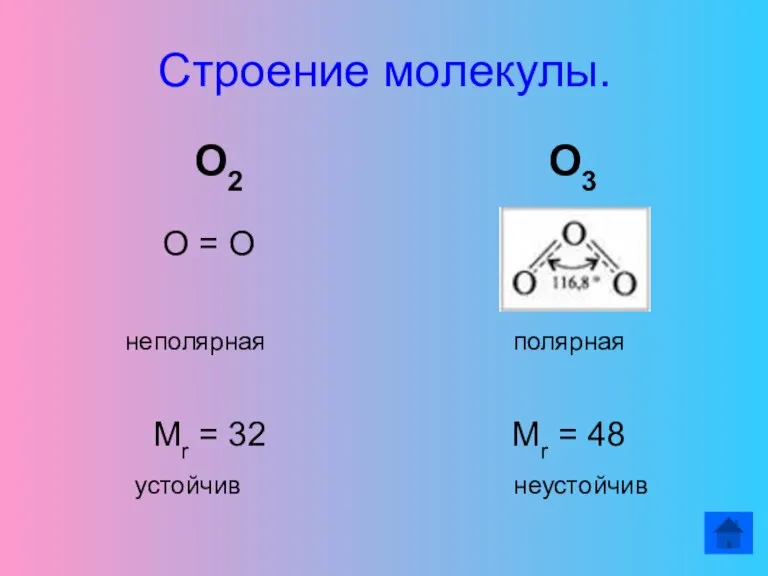
- 11. Строение молекулы. О2 О3 О = О неполярная полярная Mr = 32 Mr = 48 устойчив
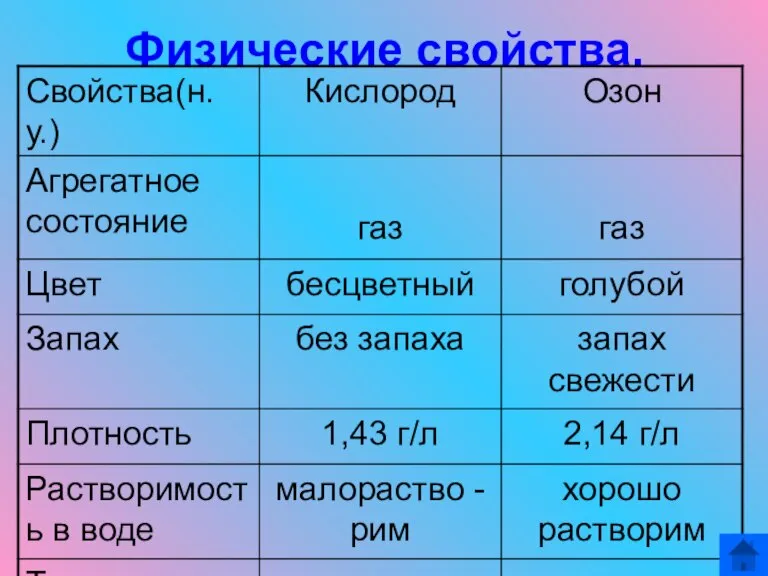
- 12. Физические свойства.
- 13. Химические свойства О2 Сильный окислитель, но не окисляет Au и Pt, окисляет многие металлы, образуя оксиды.
- 14. Получение в природе. О2 6СО2 + 6Н2О = С6Н12О6 + 6О2 Процесс фотосинтеза. О3 3О2 ⇄
- 15. Значение кислорода и озона в природе. О2 дыхание (животные) О2 гемоглобин Н2О + СО2 хлорофилл фотосинтез
- 16. Проверь себя! 1. Что такое аллотропия? 2. Назовите фамилии трех ученых, открывших кислород. 3. В результате
- 17. Литература, интернет-ресурсы. О.С.Габриелян « Химия. 9 кл.» М. Дрофа, 2010 г.. Ю.М.Малиновская «Химия. 6 кл.» (пропедевтический
- 19. Скачать презентацию













 Презентация на тему Опасна ли гроза
Презентация на тему Опасна ли гроза Redaktiruemy_beydzh
Redaktiruemy_beydzh Физкультура. Виды плаванья
Физкультура. Виды плаванья О некоторых итогах участия МИП СФО в реализации государственных программ Фонда содействия развитию МП в НТС
О некоторых итогах участия МИП СФО в реализации государственных программ Фонда содействия развитию МП в НТС Письмо пером - за и против
Письмо пером - за и против Tin cup design
Tin cup design Транспорт. Виды транспорта
Транспорт. Виды транспорта Новый стандарт: обучаем и учимся
Новый стандарт: обучаем и учимся Конституционное право. Принцип дисконтинуитета. Перспективы развития в Российской Федерации
Конституционное право. Принцип дисконтинуитета. Перспективы развития в Российской Федерации Виды рабочей одежды
Виды рабочей одежды Я люблю тебя, Сакский район!
Я люблю тебя, Сакский район! Что такое значение?От П.Грайса к теории игр.
Что такое значение?От П.Грайса к теории игр. Тема лекции:«Прикладная информатика в табличном процессоре»
Тема лекции:«Прикладная информатика в табличном процессоре» Структура Комитета торговли Министерства экономического развития и торговли Республики Казахстан
Структура Комитета торговли Министерства экономического развития и торговли Республики Казахстан Презентация на тему Информация в природе, обществе и технике
Презентация на тему Информация в природе, обществе и технике Основы коммуникативной компетентности педагогов
Основы коммуникативной компетентности педагогов Хочу отдыхать
Хочу отдыхать Урок по рассказам И.А. Бунина о любви
Урок по рассказам И.А. Бунина о любви Русская изба – поэтапное рисование
Русская изба – поэтапное рисование Известные люди Австрии
Известные люди Австрии 3-й КОНКУРСНЫЙ НАБОР ПРОЕКТНЫХ ПРЕДЛОЖЕНИЙПОДГОТОВКА ПРИЛОЖЕНИЯ B: БЮДЖЕТ И ПРИЕМЛЕМОСТЬ РАСХОДОВБеларусь, 30.03.2012 – 05.04.2012
3-й КОНКУРСНЫЙ НАБОР ПРОЕКТНЫХ ПРЕДЛОЖЕНИЙПОДГОТОВКА ПРИЛОЖЕНИЯ B: БЮДЖЕТ И ПРИЕМЛЕМОСТЬ РАСХОДОВБеларусь, 30.03.2012 – 05.04.2012 Викторина по произведениям А.П.Чехова « Смешные рассказы»
Викторина по произведениям А.П.Чехова « Смешные рассказы» Объединение «Грамматландия» Составила: Мануйлова Н. В. 2011 г.
Объединение «Грамматландия» Составила: Мануйлова Н. В. 2011 г. ЮТА (2)
ЮТА (2) Многообразие компьютеров
Многообразие компьютеров Похищение человека
Похищение человека Понятие и особенности административно правовой нормы
Понятие и особенности административно правовой нормы Техника мраморирования в современном дизайне
Техника мраморирования в современном дизайне