Содержание
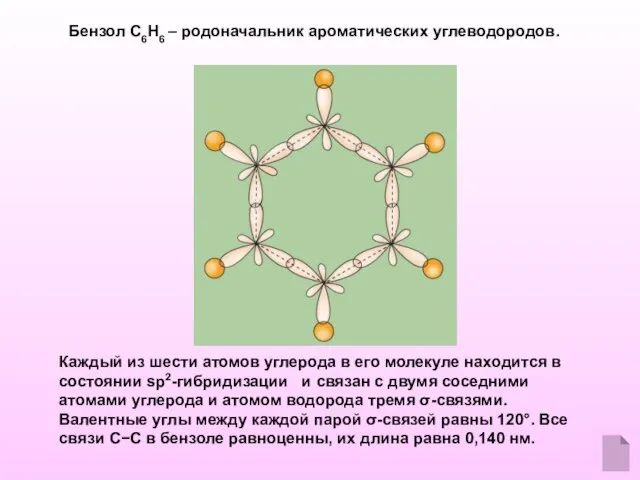
- 2. Каждый из шести атомов углерода в его молекуле находится в состоянии sp2-гибридизации и связан с двумя
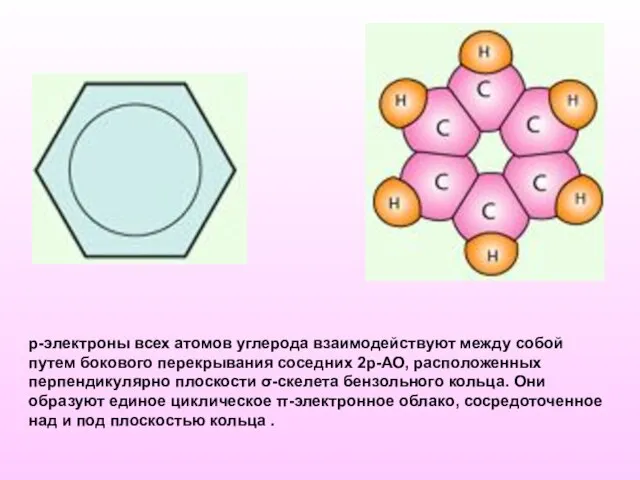
- 3. р-электроны всех атомов углерода взаимодействуют между собой путем бокового перекрывания соседних 2р-АО, расположенных перпендикулярно плоскости σ-скелета
- 4. Гомологи бензола – соединения, образованные заменой одного или нескольких атомов водорода в молекуле бензола на углеводородные
- 5. Химические свойства Для ароматических соединений наиболее типичны реакции электрофильного замещения. Другие реакции (присоединение, окисление) идут с
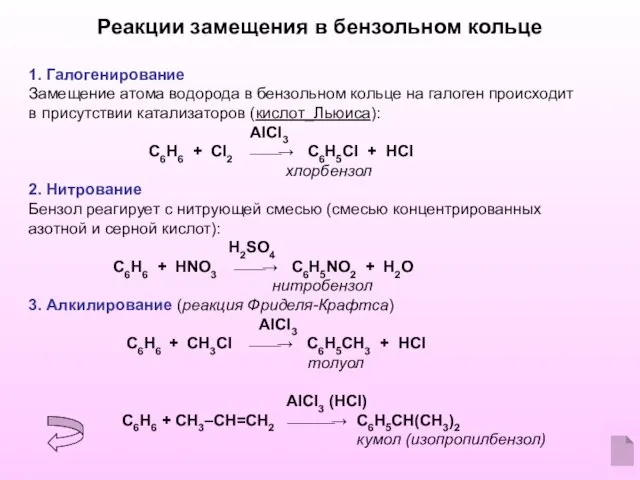
- 6. Реакции замещения в бензольном кольце 1. Галогенирование Замещение атома водорода в бензольном кольце на галоген происходит
- 7. Замещение в алкилбензолах Гомологи бензола (алкилбензолы) С6Н5–R более активно вступают в реакции замещения по сравнению с
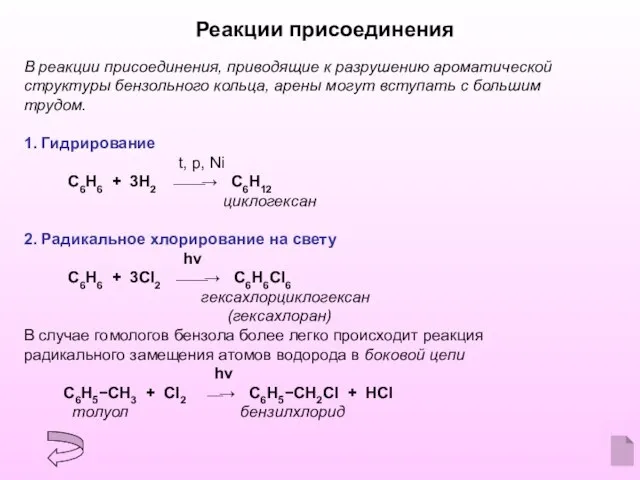
- 8. Реакции присоединения В реакции присоединения, приводящие к разрушению ароматической структуры бензольного кольца, арены могут вступать с
- 9. Реакции окисления Бензол не окисляется даже под действием сильных окислителей (KMnO4, K2Cr2O7 и т.п.). Поэтому он
- 10. Реакции окисления
- 11. Реакции окисления
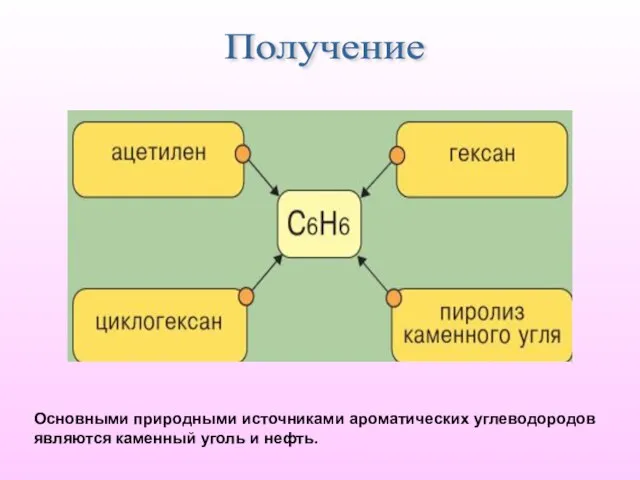
- 12. Получение Основными природными источниками ароматических углеводородов являются каменный уголь и нефть.
- 13. 1. При коксовании каменного угля образуется каменноугольная смола, из которой выделяют бензол, толуол, ксилолы, нафталин и
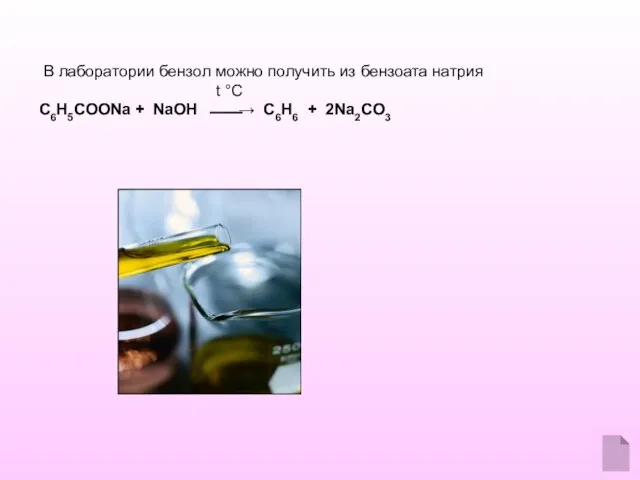
- 14. В лаборатории бензол можно получить из бензоата натрия t °C C6H5COONa + NaOH ⎯⎯→ C6H6 +
- 15. Бензол С6Н6 используется как исходный продукт для получения различных ароматических соединений – нитробензола, хлорбензола, анилина, фенола,
- 16. Толуол С6Н5−СН3 применяется в производстве красителей, лекарственных и взрывчатых веществ (тротил, тол).
- 18. Скачать презентацию









 Перспектива. Построение объектов
Перспектива. Построение объектов Участие в проектах
Участие в проектах Школьная форма
Школьная форма Учитель начальных классов МОУ СОШ №8 Оладько Валентина Николаевна
Учитель начальных классов МОУ СОШ №8 Оладько Валентина Николаевна Блок системы взаимоотношений
Блок системы взаимоотношений Мойте руки перед едой или простые правила гигиены
Мойте руки перед едой или простые правила гигиены Українська блоґосфера і ведення блоґів
Українська блоґосфера і ведення блоґів Обменять значения двух переменных, используя третью (буферную) переменную
Обменять значения двух переменных, используя третью (буферную) переменную Студенчество - дивная пора
Студенчество - дивная пора Что такое бездушие
Что такое бездушие Аффект неадекватности Неймарк – показатель капитализации человеческих ресурсов
Аффект неадекватности Неймарк – показатель капитализации человеческих ресурсов Национальные особенности продаж
Национальные особенности продаж Военная техника ВОВ
Военная техника ВОВ В.Н.ДеминТАЙНЫ ВСЕЛЕННОЙ
В.Н.ДеминТАЙНЫ ВСЕЛЕННОЙ Этапы сопровождения семей, имеющих ребенка с РАС
Этапы сопровождения семей, имеющих ребенка с РАС Василий Макарович Шукшин 10 класс
Василий Макарович Шукшин 10 класс Резьба
Резьба Пороки дерева и древесины
Пороки дерева и древесины Материальные и информационные модели
Материальные и информационные модели Мое хобби - мой бизнес. Свадебные мелочи
Мое хобби - мой бизнес. Свадебные мелочи РЕФЛЕКСИЯ
РЕФЛЕКСИЯ Смерть и бессмертие
Смерть и бессмертие Автоматизация редактирования
Автоматизация редактирования Живопись старых мастеров. Техника и технология
Живопись старых мастеров. Техника и технология Системы безопасности
Системы безопасности Правоотношения и субъекты права
Правоотношения и субъекты права Виды спектров. Спектральный анализ
Виды спектров. Спектральный анализ Английский язык вне Англии
Английский язык вне Англии