Содержание
- 2. "Жизнь — это открытые саморегулирующиеся и самовоспроизводящиеся системы совокупностей живых организмов, построенные из сложных биологических полимеров
- 3. Белки— высокомолекулярные органические соединения – (ВМС), нерегулярные биополимеры, состоящие из мономеров- аминокислот, соединенных пептидной связью. В
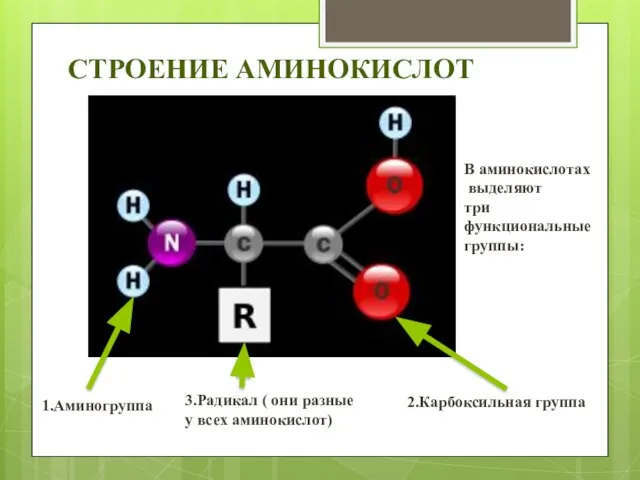
- 4. СТРОЕНИЕ АМИНОКИСЛОТ В аминокислотах выделяют три функциональные группы: 1.Аминогруппа 2.Карбоксильная группа 3.Радикал ( они разные у
- 5. Не могут быть синтезированы в организме. Поэтому их поступление в организм с пищей необходимо. Незаменимыми для
- 6. ПЕПТИДНАЯ СВЯЗЬ Пептидная связь — вид амидной связи, возникающей при образовании белков и пептидов в результате
- 7. Свойства Размер белка может измеряться количеством аминокислот Самый большой из известных в настоящее время белков —
- 8. Денатурация. Резкое изменение условий, например, нагревание или обработка белка кислотой или щёлочью приводит к потере четвертичной,
- 9. Б Е Л К И Простые Состоят только из аминокислотных остатков Сложные могут включать: - ионы
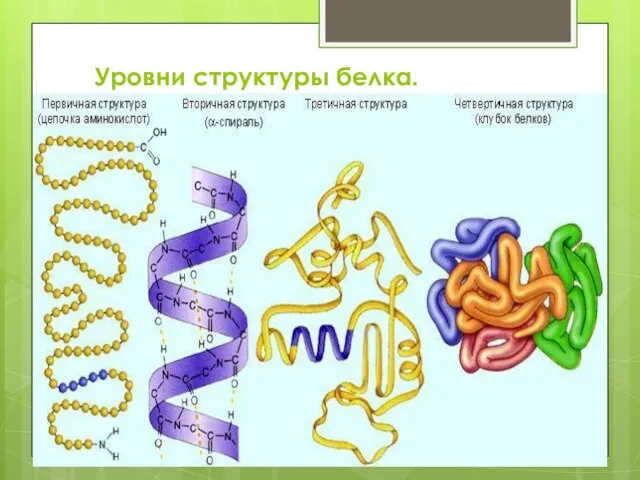
- 10. Уровни структуры белка.
- 11. Первичная структура — последовательность аминокислот в полипептидной цепи. Определяется и соответствует последовательности нуклеотидов в молекуле ДНК
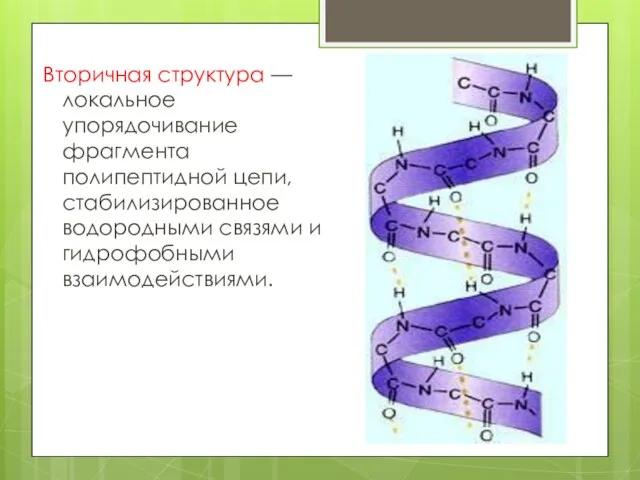
- 12. Вторичная структура — локальное упорядочивание фрагмента полипептидной цепи, стабилизированное водородными связями и гидрофобными взаимодействиями.
- 13. Третичная структура — пространственное строение полипептидной цепи — взаимное расположение элементов вторичной структуры, стабилизированное взаимодействием между
- 14. Четверичная структура — субъединичная структура белка. Взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса.
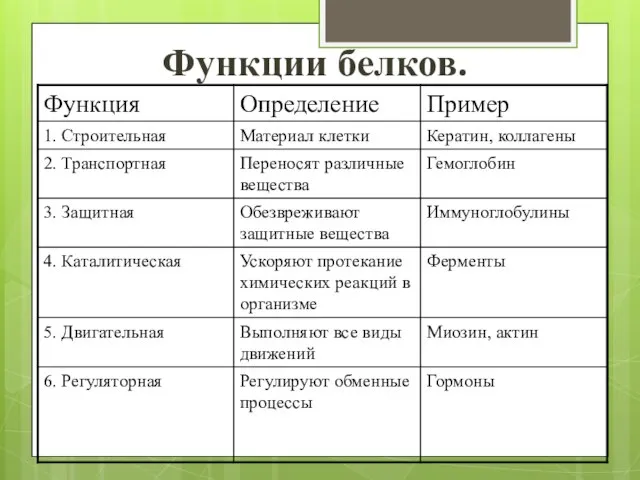
- 15. Функции белков.
- 17. ЧТО ОБЩЕГО У ЛЮДЕЙ НА ПРЕДЫДУЩЕМ СЛАЙДЕ? КАК ЭТИ ФОТОГРАФИИ СВЯЗАНЫ С ТЕМОЙ УРОКА?
- 18. ИТОГИ УРОКА: 1.Что узнали? 2.Для чего это нужно? 3.Насколько это важно? 4.Как вас изменили эти знания?
- 20. Скачать презентацию













 Первый питательный крем от Anew - Ультра-Питание
Первый питательный крем от Anew - Ультра-Питание American Society Demographics
American Society Demographics  Презентация на тему Бородинская битва 4 класс
Презентация на тему Бородинская битва 4 класс Девиантное поведение
Девиантное поведение КУЛЬТУРА РОССИИ XIV — XVI ВЕКА
КУЛЬТУРА РОССИИ XIV — XVI ВЕКА Дефекты в кристаллах
Дефекты в кристаллах «Разработка Единой медицинской информационной системы на платформе 1С:Предприятие»
«Разработка Единой медицинской информационной системы на платформе 1С:Предприятие» Разработка и вывод на рынок аппарата плазменной коагуляции, на основе низкотемпературной плазмы
Разработка и вывод на рынок аппарата плазменной коагуляции, на основе низкотемпературной плазмы Презентация на тему Модест Петрович Мусоргский
Презентация на тему Модест Петрович Мусоргский Компьютерные вирусы
Компьютерные вирусы Дополнительные цвета
Дополнительные цвета Конституция Российской Федерации: государственные символы России
Конституция Российской Федерации: государственные символы России урок 15_ — копия _2_
урок 15_ — копия _2_ В землянке
В землянке Самсон
Самсон Моя наука
Моя наука Назарларыңызға әлемдегі 10 сәнді банкноттар жайлы
Назарларыңызға әлемдегі 10 сәнді банкноттар жайлы Французское искусство XVII века
Французское искусство XVII века Презентация на тему кпд тепловых двигателей 8 класс
Презентация на тему кпд тепловых двигателей 8 класс  Организационно-правовые основы деятельности первичной профсоюзной организации
Организационно-правовые основы деятельности первичной профсоюзной организации Кошки и собаки
Кошки и собаки Эффективное обшение
Эффективное обшение Права ребенка
Права ребенка Презентация на тему Природное и культурное наследие России
Презентация на тему Природное и культурное наследие России  Между парадигмами. Особенности исследования того, что еще не стало мейнстримом
Между парадигмами. Особенности исследования того, что еще не стало мейнстримом Культурология как наука
Культурология как наука Что изучает ФИЗИКА ?
Что изучает ФИЗИКА ? Звукопоглощающие материалы и конструкции
Звукопоглощающие материалы и конструкции