Содержание
- 2. Белки (полипептиды) − биополимеры, построенные из остатков α-аминокислот, соединенных пептидными связями. Пептидной связью называют амидную связь
- 3. Схема образования полипептида
- 4. Макромолекулы белков имеют строго упорядоченное химическое и пространственное строение, исключительно важное для проявления ими определенных биологических
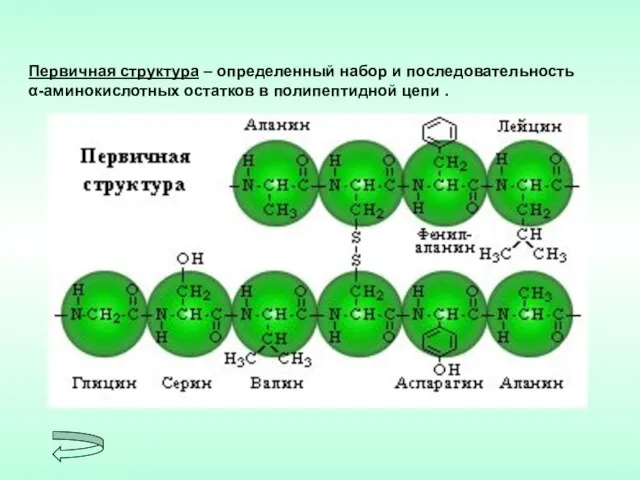
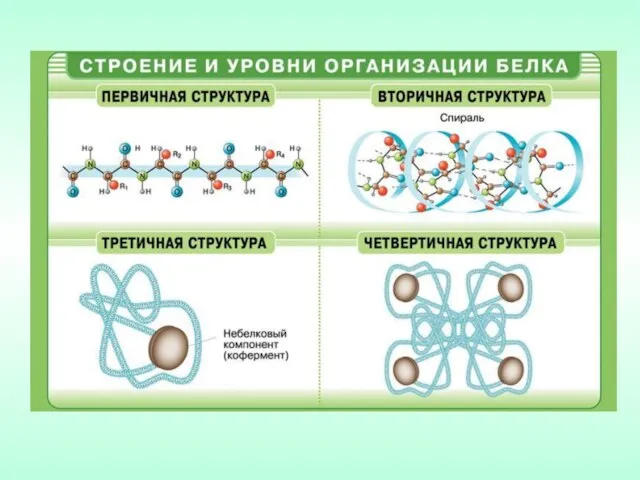
- 5. Первичная структура – определенный набор и последовательность α-аминокислотных остатков в полипептидной цепи .
- 6. Вторичная структура – конформация полипептидной цепи, закрепленная множеством водородных связей между группами N–H и С=О. Одна
- 7. Третичная структура – форма закрученной спирали в пространстве, образованная главным образом за счет дисульфидных мостиков -S-S-,
- 8. Четвертичная структура – агрегаты нескольких белковых макромолекул (белковые комплексы), образованные за счет взаимодействия разных полипептидных цепей.
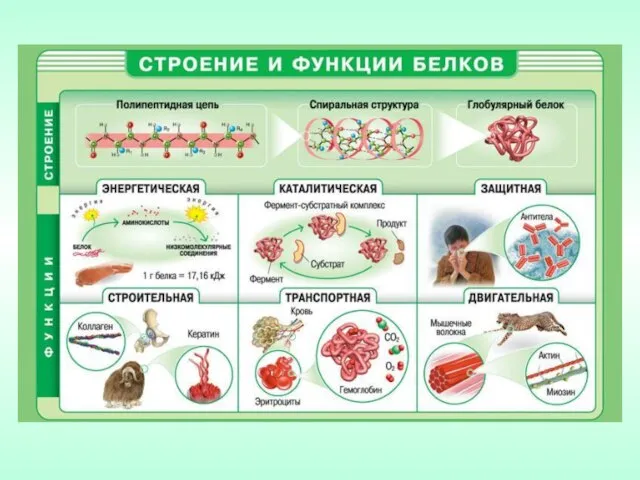
- 10. Функции белков в природе: каталитические (ферменты); регуляторные (гормоны); структурные (кератин шерсти, фиброин шелка, коллаген); двигательные (актин,
- 12. Гидролиз При гидролизе белков образуются аминокислоты. Денатурация. При нагревании белков происходит разрушение сначала четвертичной, потом третичной
- 15. Скачать презентацию









 Мировые океаны
Мировые океаны Силы природы
Силы природы Семейная викторина
Семейная викторина Вторая мировая война
Вторая мировая война Типичные ошибкипри проведении экспертизы
Типичные ошибкипри проведении экспертизы Фалсафа - 5
Фалсафа - 5 Москва
Москва Переломы пястных костей и фаланг пальцев
Переломы пястных костей и фаланг пальцев Персональный имидж учителя как средство формирования КОРПОРАТИВНОГО имиджа школы
Персональный имидж учителя как средство формирования КОРПОРАТИВНОГО имиджа школы Какая бывает промышленность?
Какая бывает промышленность? Функция
Функция Переосмысление образовательной среды. Реиновация интерьера холла колледжа
Переосмысление образовательной среды. Реиновация интерьера холла колледжа Клод Моне
Клод Моне Отряды млекопитающих
Отряды млекопитающих Что такое углеволокно (карбон) и как оно может спасти нас от нефтяного кризиса
Что такое углеволокно (карбон) и как оно может спасти нас от нефтяного кризиса Техника безопасности и форма одежды на уроках лыжной подготовки в школе
Техника безопасности и форма одежды на уроках лыжной подготовки в школе Рычаг и его удивительные свойства
Рычаг и его удивительные свойства Культура и искусство Китая
Культура и искусство Китая Виды дохода
Виды дохода 1. Икар хочет летать. 2. Поросёнок делает себе крылья. 3. Икар летит и падает. 4. Мама успокаивает поросёнка. 5. Волшебный источник хвали
1. Икар хочет летать. 2. Поросёнок делает себе крылья. 3. Икар летит и падает. 4. Мама успокаивает поросёнка. 5. Волшебный источник хвали Приемы мотивации. Диалоги на полях: чему нам имеет смысл учиться у тех, кого мы учим?
Приемы мотивации. Диалоги на полях: чему нам имеет смысл учиться у тех, кого мы учим? Аналитическая система мониторинга розничных продаж и управления клиентами
Аналитическая система мониторинга розничных продаж и управления клиентами Проблемное обучение
Проблемное обучение Применение производной в физике
Применение производной в физике Заповедники Архангельской области
Заповедники Архангельской области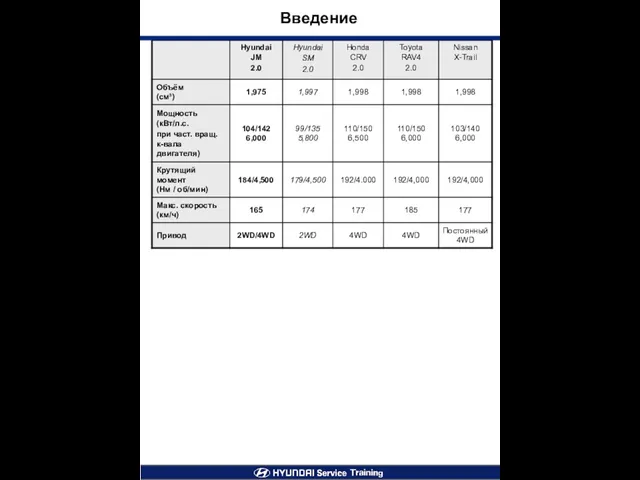 Введение
Введение Электронная коммерцияв розничных сетях VI конференция "Электроника: производство и торговля" 20 ноября 2009
Электронная коммерцияв розничных сетях VI конференция "Электроника: производство и торговля" 20 ноября 2009 Ломоносов и география
Ломоносов и география