Содержание
- 2. Отличия ферментов от небиологических катализаторов Удивительная эффективность ферментов Число оборотов некоторых ферментов
- 3. Отличия ферментов от небиологических катализаторов Ферменты обладают высокой субстратной специфичностью Ферменты обладают высокой специфичностью к типу
- 4. Отличия ферментов от небиологических катализаторов Составные ферменты: белковая часть обеспечивает связывание субстрата, а катализ осуществляют небелковые
- 5. Коферменты и витамины Витаминами можно назвать некую группу низкомолекулярных органических соединений различной химической природы, необходимых для
- 6. Коферменты и витамины Если несколько соединений близкой химической природы выполняют одну и ту же витаминную функцию
- 7. Коферменты и витамины Собственно витамины — это соединения, выполняющие свою витаминную роль самостоятельно. Витамины-коферменты — соединения,
- 8. Коферменты и витамины Следует выделить отдельно группу коферментов, т.е. тех соединений, которые образованы из соответствующих витаминов
- 9. Коферменты и витамины
- 10. Коферменты и витамины
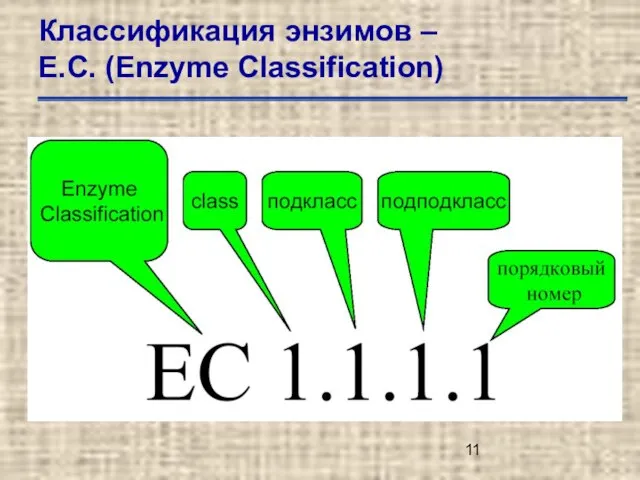
- 11. Классификация энзимов – Е.С. (Enzyme Classification)
- 12. Классификация энзимов – Е.С. (Enzyme Classification) Е.С.1. – оксидоредуктазы (oxidoreductases). Е.С.2. – трансферазы (transferases). Е.С.3. –
- 13. Оксиредуктазы Дегидрогеназы (редуктазы) Оксидазы Пероксидазы Гидроксилазы Оксигеназы Гидрогеназы
- 14. Оксиредуктазы Е.С.1.1. – действует на СН-ОН функцию Е.С.1.2. – действует на альдегидную группу Е.С.1.3. – действует
- 15. Оксиредуктазы Е.С.1.1.1. – NAD+ или NADP+ Е.С.1.1.2. – цитохромом Е.С.1.1.3. – кислородом Е.С.1.1.4. – дисульфидом Е.С.1.1.5.
- 16. Оксиредуктазы Е.С.1.1.1.1. – алкоголь дегидрогеназа NAD+ Е.С.1.1.1.2. – алкоголь дегидрогеназа NADP+ …………………………………………………. Е.С.1.1.1.27 – L-лактат дегидрогеназа
- 17. Оксиредуктазы Е.С.1.1.1.1
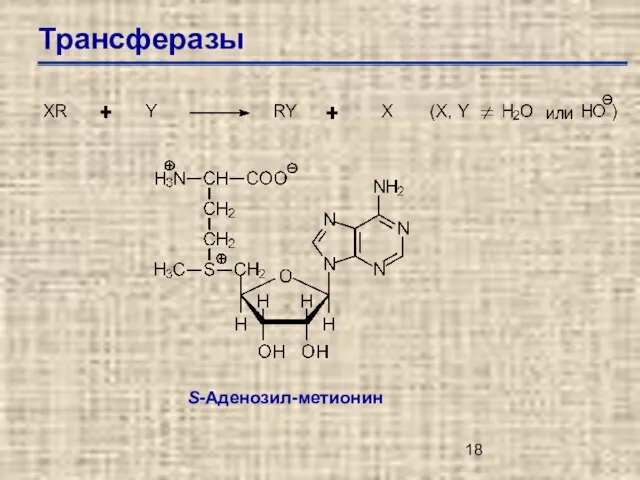
- 18. Трансферазы S-Аденозил-метионин
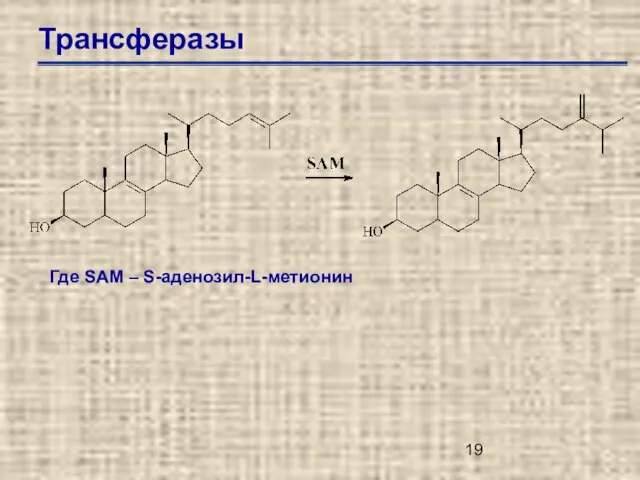
- 19. Трансферазы Где SAM – S-аденозил-L-метионин
- 20. Трансферазы Е.С.2.1. – переносчики одно-углеродной группы Е.С.2.2. – переносчики карбонильных функций Е.С.2.3. – ацетилтрансферазы Е.С.2.4. –
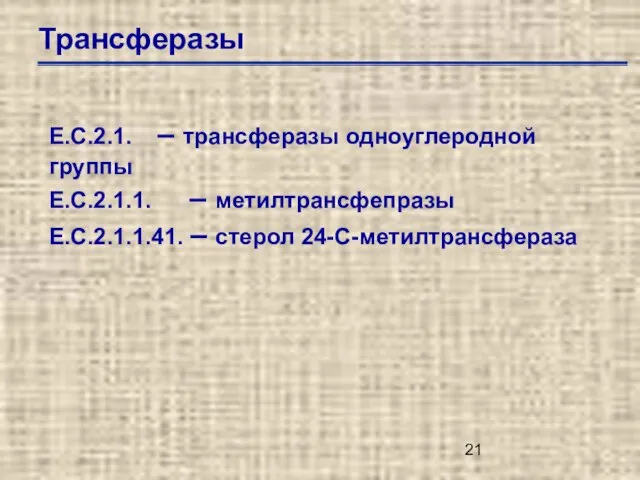
- 21. Трансферазы Е.С.2.1. – трансферазы одноуглеродной группы Е.С.2.1.1. – метилтрансфепразы Е.С.2.1.1.41. – стерол 24-С-метилтрансфераза
- 22. Гидролазы Протеазы – гидролизуют белки Нуклеазы – гидролизуют нуклеиновые кислоты Специфические эндонуклеазы (так называемые рестриктазы) –
- 23. Гидролазы Е.С.3.1. – действуют на сложноэфирные связи, эстеразы Е.С.3.2. – гликозилазы Е.С.3.3. – действуют на простоэфирные
- 24. Гидролазы Е.С.3.1 гидролазы действующие на сложноэфирную связь Е.С.3.1.1. гидролазы эфиров карбоновых кислот Е.С.3.1.1.1 карбоксилэстеразы RCOOR1 +
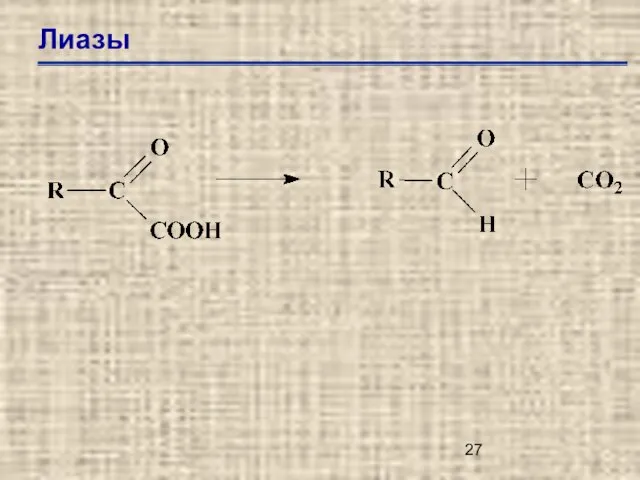
- 25. Лиазы Е.С.4.1. – углерод-углеродные лиазы Е.С.4.2. – углерод-кислородные лиазы Е.С.4.3. – углерод-азотные лиазы Е.С.4.4. – углерод-серы
- 26. Лиазы Е.С.4.1.1. – карбокси лиазы Е.С.4.1.2. – альдегид лиазы Е.С.4.1.3. – оксо-кислотные лиазы Е.С.4.1.99. – другие
- 27. Лиазы
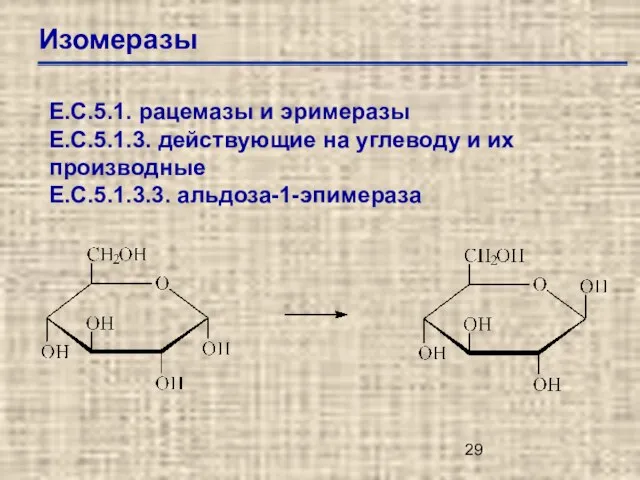
- 28. Изомеразы Е.С.5.1. – рацемазы и эпимеразы Е.С.5.2. – цис-трас-изомеразы Е.С.5.3. – внутримолекулярные оксидоредуктазы Е.С.5.4. – внутримолекулярные
- 29. Изомеразы Е.С.5.1. рацемазы и эримеразы Е.С.5.1.3. действующие на углеводу и их производные Е.С.5.1.3.3. альдоза-1-эпимераза
- 30. Лигазы (синтетазы) Е.С.6.1. – образуют углерод-кислородные связи Е.С.6.2. – образуют углерод-сера связи Е.С.6.3. – образуют углерод-азотные
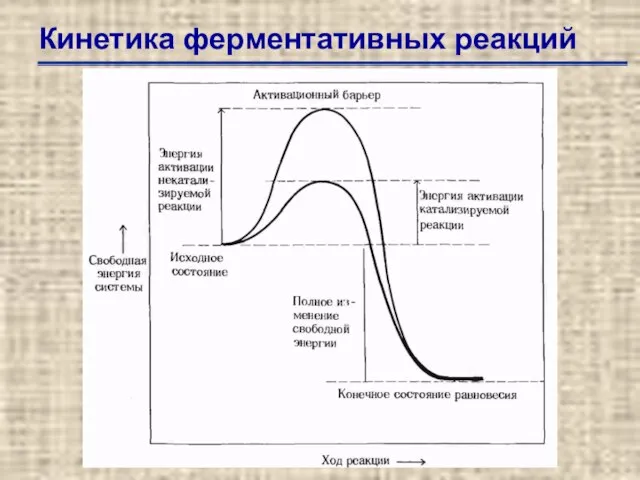
- 31. Кинетика ферментативных реакций
- 32. Кинетика ферментативных реакций Влияние концентрации субстрата на начальную скорость катализируемой ферментом реакции. Из такого графика можно
- 33. Кинетика ферментативных реакций Виктор Генри (1903 г.) Леонор Михаэлис, Мод Ментен (1913 г.)
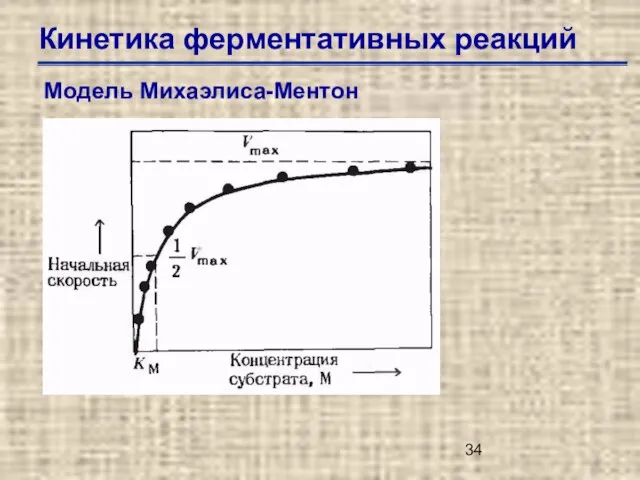
- 34. Кинетика ферментативных реакций Модель Михаэлиса-Ментон
- 35. Кинетика ферментативных реакций Модель Михаэлиса-Ментон Км (константа Михаэлиса-Ментен) –концентрация специфического субстрата, при которой данный фермент обеспечивает
- 36. Кинетика ферментативных реакций Модель Михаэлиса-Ментон Уравнение Михаэлиса-Ментен где v0 начальная скорость при концентрации субстрата [S], Vmax
- 37. Кинетика ферментативных реакций Модель Михаэлиса-Ментон
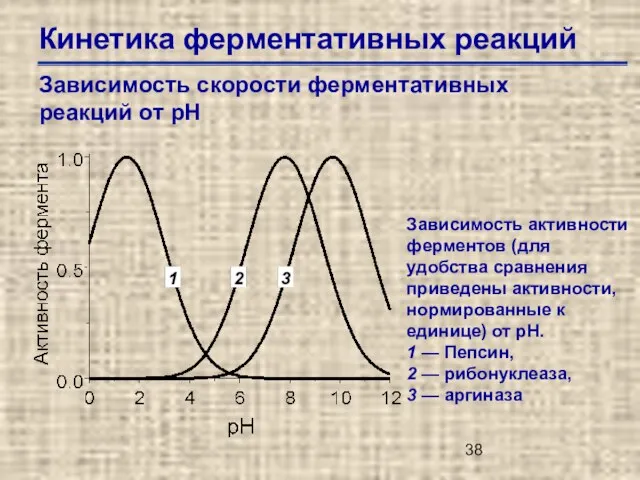
- 38. Кинетика ферментативных реакций Зависимость скорости ферментативных реакций от рН Зависимость активности ферментов (для удобства сравнения приведены
- 39. Кинетика ферментативных реакций Зависимость скорости ферментативных реакций от рН Оптимальные значения рН для некоторых ферментов
- 40. Кинетика ферментативных реакций Количество фермента можно определить по его активности За единицу активности фермента принимается такое
- 41. Специфичность ферментов по отношению к субстратам
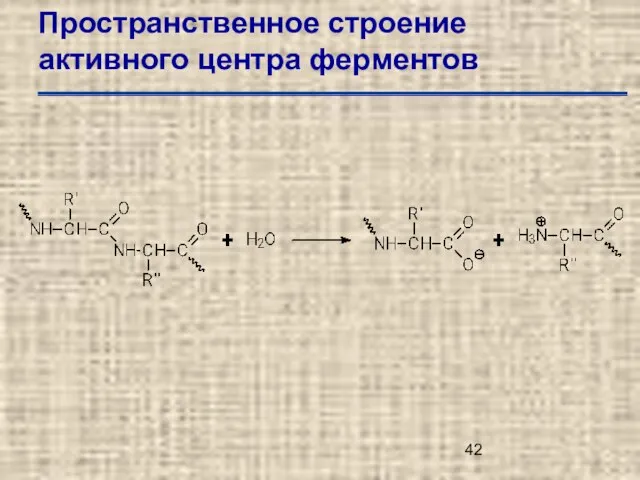
- 42. Пространственное строение активного центра ферментов
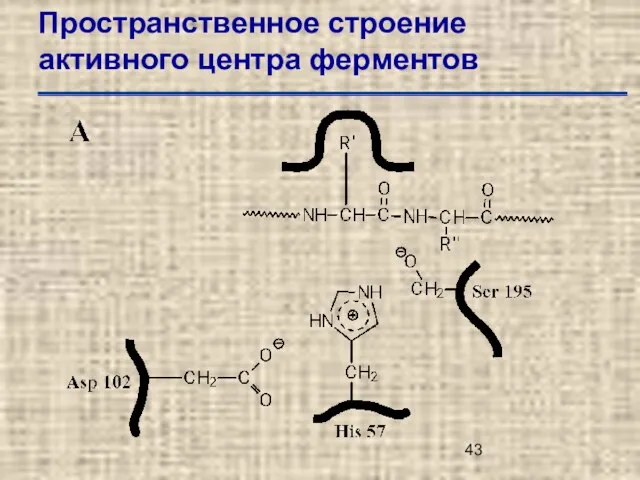
- 43. Пространственное строение активного центра ферментов
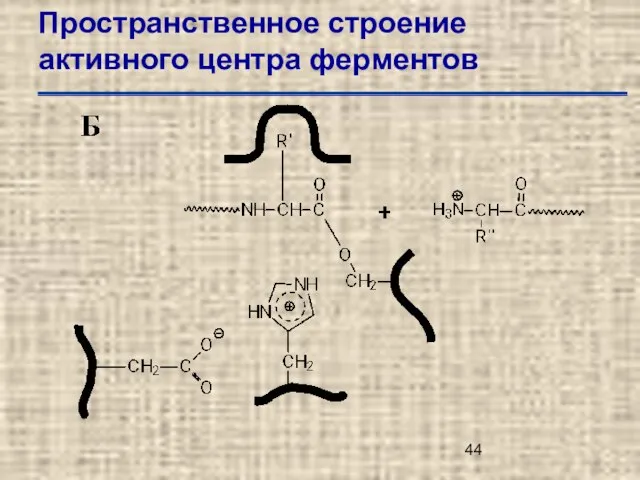
- 44. Пространственное строение активного центра ферментов
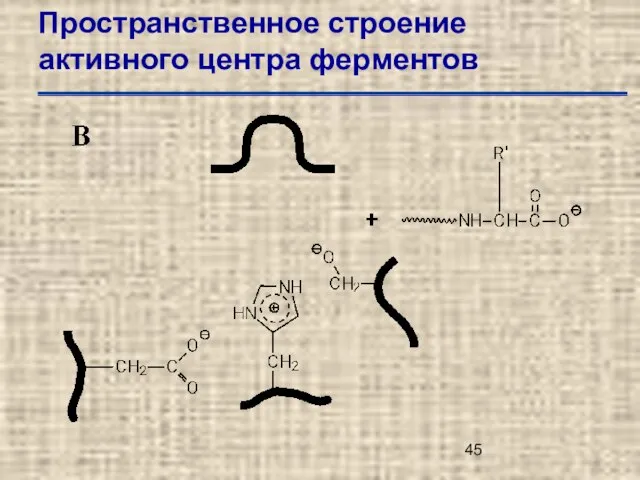
- 45. Пространственное строение активного центра ферментов
- 46. Пространственное строение активного центра ферментов
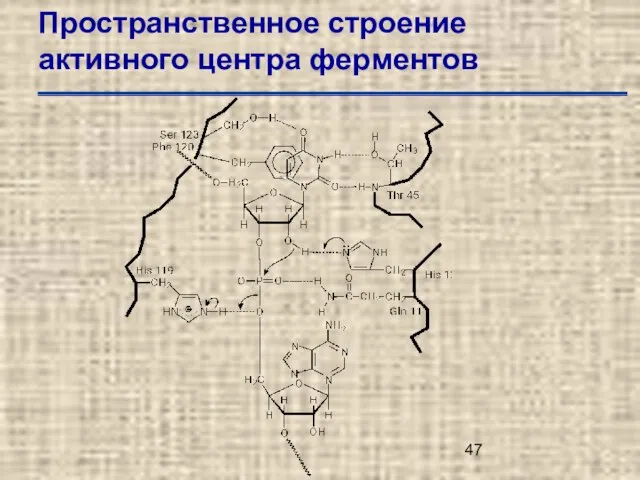
- 47. Пространственное строение активного центра ферментов
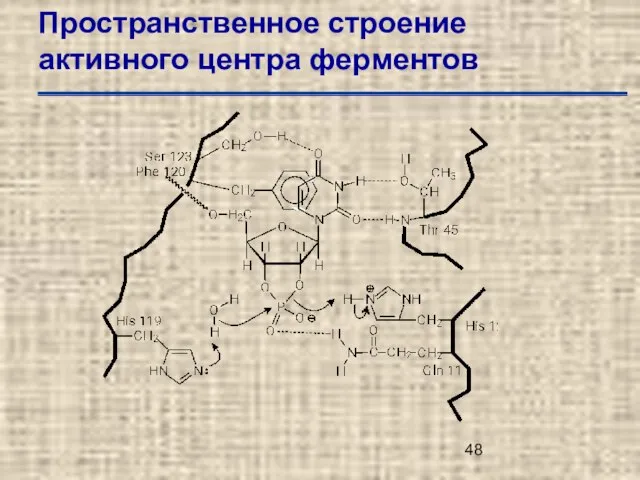
- 48. Пространственное строение активного центра ферментов
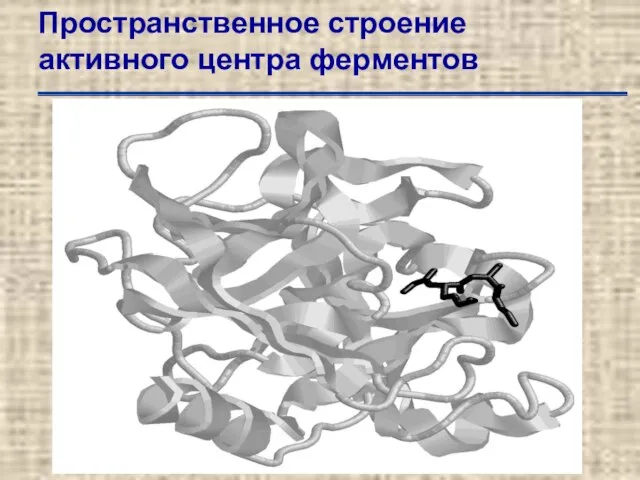
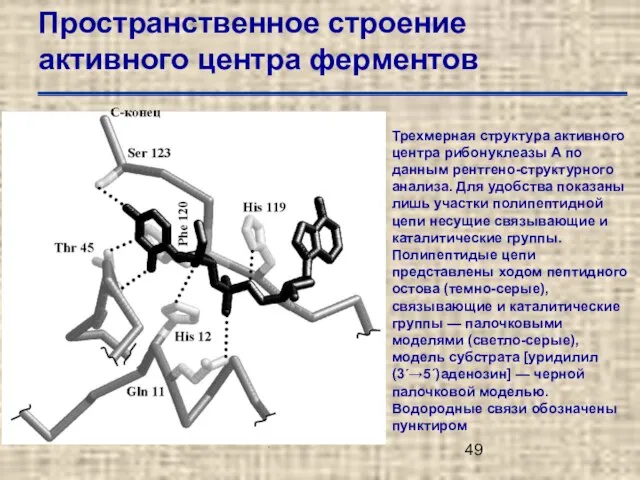
- 49. Пространственное строение активного центра ферментов Трехмерная структура активного центра рибонуклеазы А по данным рентгено-структурного анализа. Для
- 50. Пространственное строение активного центра ферментов Укладка субстрата [аденилил(3´→5´)уридилил (3´→ 5´)аденилил(3´→5´) аденозина] в третичной структуре фермента
- 52. Скачать презентацию































![Пространственное строение активного центра ферментов Укладка субстрата [аденилил(3´→5´)уридилил (3´→ 5´)аденилил(3´→5´) аденозина] в третичной структуре фермента](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/410292/slide-49.jpg)
 Развивающая игра Чего не хватает?
Развивающая игра Чего не хватает? DSM_040822_
DSM_040822_ Внедрение новой модели по управлению комплексной безопасностью
Внедрение новой модели по управлению комплексной безопасностью Презентация на тему Разделительный мягкий знак
Презентация на тему Разделительный мягкий знак  Шрифт Брайля
Шрифт Брайля Региональный конкурс на лучшую организацию работы по подготовке учащихся к военной службе
Региональный конкурс на лучшую организацию работы по подготовке учащихся к военной службе  Minsk. Capitale de Bielorussie
Minsk. Capitale de Bielorussie Праздник 1 Мая
Праздник 1 Мая Наш Брянск
Наш Брянск The Best Places to See in Altai
The Best Places to See in Altai Компания SAHRA TICARET
Компания SAHRA TICARET Образы животных наших природных зон в искусстве и фольклоре
Образы животных наших природных зон в искусстве и фольклоре Всё про Деда Мороза и Новый год
Всё про Деда Мороза и Новый год Развитие жизни на планете (Каменноугольный период)
Развитие жизни на планете (Каменноугольный период) Футбол. Онлайн обучение
Футбол. Онлайн обучение Познавательная беседа с председателем научно-учебной комиссии Донского Государственного Технического Университета (ДГТУ)
Познавательная беседа с председателем научно-учебной комиссии Донского Государственного Технического Университета (ДГТУ) 20140202_priroda_urala.unikalnye_obekty_urala
20140202_priroda_urala.unikalnye_obekty_urala Глава 1 Принципы экономики
Глава 1 Принципы экономики Текущая ситуация по разработке нормативных правовых, технических документов, регулирующих техническую эксплуатацию изделий ВТ
Текущая ситуация по разработке нормативных правовых, технических документов, регулирующих техническую эксплуатацию изделий ВТ Групповая дискуссия. Мифические и фактические данные о суициде
Групповая дискуссия. Мифические и фактические данные о суициде Социальные и личностные роли. Ситуации успеха и неуспеха
Социальные и личностные роли. Ситуации успеха и неуспеха Зарождение искусства
Зарождение искусства Sokrovischa_natsiy
Sokrovischa_natsiy Религия и верования древних хакасов
Религия и верования древних хакасов Ложный след
Ложный след Начало царствования Александра III
Начало царствования Александра III Получение кисломолочных продуктов в домашних условиях
Получение кисломолочных продуктов в домашних условиях Формирование ресурсосберегающих централизованных систем теплоснабжения на базе ТНУ
Формирование ресурсосберегающих централизованных систем теплоснабжения на базе ТНУ