Содержание
- 2. Лекция № 9 ХИМИЯ РАСТВОРОВ (Буферные растворы)
- 3. Буферными называют растворы, которые при изменении состава среды поддерживают постоянное значение какой-либо характеристики, например pH (кислотно-основной
- 4. Образцы коммерческих буферных растворов
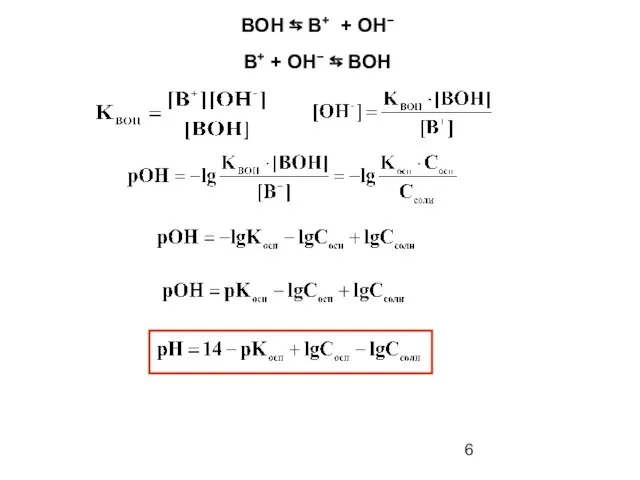
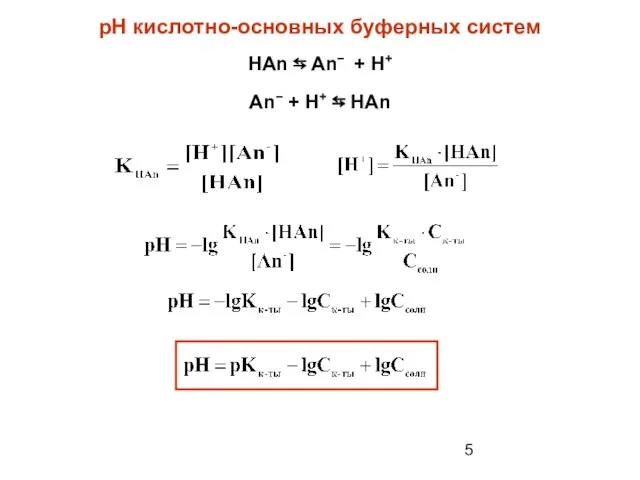
- 5. pH кислотно-основных буферных систем HAn ⇆ An− + H+ An− + H+ ⇆ НAn
- 6. BOH ⇆ B+ + OH− B+ + OH− ⇆ BOH
- 7. Буферные растворы сохраняют устойчивость буферных свойств в определенном интервале значений рН, то есть обладают определенной буферной
- 8. В лабораторной практике буферные растворы используют в тех случаях, когда та или иная реакция могут быть
- 9. Амфотерные оксиды и гидроксиды
- 10. Амфотерность (двойственность свойств) гидроксидов и оксидов многих элементов проявляется в образовании ими двух типов солей. Например,
- 12. В настоящее время растворение амфотерных гидроксидов в щелочных растворах обычно рассматривается как процесс образования гидроксосолей (гидроксокомплексов).
- 14. Амфотерные свойства проявляют те металлы, которые в Периодической таблице находятся наиболее близко к неметал-лам. Неметаллы обладают
- 15. Гидроксид B(OH)3 имеет наиболее "ковалентную" связь B-O, поскольку бор по электроотрицательности ближе к кислороду, чем Al
- 16. Если амфотерный элемент имеет в соединениях несколько степеней окисления, то амфотерные свойства наиболее ярко проявляются для
- 18. Скачать презентацию
Слайд 3 Буферными называют растворы, которые при изменении состава среды поддерживают постоянное значение
Буферными называют растворы, которые при изменении состава среды поддерживают постоянное значение

Кислотно-основные буферные растворы представляют собой слабую кислоту и ее соль, образованную сильным основанием (например, уксусная кислота СН3СООН и ацетат натрия CH3COONa) или слабое основание и его соль, образованную сильной кислотой (например, гидроксид аммония NH4OH и хлорид аммония NH4CI). При разбавлении раствора или добавлении к нему некоторого количества кислоты или щелочи кислотно-основная пара способна быть донором либо акцептором ионов водорода, поддерживая величину рH на относительно постоянном уровне:
СН3СООН ⇆ СН3СОО− + H+
СН3СОО− + H+ ⇆ СН3СООН
NH4OH ⇆ NH4+ + OH−
NH4+ + OH− ⇆ NH4OH
Слайд 4Образцы коммерческих буферных растворов
Образцы коммерческих буферных растворов

Слайд 6BOH ⇆ B+ + OH−
B+ + OH− ⇆ BOH
BOH ⇆ B+ + OH−
B+ + OH− ⇆ BOH
Слайд 7 Буферные растворы сохраняют устойчивость буферных свойств в определенном интервале значений рН,
Буферные растворы сохраняют устойчивость буферных свойств в определенном интервале значений рН,

Слайд 8 В лабораторной практике буферные растворы используют в тех случаях, когда та
В лабораторной практике буферные растворы используют в тех случаях, когда та

pH-метр для определения
кислотности молока
Слайд 9Амфотерные оксиды
и гидроксиды
Амфотерные оксиды
и гидроксиды

Слайд 10 Амфотерность (двойственность свойств) гидроксидов и оксидов многих элементов проявляется в образовании
Амфотерность (двойственность свойств) гидроксидов и оксидов многих элементов проявляется в образовании

2Al(OH)3 + 3SO3 = Al2(SO4)3 + 3H2O Al2О3 + 3H2SO4 = Al2(SO4)3 + 3H2O
2Al(OH)3 + Na2O = 2NaAlO2 + 3H2O (в расплаве) Al2О3 + 2NaOH(т) = 2NaAlO2 + H2O (в расплаве)
В одних реакциях Al(OH)3 и Al2О3 проявляют свойства основных гидроксидов и оксидов, т. е. они подобно щелочам реагируют с кислотами и кислотными оксидами, образуя соли, в которых алюминий является катионом Al3+. В других реакциях они выполняют функцию кислотных гидроксидов и оксидов, образуя соль, в которой ион Al3+ входит в состав аниона AlО2−.
В этих соединениях алюминий проявляет свойства металла и неметалла. Подобные свойства имеют также Be, Ga, Ge, Sn, Pb, Sb, Bi, а также большинство элементов Б-групп - Cr, Mn, Fe, Zn, Cd и др.
Слайд 12 В настоящее время растворение амфотерных гидроксидов в
щелочных растворах обычно рассматривается как процесс
образования гидроксосолей (гидроксокомплексов).
Экспериментально доказано существование гидроксо-комплексов многих металлов: [Zn(ОН)4]2-, [Аl(ОН)4(Н2О)2]-, [Аl(ОH)6]3- и
В настоящее время растворение амфотерных гидроксидов в
щелочных растворах обычно рассматривается как процесс
образования гидроксосолей (гидроксокомплексов).
Экспериментально доказано существование гидроксо-комплексов многих металлов: [Zn(ОН)4]2-, [Аl(ОН)4(Н2О)2]-, [Аl(ОH)6]3- и

и ему подобных, в кислой среде равновесие смещается в сторону образования солей алюминия, в щелочной - в сторону
образования гидроксокомплексов. Очевидно, в водном
растворе существует равновесие, которое более точно
описывается уравнением
Аl3+ + ЗОН- + ЗН2О = [Аl(ОН)4(Н2О)2]- + Н+
Объяснение проявления амфотерности у одних металлов и отсутствие ее у других следует искать в прочности химической связи в амфотерных гидроксидах.
Слайд 14 Амфотерные свойства проявляют те металлы, которые в Периодической таблице находятся наиболее
Амфотерные свойства проявляют те металлы, которые в Периодической таблице находятся наиболее
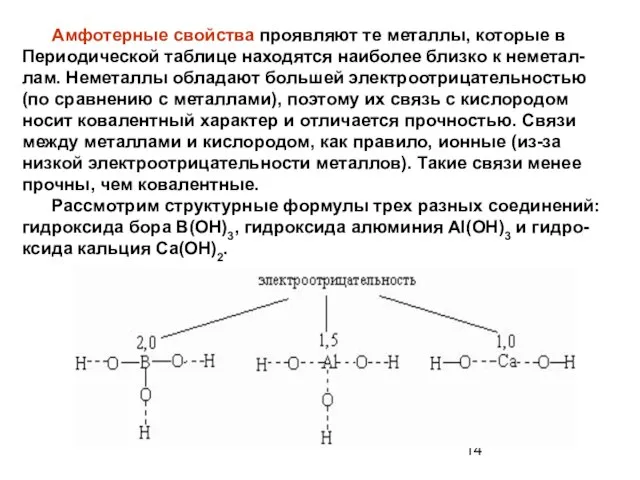
Рассмотрим структурные формулы трех разных соединений: гидроксида бора B(OH)3, гидроксида алюминия Al(OH)3 и гидро-ксида кальция Ca(OH)2.
Слайд 15 Гидроксид B(OH)3 имеет наиболее "ковалентную" связь B-O, поскольку бор по электроотрицательности
Гидроксид B(OH)3 имеет наиболее "ковалентную" связь B-O, поскольку бор по электроотрицательности

H3BO3 = 3H+ + BO3-3 (в растворе)
Кальций – наименее электроотрицательный из этих элемен-тов, поэтому связь Са–О имеет преимущественно ионный характер. Из-за низкой электроотрицательности кальция диссо-циация протекает по типу основания
Ca(OH)2 = Ca+2 + 2OH- (в растворе)
Гидроксид алюминия, в котором центральный атом имеет промежуточную электроотрицательность, может проявлять как свойства кислоты, так и основания – в зависимости от партнера в реакции нейтрализации.
Именно поэтому кислотные свойства гидроксидов Mn и Fe возрастают с увеличением степени окисления иона металла – возрастает прочность связи M-O: Mn(OH)2 < Mn(OH)3 < MnO4-2 < MnO4-; Fe(OH)2 < Fe(OH)3 < Fe(OH)6.
Слайд 16 Если амфотерный элемент имеет в соединениях несколько степеней окисления, то амфотерные
Если амфотерный элемент имеет в соединениях несколько степеней окисления, то амфотерные

Cr2+ → CrO, Cr(OH)2 → CrSO4 Cr3+ → Cr2O3, Cr(OH)3 → Cr2(SO4)3 или KCrO2 Cr6+ → CrO3, H2CrO4 → K2CrO4
Для многих амфотерных гидроксидов точные формулы не известны, поскольку из водного раствора вместо гидроксидов выпадают гидратированные оксиды, например MnO2·nH2O, Sb2O5·nH2O.
Наличие амфотерных соединений свидетельствует об отсутствии резких границ в классификации веществ (металлы — неметаллы, основания — кислоты и др.).

 Инфраструктурные инвестиции
Инфраструктурные инвестиции Културен туризъм: международен маркетинг Бележки към кръглата маса организирана от ПП ГЕРБ Асеновград, 23.06.09
Културен туризъм: международен маркетинг Бележки към кръглата маса организирана от ПП ГЕРБ Асеновград, 23.06.09 Pos материалы гербион
Pos материалы гербион Презентация на тему Неофициальные символы России
Презентация на тему Неофициальные символы России CPA launches FOD
CPA launches FOD Методы и приборы разрушающего контроля, применяемые при обследовании
Методы и приборы разрушающего контроля, применяемые при обследовании ЖИЗНЬ И БЫТ В СРЕДНЕВЕКОВОМ ЗАМКЕ
ЖИЗНЬ И БЫТ В СРЕДНЕВЕКОВОМ ЗАМКЕ Презентация компании MOST Marketing«Франчайзинговый пакет: как разработать,чтобы привлечь франчайзи»
Презентация компании MOST Marketing«Франчайзинговый пакет: как разработать,чтобы привлечь франчайзи» Колористика при окрашивании волос. Тест
Колористика при окрашивании волос. Тест Предложение по летнему корпоративному отдыху на стадионе «Труд» (пос. «Старая Купавна»)
Предложение по летнему корпоративному отдыху на стадионе «Труд» (пос. «Старая Купавна») Греческая вазопись
Греческая вазопись Холод в нефтянной промышленности
Холод в нефтянной промышленности Урок-путешествие по разделу «Были-небылицы». Оценка достижений
Урок-путешествие по разделу «Были-небылицы». Оценка достижений LobbyWorks
LobbyWorks Самоиндукция
Самоиндукция Correct сommunication. Правильное общение
Correct сommunication. Правильное общение Тема: «Положение человека в системе животного мира. Эволюция гоминид».
Тема: «Положение человека в системе животного мира. Эволюция гоминид». Презентация на тему Выживание в природных условиях после аварии
Презентация на тему Выживание в природных условиях после аварии  ангелы
ангелы Интеллектуально-познавательная игра
Интеллектуально-познавательная игра Анализ применимости ПИК «СтОФ» для массовой оценки стоимости движимого имущества Тевелева Оксана Валерьевна тел: (499) 724-15-14, 8(903)208-
Анализ применимости ПИК «СтОФ» для массовой оценки стоимости движимого имущества Тевелева Оксана Валерьевна тел: (499) 724-15-14, 8(903)208- Fruit and vegetables
Fruit and vegetables Ты подвиг совершил во имя жизни на земле
Ты подвиг совершил во имя жизни на земле Обязательства из односторонних сделок и из действий в чужом интересе. Обязательства из договоров, не подлежащие судебной защите
Обязательства из односторонних сделок и из действий в чужом интересе. Обязательства из договоров, не подлежащие судебной защите ТВ - тюнеры
ТВ - тюнеры Применение программного комплекса CorPos (FORCE Technology Norway AS) для диагностики и прогнозирования коррозии на внутренних стенках газопров
Применение программного комплекса CorPos (FORCE Technology Norway AS) для диагностики и прогнозирования коррозии на внутренних стенках газопров Евгений Замятин
Евгений Замятин Characteristic of grain mass
Characteristic of grain mass