Содержание
- 2. Лекция №16 Химия металлов ОСОБЕННОСТИ ХИМИИ d -ЭЛЕМЕНТОВ Cодержание 1. Общая характеристика d - элементов 2.
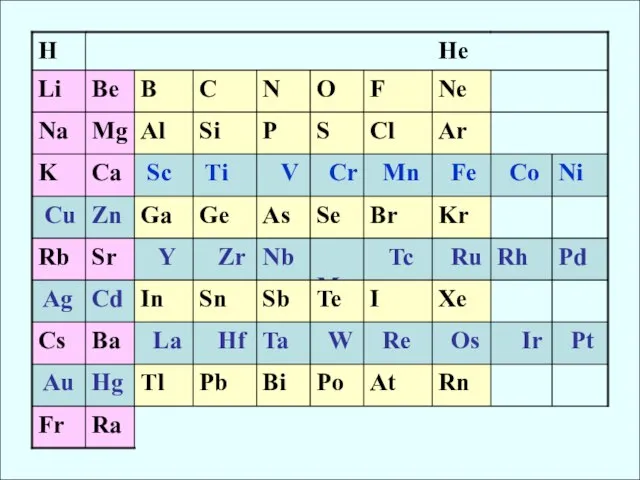
- 4. Общая характеристика d - элементов Валентными электронами являются от 1 до 10 d-е, а также 2,
- 5. (n-1)d1-5 ns2 Две группы d-элементов (n-1)d6-10 ns2 Свойственно проявление высших СО. В высших СО d-элементы III,
- 6. Cr [Ar] 3d54s1 Mn [Ar] 3d54s2 Fe [Ar] 3d64s2 Co [Ar] 3d74s2 Ni [Ar] 3d84s2 Cu
- 7. d-элементы характеризуются большой твердостью и высокими t пл. и t кип. d-элементы характеризуются высокой плотностью, что
- 8. Химические свойства d-элементов Сравнение d- и р-элементов в высших СО Группа р-элементы d-элементы VII VI V
- 9. На d-подуровне наблюдается повышенная устойчивость конфигурации d0, d5, d10 Ti:[Ar]3d24s2 Ti+IV: [Ar]3d04s0 Ti: (II),III,IV Fe:[Ar]3d64s2 Fe:
- 10. VIIB Mn: II, IV, VI, VII TcRe (IV,V) VII VIB Cr: II, III, VI MoW (IV,
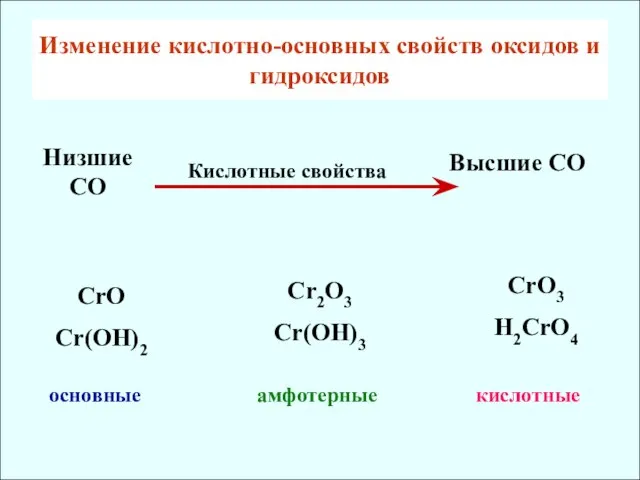
- 11. Изменение кислотно-основных свойcтв оксидов и гидроксидов CrO Cr(OH)2 основные Cr2O3 Cr(OH)3 CrO3 H2CrO4 амфотерные кислотные Низшие
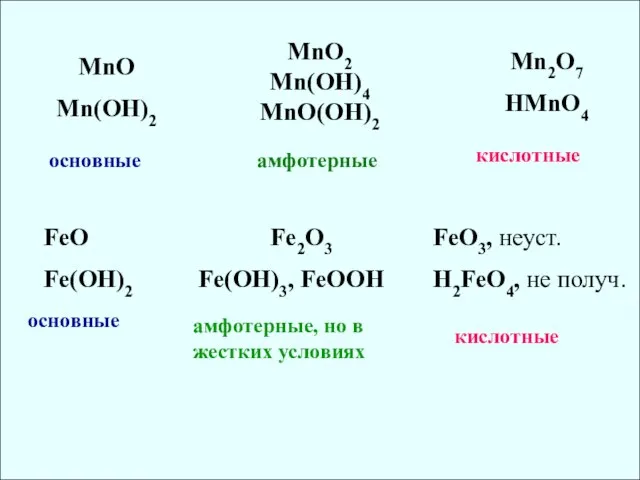
- 12. MnO Mn(OH)2 MnO2 Mn(OH)4 MnO(OH)2 Mn2O7 HMnO4 основные амфотерные кислотные FeO Fe(OH)2 Fe2O3 Fe(OH)3, FeOOH FeO3,
- 13. Cr(OH)3 + H2SO4 = Cr2(SO4)3 + H2O Cr(OH)3 + NaOH = Na[Cr(OH)4] тетрагидроксохромит натрия Cr2O3 +
- 14. Fe2O3 - обладает амфотерными свойствами, но в жестких условиях: Fe2O3 + HCl = FeCl3 + H2O
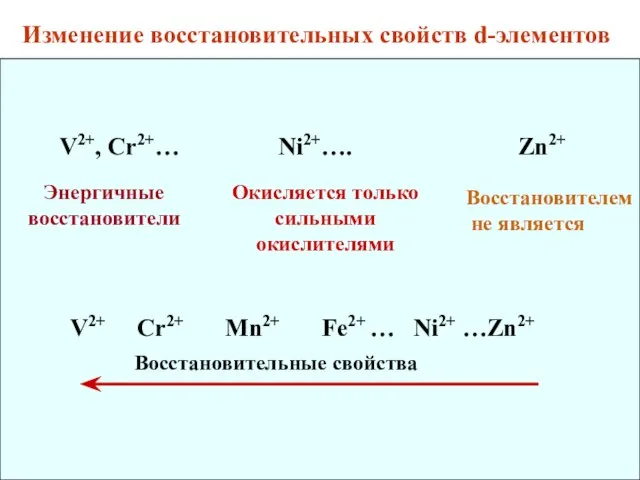
- 15. V2+, Cr2+… Ni2+…. Zn2+ Энергичные восстановители Окисляется только сильными окислителями V2+ Cr2+ Mn2+ Fe2+ … Ni2+
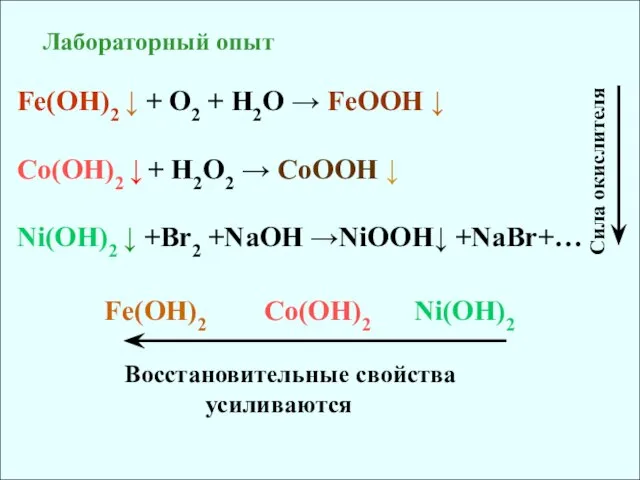
- 16. Лабораторный опыт Fe(OH)2 + O2 + H2O FeOOH Co(OH)2 + H2O2
- 17. Cr(OH)2 + H2O + O2 = Cr(OH)3 В степени +II соединения хрома являются сильными восстановителями: Cоли
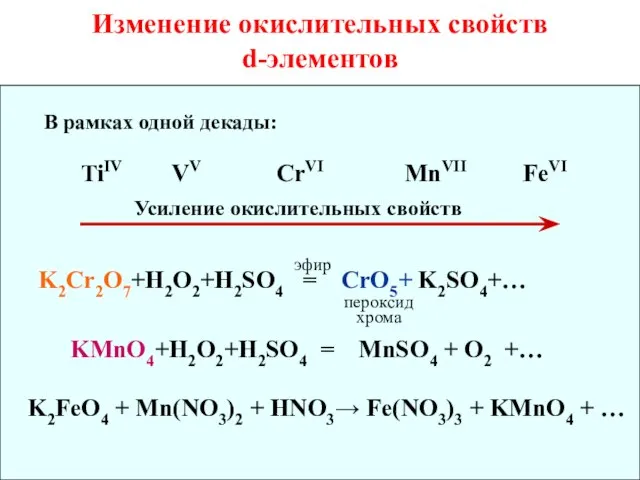
- 18. Изменение окислительных свойств d-элементов В рамках одной декады: TiIV VV CrVI MnVII FeVI Усиление окислительных свойств
- 19. Дихроматы и хроматы являются сильными окислителями: K2Cr2O7 + KJ + H2SO4 = J2 + Cr2(SO4)3 +
- 20. CoCl2 + 4KSCN K2[Co(SCN)4] + 2KCl Эту способность используют: 1) для очистки d-элементов от примесей
- 21. 2) Для разделения близких по свойствам элементов: ZnSO4CdSO4 + NaOHизбыток Na2[Zn(OH)4]раствор Cd(OH)2 + Na2SO4 AgCl
- 22. Fe2+ + K3[Fe(CN)6] = KFeFe(CN)6 + … III II III Fe3+ + 6 SCN- = [Fe(SCN)6]3-
- 23. ФИЗИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ - высокая электропроводность - высокая теплопроводность - пластичность - твердость - тугоплавкость
- 24. Руды – это природные соединения металлов. 1 Оксидные руды: 2 Сульфидные руды: - FeS2 – пирит
- 25. Галогенидные руды (в основном щелочных и щелочноземельных металлов): 3 4 NaCl – галит (поваренная соль) KCl
- 26. РУТИЛ TiO2
- 27. Пиролюзит MnO2
- 28. Пирит FeS2
- 29. 1. Пирометаллургия – окислительный обжиг сульфидов и восстановление металлов из оксидов при высокой температуре. Fe2O3 +
- 30. 3. Гидрометаллургия - выделение металлов из растворов их солей более активными металлами CdSO4 + Zn Cd+
- 31. Au + KCN + O2 + H2O = K[Au(CN)2] + KOH K[Au(CN)2] + Zn = K2[Zn(CN)4]
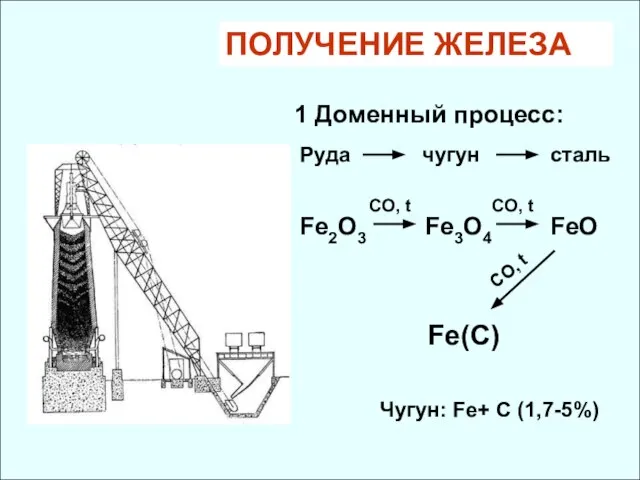
- 32. ПОЛУЧЕНИЕ ЖЕЛЕЗА 1 Доменный процесс: Руда чугун сталь Fe3O4 Fe2O3 CO, t CO, t FeO Fe(C)
- 33. 1. Разложение карбонильных комплексов (Ni, Co, Cr…) Fe + 5CO = Fe(CO)5 Порошок желтая жидкость пентакарбонил
- 34. РЯД НАПРЯЖЕНИЙ МЕТАЛЛОВ Li Cs Ca Na Mg Al Zn Fe Ni Pb H2 Cu Ag
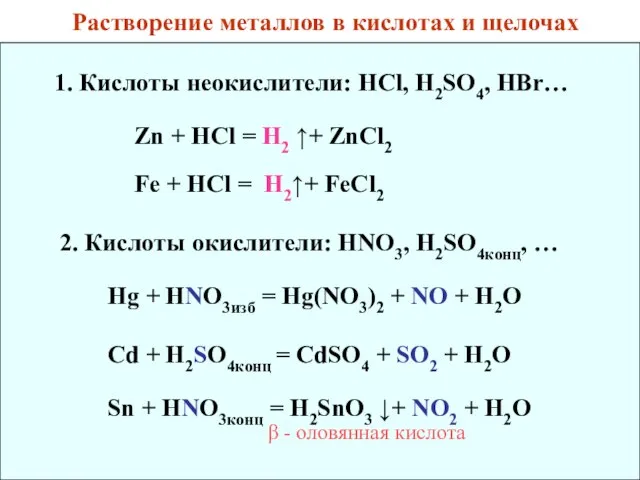
- 35. Растворение металлов в кислотах и щелочах 1. Кислоты неокислители: HCl, H2SO4, HBr… Zn + HCl =
- 36. 3. Смеси кислот: HNO3 + HCl – «царская водка» HNO3 + HF Nb + HNO3 +
- 38. Скачать презентацию



![Cr [Ar] 3d54s1 Mn [Ar] 3d54s2 Fe [Ar] 3d64s2 Co [Ar] 3d74s2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/372776/slide-5.jpg)


![На d-подуровне наблюдается повышенная устойчивость конфигурации d0, d5, d10 Ti:[Ar]3d24s2 Ti+IV: [Ar]3d04s0](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/372776/slide-8.jpg)

![Cr(OH)3 + H2SO4 = Cr2(SO4)3 + H2O Cr(OH)3 + NaOH = Na[Cr(OH)4]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/372776/slide-12.jpg)



![CoCl2 + 4KSCN K2[Co(SCN)4] + 2KCl Эту способность используют: 1) для](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/372776/slide-19.jpg)
![2) Для разделения близких по свойствам элементов: ZnSO4CdSO4 + NaOHизбыток Na2[Zn(OH)4]раствор Cd(OH)2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/372776/slide-20.jpg)
![Fe2+ + K3[Fe(CN)6] = KFeFe(CN)6 + … III II III Fe3+ +](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/372776/slide-21.jpg)








![Au + KCN + O2 + H2O = K[Au(CN)2] + KOH K[Au(CN)2]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/372776/slide-30.jpg)



 Родительское собрание
Родительское собрание Презентация на тему Конвекция. Излучение
Презентация на тему Конвекция. Излучение  Труд людей весной
Труд людей весной Обучение. Лидогенерация. Понятие и значение. Ростелеком
Обучение. Лидогенерация. Понятие и значение. Ростелеком Федеральное государственное бюджетное общеобразовательное учреждение высшего профессионального обра
Федеральное государственное бюджетное общеобразовательное учреждение высшего профессионального обра Звуковые волны
Звуковые волны Как создать технологически надежный стартап
Как создать технологически надежный стартап Интернет вещей
Интернет вещей Ференц Лист
Ференц Лист Организация проблемного обучения
Организация проблемного обучения Современное обществоведческое образование и его место в системе общего образования
Современное обществоведческое образование и его место в системе общего образования Классификация налогов. (Тема 2)
Классификация налогов. (Тема 2) Walt disney presents
Walt disney presents Презентация на тему Технология организации логопедического обследования
Презентация на тему Технология организации логопедического обследования  ТЕМА: «Откуда берутся снег и лед?»
ТЕМА: «Откуда берутся снег и лед?» ИТОГИ РЕАЛИЗАЦИИ В 2011 ГОДУ НА ТЕРРИТОРИИ ТУЛЬСКОЙ ОБЛАСТИ ПРОГРАММЫ «ГАЗПРОМ - ДЕТЯМ» И ПРОГРАММЫ ГАЗИФИКАЦИИ РЕГИОНОВ РФ ОАО «ГА
ИТОГИ РЕАЛИЗАЦИИ В 2011 ГОДУ НА ТЕРРИТОРИИ ТУЛЬСКОЙ ОБЛАСТИ ПРОГРАММЫ «ГАЗПРОМ - ДЕТЯМ» И ПРОГРАММЫ ГАЗИФИКАЦИИ РЕГИОНОВ РФ ОАО «ГА Сказки о золотом петушке
Сказки о золотом петушке Античная философия
Античная философия Акция «Вахта памяти»
Акция «Вахта памяти» Выступление «Оценка качества деятельности вузов, реализующих подготовку кадров для железнодорожной отрасли»
Выступление «Оценка качества деятельности вузов, реализующих подготовку кадров для железнодорожной отрасли» Брейн-ринг«Юные знатоки физики»
Брейн-ринг«Юные знатоки физики» Как записываются алгоритмы?Какими видами обладают алгоритмы?
Как записываются алгоритмы?Какими видами обладают алгоритмы? МЫ ЗАЖИГАЕМ ЗВЁЗДЫ
МЫ ЗАЖИГАЕМ ЗВЁЗДЫ Являются ли столь сильные движения цен акций оправданными последовательными изменениями в дивидендах
Являются ли столь сильные движения цен акций оправданными последовательными изменениями в дивидендах Стандарты обслуживания КЦ
Стандарты обслуживания КЦ Влияние результатов финансового анализа на выбор методов оценки стоимости бизнеса (предприятия)
Влияние результатов финансового анализа на выбор методов оценки стоимости бизнеса (предприятия) Основы маркетингаЛекция 1
Основы маркетингаЛекция 1 Викторина по произведению А. Рыбакова Кортик
Викторина по произведению А. Рыбакова Кортик