Содержание
- 2. Мазмұны: Модуль мақсаты: реакция жағдайларын анықтау әдістерін талқылау;- энтропия мен Гиббс энергиясының өзгеруіне есептер шығару.
- 3. 10 сынып 10.3.1.5 энтропияны жүйенің ретсіздік өлшемі ретінде түсіндіру және оны анықтамалық деректер арқылы есептеу; 10.3.1.6
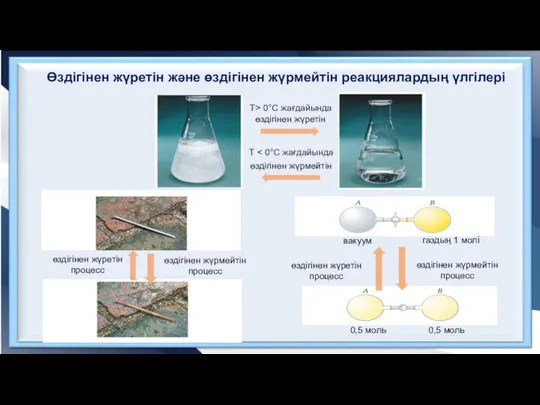
- 4. өздігінен жүретін процесс өздігінен жүрмейтін процесс өздігінен жүретін өздігінен жүрмейтін өздігінен жүрмейтін процесс өздігінен жүретін процесс
- 5. ΔH°р = +62.3 кДж Бұл реакция қатты заттар араласқан кезде өздігінен жүреді. Реакциялық қоспаның қоршаған ортадан
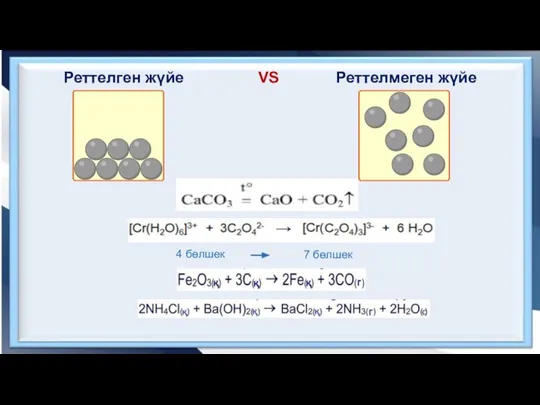
- 6. Реттелген жүйе VS Реттелмеген жүйе 4 бөлшек 7 бөлшек
- 7. Бейнеролик көрсетілімі https://www.youtube.com/watch?v=qH7C43dqTJc Талдау
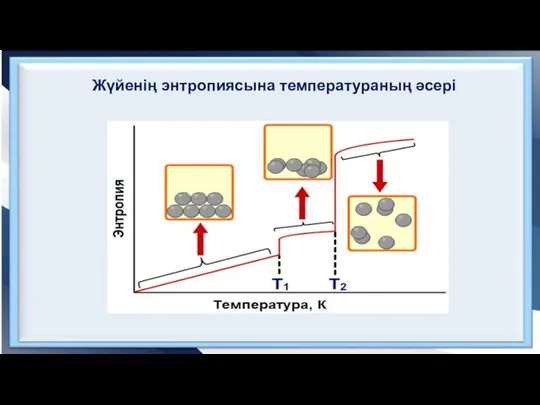
- 8. Жүйенің энтропиясына температураның әсері
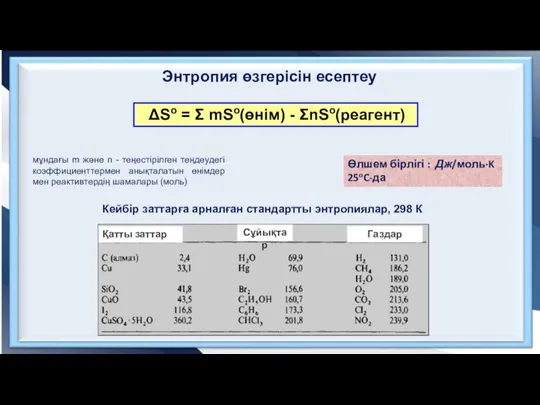
- 9. ΔSo = Σ mSo(өнім) - ΣnSo(реагент) Өлшем бірлігі : Дж/моль·K 25oC-да мұндағы m және n -
- 10. ΔS жүйе энтропиясының өзгеруіне ΔH жүйе энтальписының өзгеруіне T температураға Реакция өздігінен жүре ме, келесілерге байланысты:
- 11. http://youtube.com/watch?v=GI9364LEvqU Демонстрация және талқылау
- 12. ΔGжүйе= ΔHжүйе - T ΔSжүйе Температураның реакцияның өздігінен жүруіне әсері
- 14. Су буының конденсациясы моделі Осы процесс үшін ΔH және ΔS жазыңыз Процестің өздігінен жүруі үшін температура
- 15. https://www.youtube.com/watch?v=PPfZXepxFAw Бейнежазбаны көрсету және талқылау
- 16. ΔGтүз° (KClO4) ΔGтүз° (KCl) ΔGтүз° (KClO3) -303.2 кДж/моль -409.2 кДж/моль -296.3 кДж/моль Стандартты реакцияның ΔG °
- 17. Тапсырма: Кестелік ΔHтүз° мәліметтерді қолданып, ΔH°реакцияның есептеу үшін және ΔS° мәнін ΔS°реакцияның есептеу үшін реакцияның ΔG°
- 18. Рефлексия Сөйлемдерді жалғастыру: Бүгінгі сессияда қайталадым……………………. Бүгінгі сессияда мен бекіттім…………………… Бүгінгі сессиясда мен білдім……………………. Бүгінгі сессияда
- 20. Скачать презентацию











 Критерии живых систем
Критерии живых систем Презентация на тему Сказки о Югре
Презентация на тему Сказки о Югре  TechartМалова
TechartМалова Как заработать в бизнес-кейс флипбук
Как заработать в бизнес-кейс флипбук Мотивация в профсоюзе
Мотивация в профсоюзе Иван Алексеевич Бунин
Иван Алексеевич Бунин Реальный мир и хорошие модели данных
Реальный мир и хорошие модели данных 3. Природные особенности и занятия.
3. Природные особенности и занятия. Лёгкая атлетика. История лёгкой атлетики
Лёгкая атлетика. История лёгкой атлетики Всемирный день иммунитета
Всемирный день иммунитета Управление стратегическими изменениями
Управление стратегическими изменениями 20130310_prezentaciya_11
20130310_prezentaciya_11 Применение ИКТ в МОУ СОШ №3 г.Азнакаево РТ
Применение ИКТ в МОУ СОШ №3 г.Азнакаево РТ Сравнение культур
Сравнение культур Кеннеди
Кеннеди О премудрости Божией - Святорусская редакция вечнозаветной псалтири (псалом 77)
О премудрости Божией - Святорусская редакция вечнозаветной псалтири (псалом 77) ВСТАВКА ОБЪЕКТОВВ ТЕКСТОВОМ ПРОЦЕССОРЕ WORD
ВСТАВКА ОБЪЕКТОВВ ТЕКСТОВОМ ПРОЦЕССОРЕ WORD Требования применяемые к современным вычислительным сетям
Требования применяемые к современным вычислительным сетям  Астрахань, улица К. Комарова, 65
Астрахань, улица К. Комарова, 65 H2H
H2H Роль агрессивности и эмпатии в социализации личности
Роль агрессивности и эмпатии в социализации личности Амулекс. Раскадровка
Амулекс. Раскадровка Город и транспорт
Город и транспорт Применение международных протоколов обследования и лечения при ведении пациентов с синдромом Веста.
Применение международных протоколов обследования и лечения при ведении пациентов с синдромом Веста. ET-9X0MCR
ET-9X0MCR ITC-Invest Trading Company
ITC-Invest Trading Company Миграции животных
Миграции животных Презентация на тему Проблемы мирового океана
Презентация на тему Проблемы мирового океана