Содержание
- 2. ЭЛЕКТРОХИМИЯ Электрохимией называется раздел физичес- кой химии, посвященный изучению связей между химическими и электрическими явлениями.
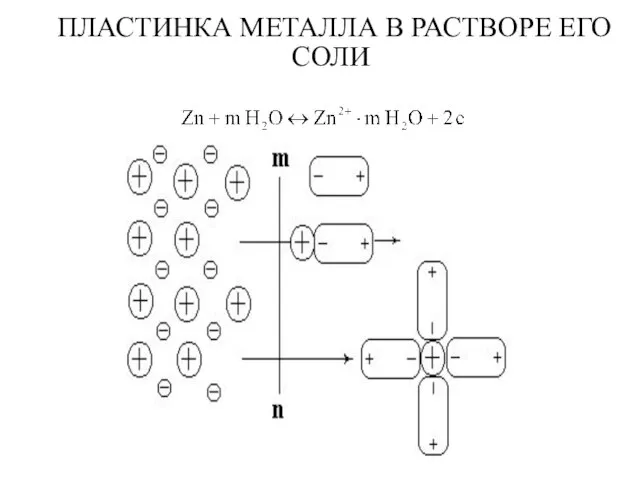
- 3. ПЛАСТИНКА МЕТАЛЛА В РАСТВОРЕ ЕГО СОЛИ
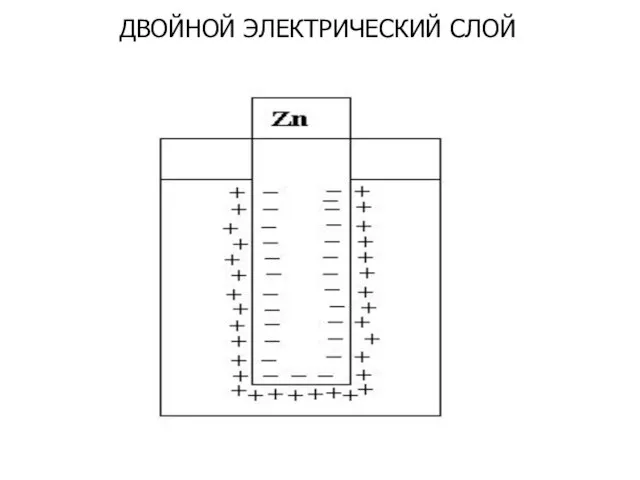
- 4. ДВОЙНОЙ ЭЛЕКТРИЧЕСКИЙ СЛОЙ
- 5. СТРОЕНИЕ ДВОЙНОГО ЭЛЕКТРИЧЕСКОГО СЛОЯ Плотная часть двойного электрического слоя Примыкает к металлу, состоит из молекул воды,
- 6. ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ Разность электрических потенциалов, возника- ющую между металлом и окружающим его раствором, называют электродным потенциалом
- 7. ИЗМЕРЕНИЕ СТАНДАРТНЫХ ЭЛЕКТРОДНЫХ ПОТЕНЦИАЛОВ 1.Стандартные условия 1. Концентрация ионов металла в растворе 1 моль/л; 2. Давление
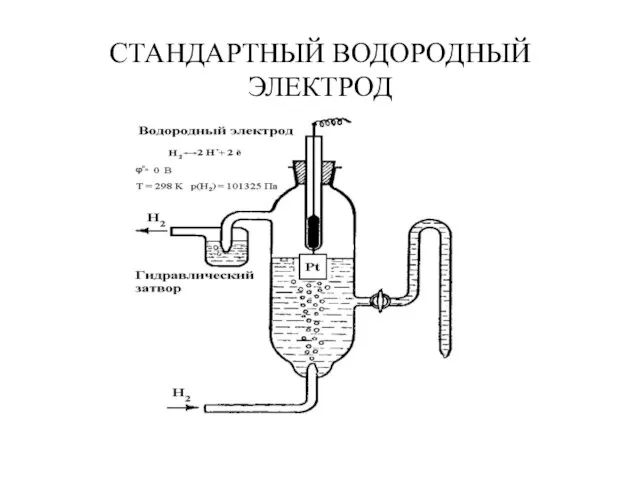
- 8. СТАНДАРТНЫЙ ВОДОРОДНЫЙ ЭЛЕКТРОД
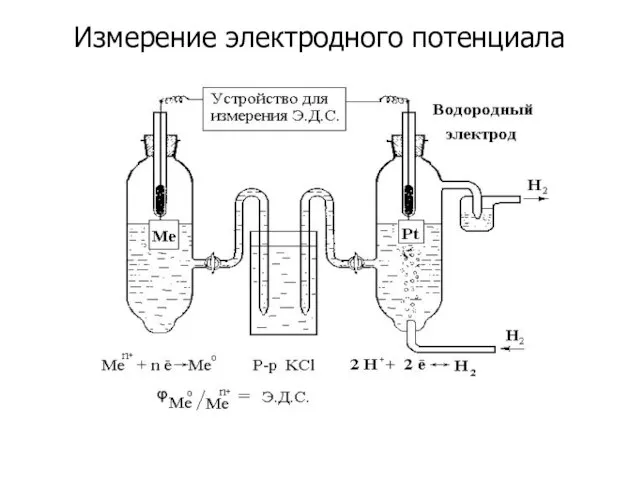
- 9. Измерение электродного потенциала
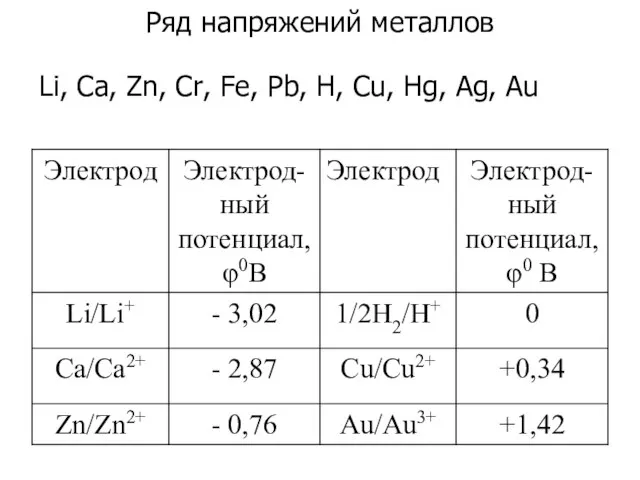
- 10. Ряд напряжений металлов Li, Са, Zn, Cr, Fe, Pb, H, Cu, Hg, Ag, Au
- 11. Уравнение Нернста (1889 г.) φ – потенциал электрода, В; φ0 – стандартный электродный потенциал, В; Т
- 12. Уравнение Нернста Если [Ox] = [Red] =1 моль/л, то: При стандартной температуре 298K (25C) и подстановке
- 13. Электроды Электродом в электрохимии называют такую систему, в которой токопроводящее вещество помещено в раствор или расплав
- 14. Электроды 1-го рода Электродом 1-го рода называют металличес- кий электрод, помещенный в раствор его соли. Меz+
- 15. Электроды 1-го рода Пример 1: медная пластинка в растворе сульфата меди (II). На пластинке возможны два
- 16. Электроды 2-го рода Металл с нанесенным на поверхность слоем его труднорастворимой соли или оксида и помещенный
- 17. ИНЕРТНЫЕ ЭЛЕКТРОДЫ Платина в растворе хлорида железа (III) Некоторые материалы (платина, графит) называются инертными, так как
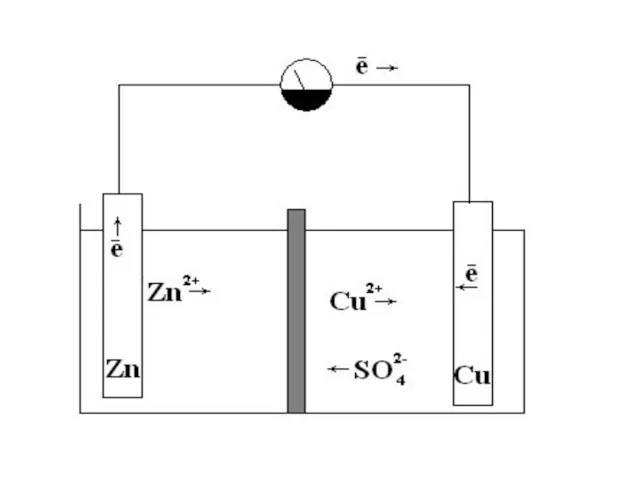
- 18. ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ устройства, в которых энергия окислительно-восстановительных реакций преобразуется в электрическую энергию. Элемент Даниеля-Якоби Zn2+ +
- 19. Элемент Даниэля-Якоби
- 20. РАСЧЕТ ЭЛЕКТРОДВИЖУЩЕЙ СИЛЫ (ЭДС) Катод (восстановление): Сu2+ + 2е = Сu Анод (окисление): Zn - 2ē
- 21. Литиевые батарейки Платина в растворе хлорида железа (III) Источники тока на базе системы: литий/диоксид марганца (Li/MnO2
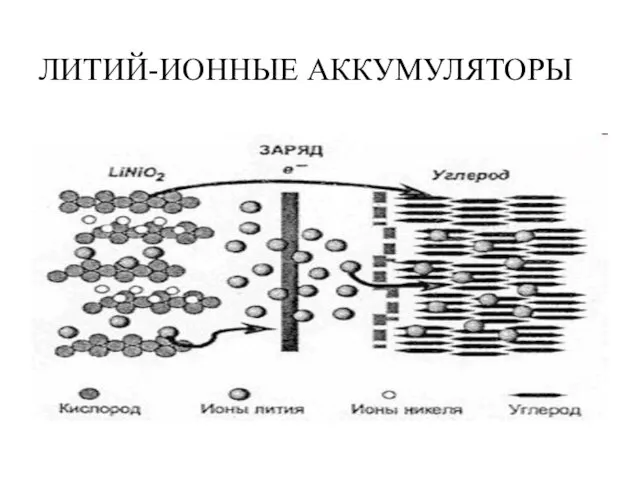
- 22. ЛИТИЙ-ИОННЫЕ АККУМУЛЯТОРЫ (используются в мобильных телефонах и ноутбуках) Платина в растворе хлорида железа (III) Анод: -
- 23. ЛИТИЙ-ИОННЫЕ АККУМУЛЯТОРЫ Платина в растворе хлорида железа (III) При зарядке : Анод (положительный электрод): LiNiO2- xē
- 24. ЛИТИЙ-ИОННЫЕ АККУМУЛЯТОРЫ
- 25. ЛИТИЙ-ИОННЫЕ АККУМУЛЯТОРЫ Платина в растворе хлорида железа (III) Используются в мобильных телефонах и ноутбуках Имеют высокие
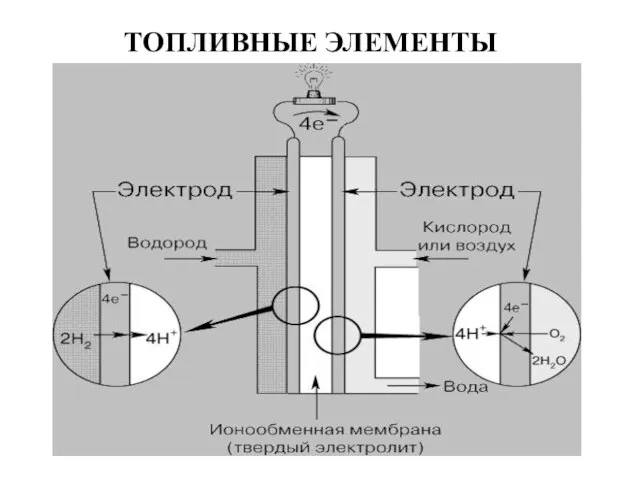
- 26. ТОПЛИВНЫЕ ЭЛЕМЕНТЫ Платина в растворе хлорида железа (III)
- 27. ПРИНЦИП ДЕЙСТВИЯ ВОДОРОДНО-КИСЛОРОДНОГО ТОПЛИВНОГО ЭЛЕМЕНТА С ИОНООБМЕННОЙЬ МЕМБРАНОЙ Платина в растворе хлорида железа (III) Технология изготовления
- 28. ТЕМЫ КОРОТКИХ СООБЩЕНИЙ Платина в растворе хлорида железа (III) Стеклянный электрод: принцип действия и сферы использования;
- 30. Скачать презентацию





![Уравнение Нернста Если [Ox] = [Red] =1 моль/л, то: При стандартной температуре](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/411907/slide-11.jpg)













 Технологическое предпринимательство для школьников: от изобретения к бизнесу! Занятие 2
Технологическое предпринимательство для школьников: от изобретения к бизнесу! Занятие 2 Романская архитектура
Романская архитектура Выборы Лидера совета старшеклассников
Выборы Лидера совета старшеклассников Роботы в древней греции
Роботы в древней греции Функция
Функция Поисковое продвижение: как увеличить его эффективность?
Поисковое продвижение: как увеличить его эффективность? Рекламные решения
Рекламные решения Мегалитическая архитектура 8 класс
Мегалитическая архитектура 8 класс Планета дорог
Планета дорог Забота о ближнем - призвание христианина
Забота о ближнем - призвание христианина МОДЕЛИ ПЕДАГОГИЧЕСКОГО ОБЩЕНИЯ
МОДЕЛИ ПЕДАГОГИЧЕСКОГО ОБЩЕНИЯ Презентация на тему Правила поведения при пожаре
Презентация на тему Правила поведения при пожаре  Викторина по произведению А.С. Пушкина "Капитанская дочка"
Викторина по произведению А.С. Пушкина "Капитанская дочка" Конструирование и моделирование одежды
Конструирование и моделирование одежды Медиабезопасность
Медиабезопасность Агатэ Элерс, отдел Международного сотрудничества Услуги и опыт Немецкого Энергетического Агентства в реализации СО- и МЧР-проект
Агатэ Элерс, отдел Международного сотрудничества Услуги и опыт Немецкого Энергетического Агентства в реализации СО- и МЧР-проект ВСЕМ! ВСЕМ! ВСЕМ! 7 ФЕВРАЛЯ, В 17 ЧАСОВ ГИМНАЗИЯ № 3 ЖДЁТ СВОИХ ВЫПУСКНИКОВ
ВСЕМ! ВСЕМ! ВСЕМ! 7 ФЕВРАЛЯ, В 17 ЧАСОВ ГИМНАЗИЯ № 3 ЖДЁТ СВОИХ ВЫПУСКНИКОВ  Что нас окружает ?
Что нас окружает ? НИД кафедры ЭиУ в 2020/21 уч. году Проблемы, задачи, пути развития
НИД кафедры ЭиУ в 2020/21 уч. году Проблемы, задачи, пути развития Британские художники
Британские художники Год театра в России. Научно-практическая конференция
Год театра в России. Научно-практическая конференция Презентация3
Презентация3 Винтовые лестницы
Винтовые лестницы Экспорт нефти и нормативно-правовое регулирование
Экспорт нефти и нормативно-правовое регулирование Александрова Айталина Ивановна
Александрова Айталина Ивановна Готовность первоклассника к школе
Готовность первоклассника к школе Отклонение в поведении ребенка как социально-педагогическая проблема
Отклонение в поведении ребенка как социально-педагогическая проблема Презентация на тему Миграции населения России (8 класс)
Презентация на тему Миграции населения России (8 класс)