Слайд 2 концентрация реагирующих веществ:
чем больше концентрация
реагирующих веществ, тем
больше скорость

химической реакции
Закон действующих масс (Н.И.Бекетов)
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ
2А + 3В = 2С
v = k·CА2·СВ3 , k – константа скорости
Слайд 3Концентрация газообразных веществ

Слайд 4Скорость реакции зависит от концентрации только жидких и газообразных веществ

Слайд 6 температура
Чем выше температура, тем больше
кинетическая энергия частиц, следовательно, больше вероятность

их взаимодействия
Правило Вант-Гоффа (голландский химик):
При повышении температуры на каждые 10С скорость реакции возрастает в 2-4 раза
Слайд 7Некоторые химические реакции протекают с мгновенной скоростью (между кислотами и солями),
другие со

средней скоростью (между оксидами металлов, металлами и кислотами),
но есть реакции, протекающие очень медленно (гидролиз солей, коррозия металлов)
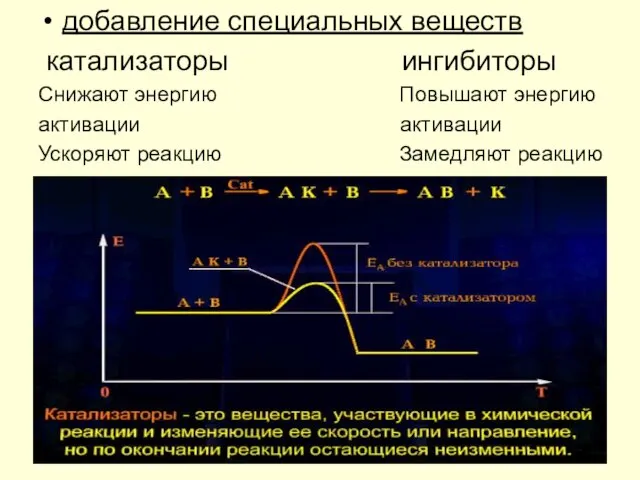
Слайд 9добавление специальных веществ
катализаторы ингибиторы
Снижают энергию Повышают энергию
активации активации
Ускоряют реакцию Замедляют реакцию
Слайд 11природа реагирующих веществ
Zn + 2HCl = ZnCl2 + H2↑
Pb + 2HCl

= PbCl2 + H2↑
Первая реакция протекает быстрее, т.к. цинк более активный металл и легче окисляется, чем свинец
Слайд 13площадь соприкосновения веществ:
Чем меньше размер поверхности
твердых веществ, тем больше площадь

соприкосновения реагирующих веществ,
тем больше скорость реакции
Увеличение площади поверхности соприкосновения достигается:
измельчением веществ;
растворением веществ;
подачей веществ противотоком.













 Подготовка к ЕГЭ
Подготовка к ЕГЭ Животноводство России
Животноводство России Путешествие по сказочным тропинкам
Путешествие по сказочным тропинкам Молоко. Молочные продукты
Молоко. Молочные продукты Психолог в отделе полиции
Психолог в отделе полиции 24 апреля 1915 года младотурецкие правители Талаат-паша, Энвер-паша и Джемаль-паша — приказали собрать всю армянскую интеллигенцию в
24 апреля 1915 года младотурецкие правители Талаат-паша, Энвер-паша и Джемаль-паша — приказали собрать всю армянскую интеллигенцию в Программа строительства и реконструкции котельных муниципальных образований Московской области - приоритетный инвестиционный п
Программа строительства и реконструкции котельных муниципальных образований Московской области - приоритетный инвестиционный п Глобальный экологический университет (по улучшению качества жизни)
Глобальный экологический университет (по улучшению качества жизни) Оформление чертежа
Оформление чертежа ЕДИНАЯ ИНТЕЛЛЕКТУАЛЬНАЯ СИСТЕМА УПРАВЛЕНИЯ И АВТОМАТИЗАЦИИ ПРОИЗВОДСТВЕННЫХ ПРОЦЕССОВ НА ЖЕЛЕЗНОДОРОЖНОМ ТРАНСПОРТЕ (ИСУЖТ)
ЕДИНАЯ ИНТЕЛЛЕКТУАЛЬНАЯ СИСТЕМА УПРАВЛЕНИЯ И АВТОМАТИЗАЦИИ ПРОИЗВОДСТВЕННЫХ ПРОЦЕССОВ НА ЖЕЛЕЗНОДОРОЖНОМ ТРАНСПОРТЕ (ИСУЖТ) Ландшафтный дизайн и озеленение участка
Ландшафтный дизайн и озеленение участка Кальянные миксы. Обеспечь себе истинное наслаждение
Кальянные миксы. Обеспечь себе истинное наслаждение Презентация на тему Логические операции
Презентация на тему Логические операции Хатеновская Елена Васильевна
Хатеновская Елена Васильевна SK700-II (Sandpiper II Electronics)
SK700-II (Sandpiper II Electronics) Духовная сфера общества. Религия
Духовная сфера общества. Религия Equalizer
Equalizer XIII Международная конференция "Маркетинг в России" Сообщение: «ОСОБЕННОСТИ ОНЛАЙН ИССЛЕДОВАНИЙ В РОССИИ» Александр Шашкин (Online Market
XIII Международная конференция "Маркетинг в России" Сообщение: «ОСОБЕННОСТИ ОНЛАЙН ИССЛЕДОВАНИЙ В РОССИИ» Александр Шашкин (Online Market  Здравствуй, милая картошка!
Здравствуй, милая картошка! ИСТОРИЯ РОССИИ
ИСТОРИЯ РОССИИ Полисахариды
Полисахариды Презентация на тему Труд земной. Ремесла на Руси
Презентация на тему Труд земной. Ремесла на Руси Saxotech 170
Saxotech 170 Внешняя политика СССР
Внешняя политика СССР Гелиоцентрическая система Николая Коперника
Гелиоцентрическая система Николая Коперника Шираб-Жамсо Раднаев
Шираб-Жамсо Раднаев «Давньогрецька міфологія як основа формування філософії та розвитку Європейської цивілізації в цілому»
«Давньогрецька міфологія як основа формування філософії та розвитку Європейської цивілізації в цілому» Их лик сияет над Симбирском
Их лик сияет над Симбирском