Содержание
- 2. План урока 1)СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА АТОМОВ ФОСФОРА И АЗОТА; 2)ФОСФОР, КАК ПРОСТОЕ ВЕЩЕСТВО ;АЛЛОТРОПНЫЕ МОДИФИКАЦИИ ФОСФОРА; 3)ИСТОРИЯ
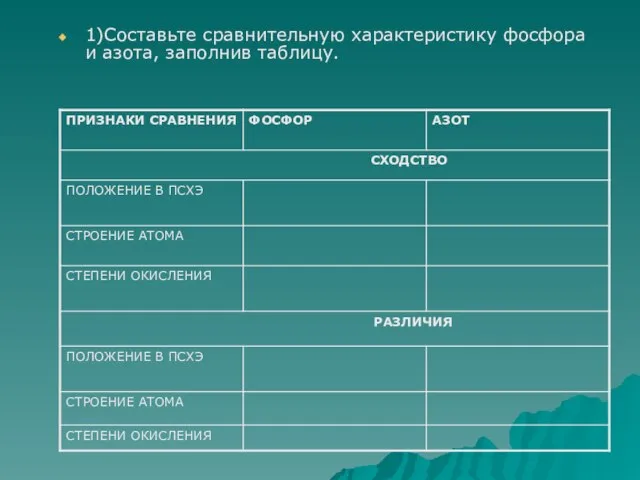
- 3. 1)Составьте сравнительную характеристику фосфора и азота, заполнив таблицу.
- 4. 2)СРАВНИТЕ СВОЙСТВА АТОМА ФОСФОРА СО СВОЙСТВАМИ ЭЛЕМЕНТОВ, СТОЯЩИМИ РЯДОМ В ПЕРИОДЕ И ПОДГРУППЕ. N Si P
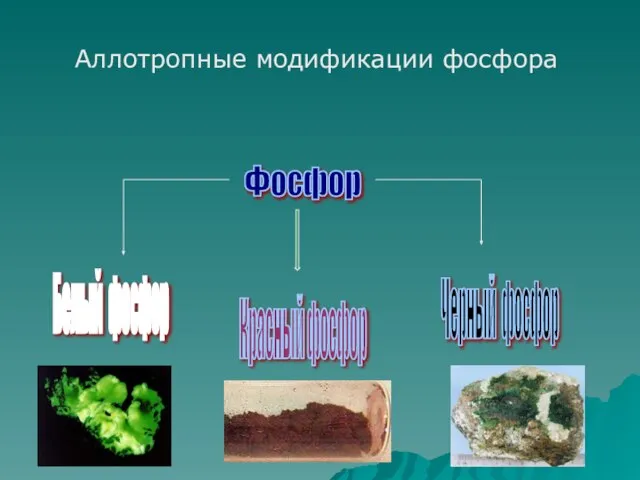
- 5. Фосфор Белый фосфор Красный фосфор Черный фосфор Аллотропные модификации фосфора
- 6. Белый фосфор Наиболее распространен белый, или желтый, фосфор. Белый фосфор имеет молекулярную решетку, в узлах которой
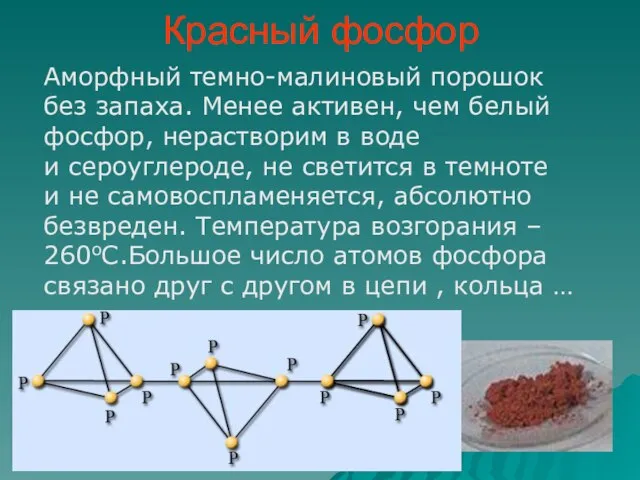
- 7. Красный фосфор Аморфный темно-малиновый порошок без запаха. Менее активен, чем белый фосфор, нерастворим в воде и
- 8. Черный фосфор Ромбическая модификация Кубическая модификация Имеет атомную кристаллическую решетку. По внешним признакам черный фосфор напоминает
- 9. «Да! Это была собака, огромная, черная как смоль… Из ее отверстой пасти вырывалось пламя, глаза метали
- 10. 3)ИСТОРИЯ ОТКРЫТИЯ ФОСФОРА Свое название фосфор получил за способность светиться в темноте (греч. фосфор означает «светоносный»).
- 11. К.В. Шееле (1742–1786) Вскоре Ю. Ган и К.В. Шееле доказали, что в костях содержится много фосфора.
- 12. 4)ПОЛУЧЕНИЕ ФОСФОРА; Свободный фосфор получают в электрических печах без доступа воздуха из фосфата кальция ,смешивая его
- 13. 5)ХИМИЧЕСКИЕ СВОЙСТВА ФОСФОРА А) Взаимодействие с кислородом: Р + О2 → Б) Взаимодействие с бертолетовой солью:
- 14. 6)НАХОЖДЕНИЕ В ПРИРОДЕ Фосфор встречается в природе только в связанном состоянии. Массовая доля фосфора в земной
- 15. 7)ПРИМЕНЕНИЕ ФОСФОРА Более половины объема мирового производства фосфора перерабатывается в соединения, используемые в синтетических моющих средствах.
- 16. Я светоносный элемент. Я спичку вам зажгу в момент. Сожгут меня – и под водой Я
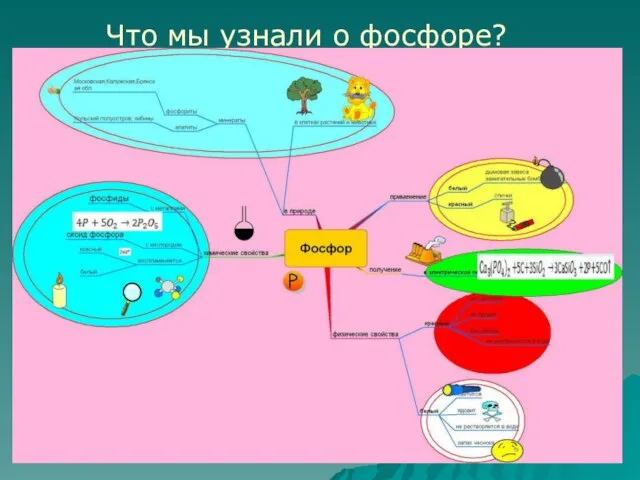
- 17. Что мы узнали о фосфоре?
- 19. Скачать презентацию












 Talk for a minute
Talk for a minute Литературная игра для младших школьников по произведениям Н.Н.Носова «Затейники и фантазёры»
Литературная игра для младших школьников по произведениям Н.Н.Носова «Затейники и фантазёры» L`italiano è facile
L`italiano è facile Коммуникации. Техника 3-х касаний
Коммуникации. Техника 3-х касаний Муниципальное образовательное учреждение "Ковылкинская средняя общеобразовательная школа № 1"
Муниципальное образовательное учреждение "Ковылкинская средняя общеобразовательная школа № 1" Грант 2013г
Грант 2013г Тема урока: «Бунташный век».
Тема урока: «Бунташный век». History & Mystery of the English language
History & Mystery of the English language Внутренняя среда организма. Кровеносная система
Внутренняя среда организма. Кровеносная система Современные средства поражений
Современные средства поражений ПЕРСПЕКТИВНАЯ НАЧАЛЬНАЯШКОЛА
ПЕРСПЕКТИВНАЯ НАЧАЛЬНАЯШКОЛА lecture_1
lecture_1 Тукай начал изучать русский язык
Тукай начал изучать русский язык История праздника Новый Год
История праздника Новый Год Проект: видеоблог
Проект: видеоблог Расчет теплоусвоения внутренней поверхности полов
Расчет теплоусвоения внутренней поверхности полов ЭФФЕКТ КАЗИМИРА: ОТ НАНОТЕХНОЛОГИЙ ДО ФИЗИКИ ВСЕЛЕННОЙ
ЭФФЕКТ КАЗИМИРА: ОТ НАНОТЕХНОЛОГИЙ ДО ФИЗИКИ ВСЕЛЕННОЙ Цифровые права
Цифровые права Сетевой маркетинг
Сетевой маркетинг культура и достопримечательности Греции
культура и достопримечательности Греции Мектеп бітірушілердің психологиялық-физиологиялық жағдайын ескере отырып қобалжу деңгейін төмендету
Мектеп бітірушілердің психологиялық-физиологиялық жағдайын ескере отырып қобалжу деңгейін төмендету Решение текстовых задач. Закрепление пройденного
Решение текстовых задач. Закрепление пройденного Традиционная реклама
Традиционная реклама Saint Patricks day
Saint Patricks day КОМПЬЮТЕРНАЯ ДОЛИНА
КОМПЬЮТЕРНАЯ ДОЛИНА Литературная игра по творчеству А.С. Пушкина
Литературная игра по творчеству А.С. Пушкина Презентация на тему Семейство Губоцветные
Презентация на тему Семейство Губоцветные ФИЗИЧЕСКАЯ КУЛЬТУРА
ФИЗИЧЕСКАЯ КУЛЬТУРА