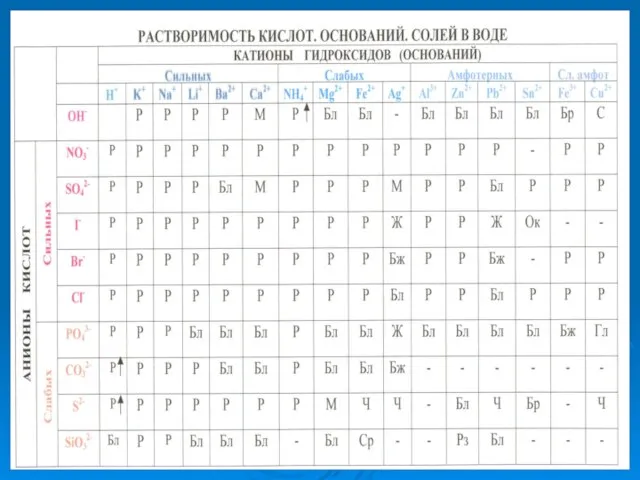
Содержание
- 3. ОКРАСКА ЛАКМУСОВОЙ БУМАГИ В РАЗЛИЧНЫХ СРЕДАХ
- 4. Тема: Гидролиз солей Цель: изучить сущность гидролиза солей в водных растворах. Задачи : сформулировать определение понятия
- 5. «ГИДРОЛИЗ» - от греческого «гидро» - вода «лизис» - разложение
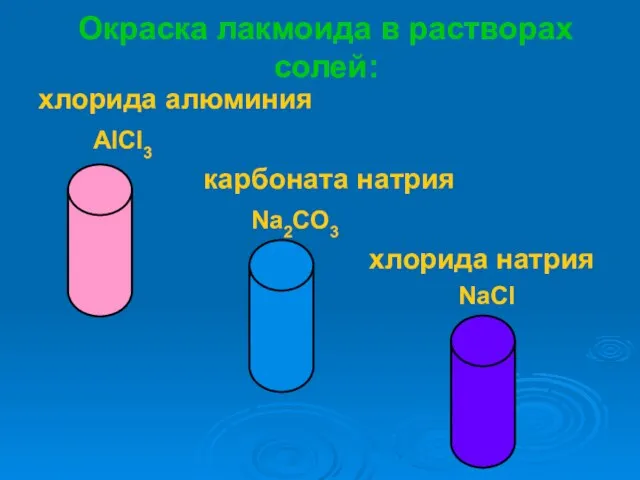
- 6. Окраска лакмоида в растворах солей: хлорида алюминия AlCl3 карбоната натрия Na2CO3 хлорида натрия NaCl
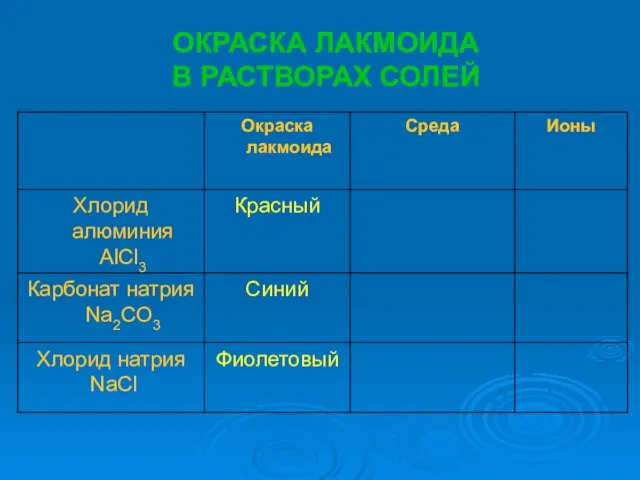
- 7. ОКРАСКА ЛАКМОИДА В РАСТВОРАХ СОЛЕЙ
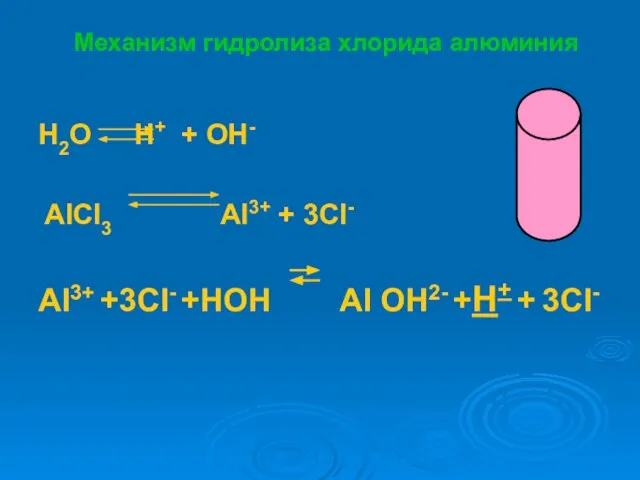
- 8. Механизм гидролиза хлорида алюминия H2O H+ + OH- AlCl3 Al3+ + 3Cl- Al3+ +3Cl- +HOH Al
- 9. Схема гидролиза хлорида алюминия AlCl3 Al(OH)3 HCl слабое основание сильная кислота [OH]- (что сильней того и
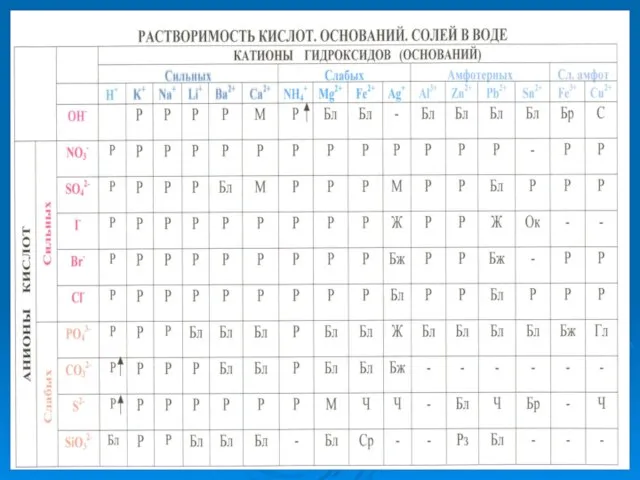
- 10. АЛГОРИТМ СОСТАВЛЕНИЯ УРАВНЕНИЙ РЕАКЦИЙ ГИДРОЛИЗА СОЛЕЙ Определить состав соли, то есть указать, каким по силе основанием
- 11. Al3+ + HOH AlOH2+ + H+ AlCl3 + H2O AlOHCl2 + HCl Одним из продуктов данной
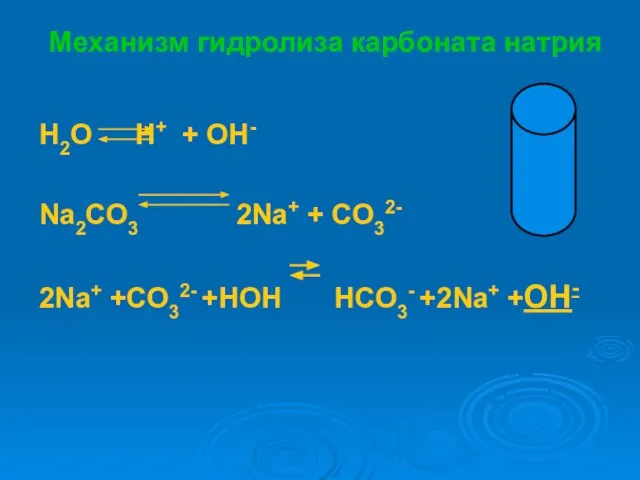
- 12. Механизм гидролиза карбоната натрия H2O H+ + OH- Na2CO3 2Na+ + CO32- 2Na+ +CO32- +HOH HCO3-
- 13. Схема гидролиза карбоната натрия Na2CO3 NaOH H2CO3 сильное основание слабая кислота [OH]- > [H]+ (что сильней
- 14. АЛГОРИТМ СОСТАВЛЕНИЯ УРАВНЕНИЙ РЕАКЦИЙ ГИДРОЛИЗА СОЛЕЙ Определить состав соли, то есть указать, каким по силе основанием
- 15. CO32- +HOH HCO3- +OH- Na2CO3 +H2O NaHCO3 +NaOH Одним из продуктов данной обменной реакции является кислая
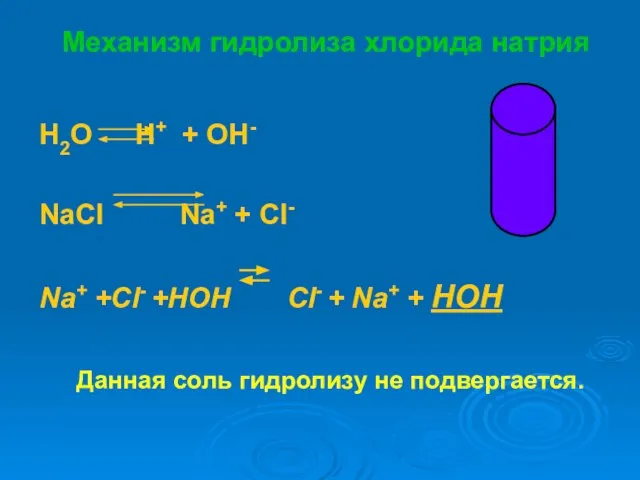
- 16. Механизм гидролиза хлорида натрия H2O H+ + OH- NaСl Na+ + Cl- Na+ +Cl- +HOH Cl-
- 17. Схема гидролиза карбоната натрия NaCl NaOH HCl сильное основание сильная кислота [OH]- = [H]+ Н е
- 18. NaCl + Н2О = Сформулируем вывод: Раствор соли, образованной__________________, имеет________________________реакцию, так как в растворе__________________________________.
- 19. Сформулируем определение понятия «гидролиз»: К какому типу мы отнесем данные реакции? Какие вещества в них участвуют?
- 20. ГИДРОЛИЗ – это реакция обмена между некоторыми солями и водой приводящая к образованию слабого электролита.
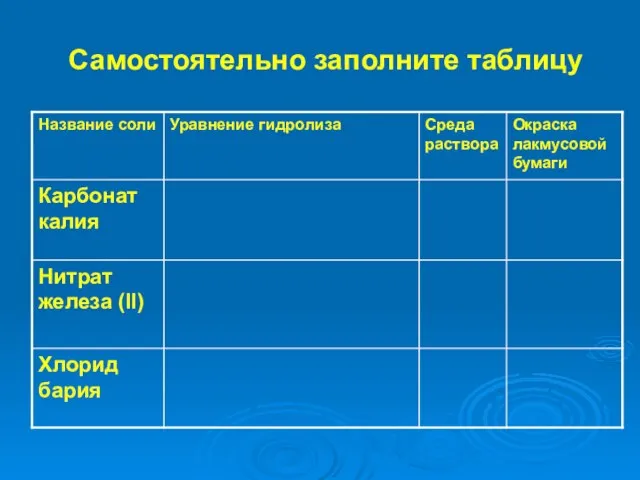
- 22. Самостоятельно заполните таблицу
- 23. Самостоятельно заполните таблицу
- 24. Роль гидролиза в природе Преобразование земной коры Обеспечение слабощелочной среды морской воды
- 25. Роль гидролиза в народном хозяйстве Порча производственного оборудования Выработка из непищевого сырья ценных продуктов (бумага, мыло,
- 26. Роль гидролиза в повседневной жизни человека Стирка Мытье посуды Умывание с мылом Процессы пищеварения
- 27. Ключ к оценке качества выполнения теста: Верные ответы: 1 вариант: 1а, 2б, 3а, S2- + HOH
- 28. Тема: Гидролиз солей Цель: изучить сущность гидролиза солей в водных растворах. Задачи : сформулировать определение понятия
- 30. Скачать презентацию



![Схема гидролиза хлорида алюминия AlCl3 Al(OH)3 HCl слабое основание сильная кислота [OH]-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/362173/slide-8.jpg)


![Схема гидролиза карбоната натрия Na2CO3 NaOH H2CO3 сильное основание слабая кислота [OH]-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/362173/slide-12.jpg)


![Схема гидролиза карбоната натрия NaCl NaOH HCl сильное основание сильная кислота [OH]-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/362173/slide-16.jpg)









 Новый менеджер в сформировавшейся команде – методы безболезненного внедрения Вершинина Екатерина
Новый менеджер в сформировавшейся команде – методы безболезненного внедрения Вершинина Екатерина SPE Outstanding Student Chapter and Gold Award Criteria
SPE Outstanding Student Chapter and Gold Award Criteria Предлог
Предлог Презентация на тему Физминутка для глаз
Презентация на тему Физминутка для глаз  Теплота згоряння палива. Розрахунок кількості теплоти внаслідок згоряння палива
Теплота згоряння палива. Розрахунок кількості теплоти внаслідок згоряння палива Вакцины от ВПЧ. Конкурентная борьба и стратегия работы врача женской консультации.Нужна ли нам государственная программа вакцина
Вакцины от ВПЧ. Конкурентная борьба и стратегия работы врача женской консультации.Нужна ли нам государственная программа вакцина Египетские пирамиды в Гизе
Египетские пирамиды в Гизе О дисциплинах цикла ГСЭ
О дисциплинах цикла ГСЭ Проект для сотрудников (шаблон)
Проект для сотрудников (шаблон) «Работа учреждения в рамках реализации закона 83-ФЗ»
«Работа учреждения в рамках реализации закона 83-ФЗ» Карикатурный портрет
Карикатурный портрет Am, is or are
Am, is or are ДОКЛАД: М.М. ТУЛЯГАНОВОЙ ОСОБЕННОСТИ НЕФОРМАЛЬНОЙ ЭКОНОМИКИ В РЕСПУБЛИКЕ УЗБЕКИСТАН
ДОКЛАД: М.М. ТУЛЯГАНОВОЙ ОСОБЕННОСТИ НЕФОРМАЛЬНОЙ ЭКОНОМИКИ В РЕСПУБЛИКЕ УЗБЕКИСТАН Кленовый лист, кленовый лист, ты мне среди зимы приснись
Кленовый лист, кленовый лист, ты мне среди зимы приснись Путешествия в сказку
Путешествия в сказку Визитная карточка школы
Визитная карточка школы ОПЕРАТИВНАЯ ПОЛИГРАФИЯ
ОПЕРАТИВНАЯ ПОЛИГРАФИЯ Учебный проектОсновные темы рассказа А.И. Куприна «Белый пудель»
Учебный проектОсновные темы рассказа А.И. Куприна «Белый пудель» London. Sightseeing of London
London. Sightseeing of London Документы и сведения, представляемые таможенным органам при прибытии на таможенную территорию Подготовили: студентки 3-го курса
Документы и сведения, представляемые таможенным органам при прибытии на таможенную территорию Подготовили: студентки 3-го курса  Логічні одиниці інформаціи
Логічні одиниці інформаціи Основы ЭКГ
Основы ЭКГ Английская монархия от завоевания до парламента
Английская монархия от завоевания до парламента Налоги. Объект налогообложения
Налоги. Объект налогообложения Освещение. Свет и тень. Правила распределения светотени в натюрморте
Освещение. Свет и тень. Правила распределения светотени в натюрморте Презентация "Художественный образ в произведениях музыки и изобразительного искусства" - скачать презентации по МХК
Презентация "Художественный образ в произведениях музыки и изобразительного искусства" - скачать презентации по МХК Учитель начальных классов высшей категории МОУ «СОШ №6» г. Бузулука Оренбургской области
Учитель начальных классов высшей категории МОУ «СОШ №6» г. Бузулука Оренбургской области Организация и планирование закупок. Тема 2
Организация и планирование закупок. Тема 2