Гранулоцитарный колониестимулирующий фактор (G-CSF, Г-КСФ): молекулярная биология, биотехнология, производство лекарственных форм, к
Содержание
- 2. Согласно современным представлениям эндокринная система наряду с нервной и иммунной обеспечивает функционирование в организме человека единой
- 3. Иммунитет и защита организма Нейтрофилы — один из элементов, реализующих защитную функцию иммунитета (1-я линия защиты).
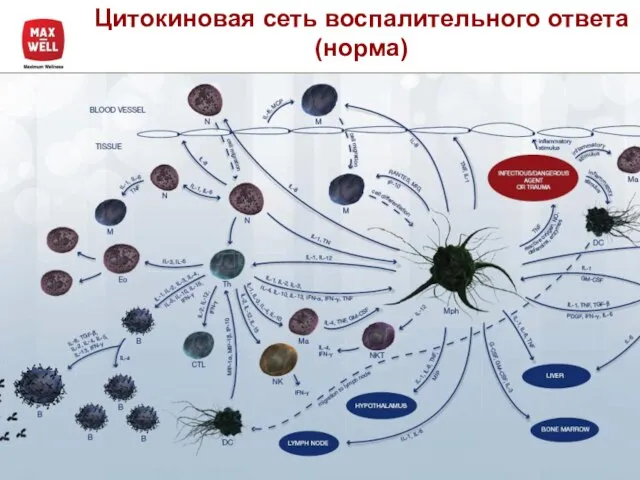
- 4. Цитокиновая сеть воспалительного ответа (норма)
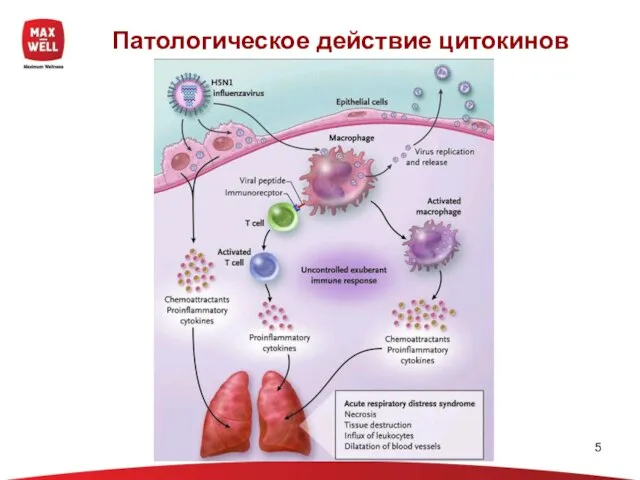
- 5. Патологическое действие цитокинов
- 6. Основные функции нейтрофилов Нейтрофилы в большом количестве первыми «прибывают» на «место инфекции». Длительность жизни нейтрофилов составляет
- 7. G-CSF: определение Гранулоцитарный колониестимулирующий фактор (Granulocyte Colony-Stimulating Factor, G-CSF) — ключевой регулятор выработки нейтрофилов. G-CSF широко
- 8. Колониестимулирующие факторы (CSFs): с чего все начиналось… 1967 г. Получено первоначальное представление о наличии факторов, от
- 9. G-CSF. История 1985 г. Первые очистки G-CSF до гомогенности. G-CSF впервые получили из плаценты и опухолевых
- 10. G-CSF продуцируется многими клетками: стромальными клетками костного мозга; эндотелиальными клетками; макрофагами; гранулоцитами; фибробластами; астроцитами.
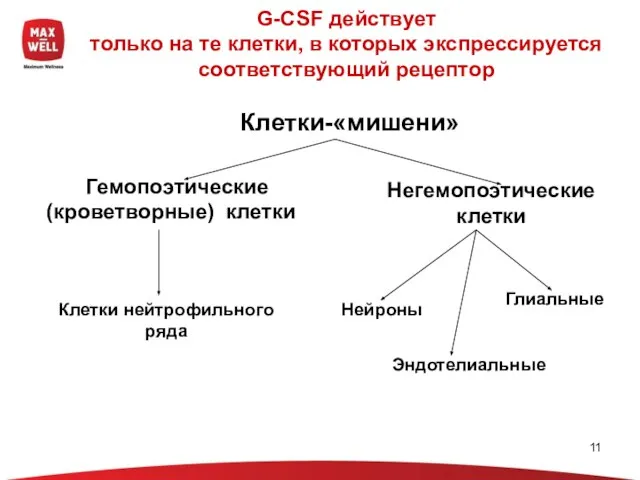
- 11. G-CSF действует только на те клетки, в которых экспрессируется соответствующий рецептор Гемопоэтические (кроветворные) клетки Негемопоэтические клетки
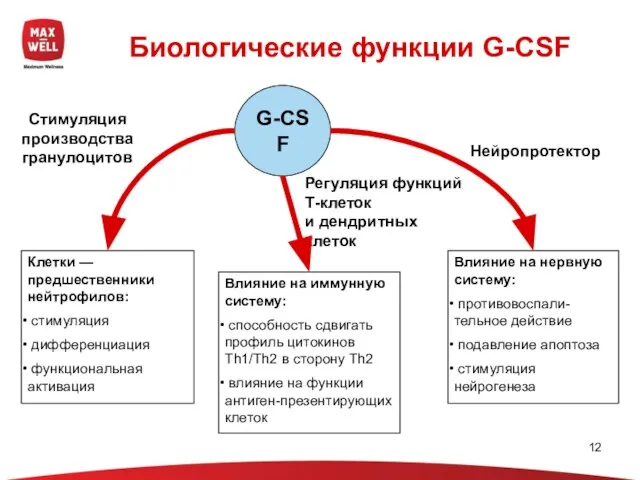
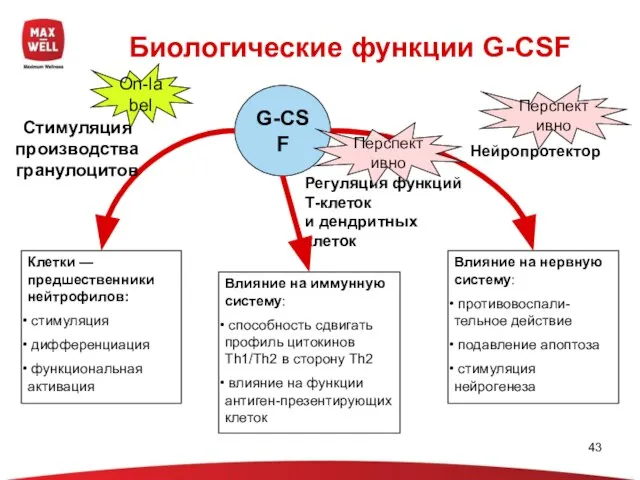
- 12. G-CSF Биологические функции G-CSF Клетки —предшественники нейтрофилов: стимуляция дифференциация функциональная активация Влияние на иммунную систему: способность
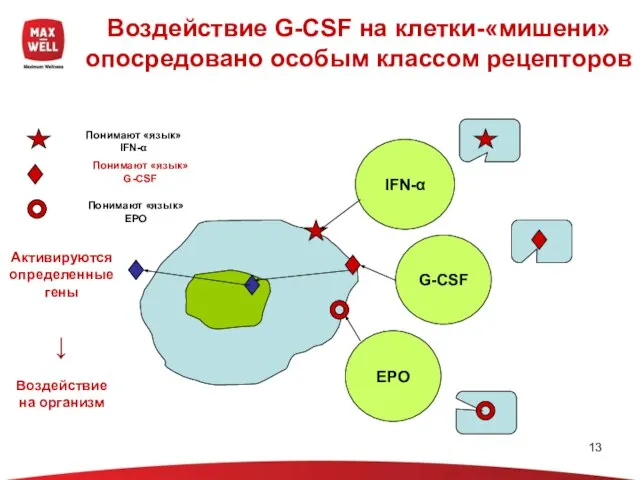
- 13. Воздействие G-CSF на клетки-«мишени» опосредовано особым классом рецепторов IFN-α EPO G-CSF Понимают «язык» IFN-α Понимают «язык»
- 14. Биологические функции G-CSF Осуществляются в основном посредством активации сигнального пути JAK / STAT. JAK / STAT
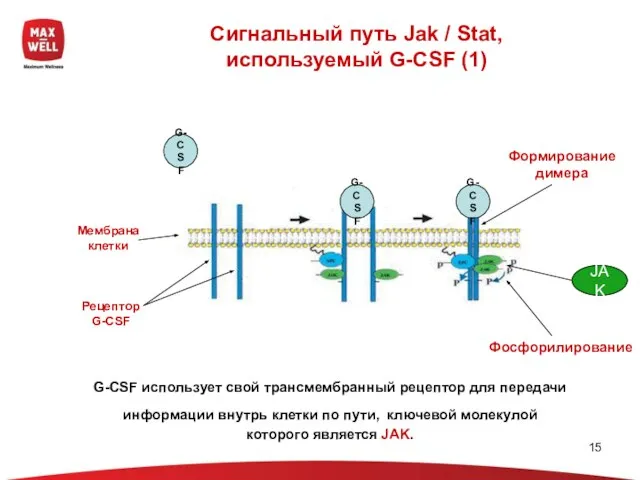
- 15. Сигнальный путь Jak / Stat, используемый G-CSF (1) Мембрана клетки Рецептор G-CSF G-CSF G-CSF G-CSF Формирование
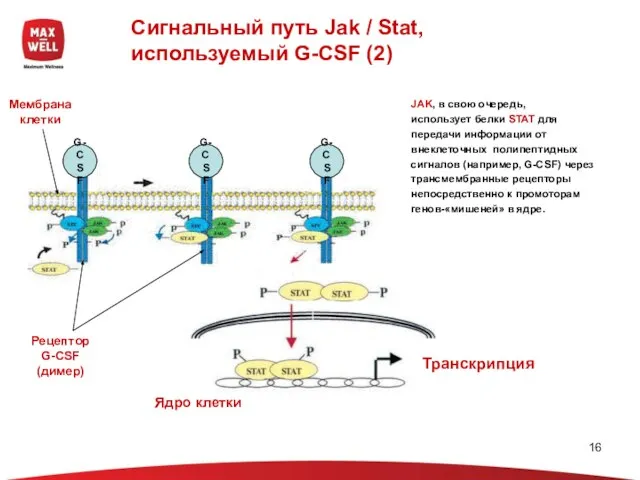
- 16. Сигнальный путь Jak / Stat, используемый G-CSF (2) Мембрана клетки Рецептор G-CSF (димер) Ядро клетки Транскрипция
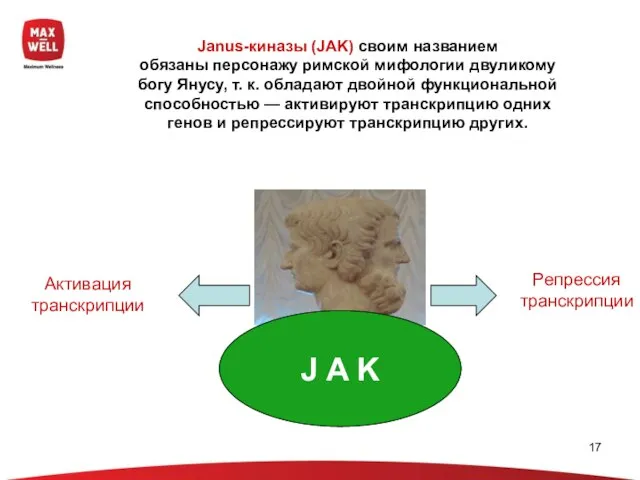
- 17. Janus-киназы (JAK) своим названием обязаны персонажу римской мифологии двуликому богу Янусу, т. к. обладают двойной функциональной
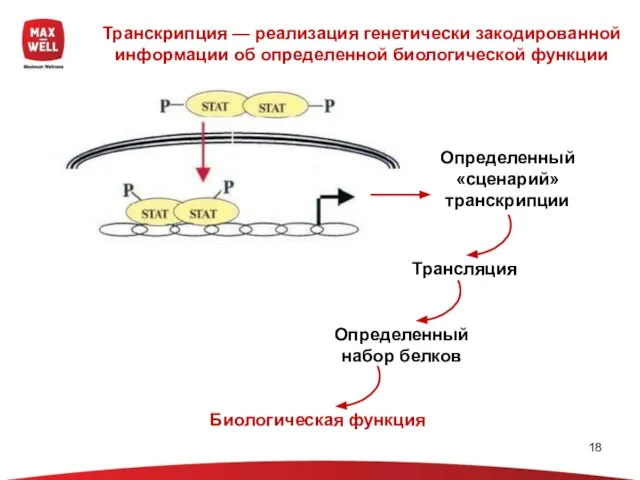
- 18. Транскрипция — реализация генетически закодированной информации об определенной биологической функции Определенный «сценарий» транскрипции Трансляция Определенный набор
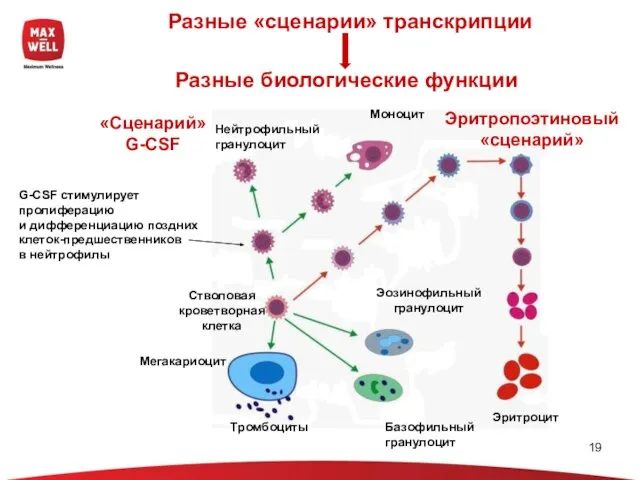
- 19. Разные «сценарии» транскрипции G-CSF стимулирует пролиферацию и дифференциацию поздних клеток-предшественников в нейтрофилы Разные биологические функции Эритропоэтиновый
- 20. G-CSF — гликопротеин Молекула G-CSF: углеводная часть — 4% Гликозилирование не играет важной роли ↓ Облегчен
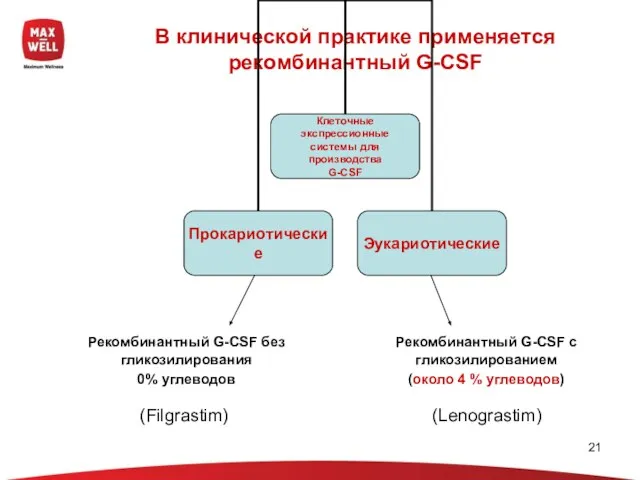
- 21. В клинической практике применяется рекомбинантный G-CSF Рекомбинантный G-CSF без гликозилирования 0% углеводов Рекомбинантный G-CSF с гликозилированием
- 22. Bönig H, Silbermann S, Weller S, Kirschke R, Körholz D, Janssen G, Göbel U, Nürnberger W.
- 23. Neupogen Производитель — Amgen, США. Показания к применению Снижение вероятности инфекции у пациентов с немиелоидными онкозаболеваниями,
- 24. Человеческий гранулоцитарный колониестимулирующий фактор (G-CSF) Производится с помощью рекомбинантных технологий Neupogen® содержит 175 аминокислот и имеет
- 25. Neupogen® является торговым названием филграстима компании Amgen Inc. Филграстим — химическое название рекомбинантного человеческого гранулоцитарного колониестимулирующего
- 26. Neupogen® представляет собой стерильную прозрачную бесцветную жидкость без консервантов для парентерального введения; содержит филграстим с удельной
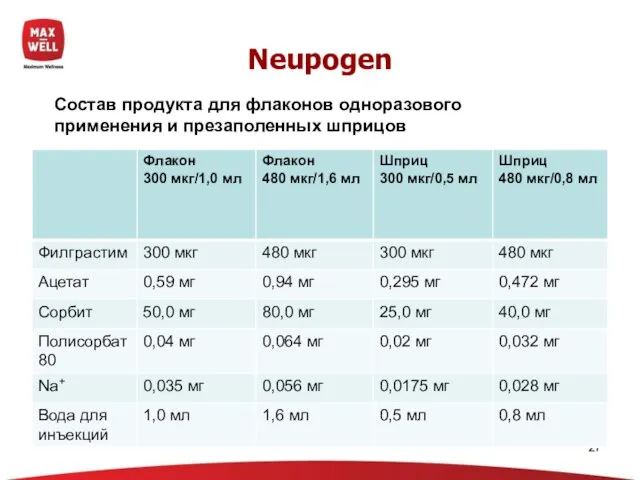
- 27. Neupogen Состав продукта для флаконов одноразового применения и презаполенных шприцов
- 28. Neulasta Производитель — Amgen, США. Показания к применению: снижение вероятности инфекции у пациентов с немиелоидными онкозаболеваниями,
- 29. Neulasta (пэгилированный филграстим) является ковалентным конъюгатом рекомбинантного человеческого Мet-G-CSF (филграстим) и монометокси-ПЭГ. Для получения ПЭГ-филграстима молекула
- 30. Neulasta представляет собой стерильный прозрачный бесцветный раствор без консервантов (pH 4,0). Neulasta выпускается в форме презаполненных
- 31. Granocyte Производитель — Chugai Pharmaceutical Co. Ltd., Tokyo, Japan / Mayne Pharma Pty Ltd, Australia. Показания
- 32. Granocyte содержит ленограстим — рекомбинатный гликопротеин, эквивалентный человеческому гранулоцитарному колониестимулирующему фактору (G-CSF). Ленограстим получают из клеток
- 33. Форма выпуска — лиофилизированный порошок во флаконе одноразового применения. GRANOCYTE 34 содержит 263 μg (33,6 млн
- 34. Лейкостим Производитель — «Биокад», Россия. Показания к применению Сокращение продолжительности нейтропении II–IV степени и снижение частоты
- 35. Международное непатентованное название (МНН): филграстим Лекарственная форма: раствор для внутривенного и подкожного введения Состав 1 мл
- 36. Филграстим Производитель — «Биофарма», Украина. Показания к применению Сокращение продолжительности и снижение частоты возникновения нейтропении, сопровождающейся
- 37. Международное непатентованное название: Filgrastim Основные свойства лекарственной формы: бесцветная или слабоокрашенная, прозрачная или слабоопалесцирующая жидкость. Состав
- 38. Leukine (rhu GM-CSF) (sargramostim) Производитель — BERLEX, Bayer HealthCare Biopharmaceuticals, USA. Показания к применению Использование при
- 39. LEUKINE® (сарграмостим) — это рекомбинантный человеческий грануло-макрофагальный колониестимулирующий фактор (rhu GM-CSF), произведенный с помощью рекомбинантной технологии
- 40. Форма выпуска: стерильный инъекционный раствор во флаконе (500 мкг/мл) с содержанием консерванта (1,1% бензилового спирта); стерильный
- 41. Leucomax (rhu GM-CSF) Производитель — Novartis/Schering-Plough, USA/Switzerland. Показания к применению При миелосупрессивной терапии (например, химиотерапии) для
- 42. Действующее вещество (МНН) — молграмоcтим (Molgramostim) Форма выпуска: флаконы, содержащие лиофилизированный порошок для инъекций. Для внутривенного
- 43. G-CSF Биологические функции G-CSF Клетки — предшественники нейтрофилов: стимуляция дифференциация функциональная активация Влияние на иммунную систему:
- 44. “Оn-label” области клинического применения рекомбинантного G-CSF Онкология, гематология Врожденные и приобретенные нарушения функции костного мозга Нейтропения,
- 45. Причины нейтропении при раке Противоопухолевая терапия может сопровождаться широким спектром системных побочных эффектов. Наиболее частые —
- 46. Причины нейтропении при раке (2) Принято считать, что для начала и проведения химиотерапии количество лейкоцитов в
- 47. G-CSF в онкологии В настоящее время для применения в онкологии коммерциализированы 4 препарата: Filgrastim (Neupogen) Amgen
- 48. Применение G-CSF в онкологии АSCO рекомендации (2006) 1. Снижение длительности нейтропении и частоты возникновения инфекционных осложнений:
- 49. Химиоиндуцированная нейтропения. Первичная профилактика АSCO рекомендации Применение колониестимулирующего фактора показано пациентам, получающим лечение по химиотерапевтическим схемам,
- 50. Химиоиндуцированная нейтропения. Вторичная профилактика ASCO рекомендации Использование CSFs может снизить вероятность фебрильной нейтропении в ходе последующих
- 51. Применение G-CSF для увеличения интенсивности химиотерапии Многие исследования показали, что применение G-CSF позволяет значительно увеличить интенсивность
- 52. Применение G-CSF для уменьшения периодов между курсами химиотерапии Общеизвестно, что, для того чтобы уменьшить опухолевую массу,
- 53. David C. Dale, Mary Ann Bonilla, Mark W. Davis, Arline M. Nakanishi, William P. Hammond, Joanne
- 54. GLUCKMAN, ELIANE , ROKICKA-MILEWSKA, RIITTA HANN, IAN 3, NIKIFORAKIS, EMMANOUEL ,TAVAKOLI, FILIPOS , COHEN-SCALI, SOPHIE, BACIGALUPO,
- 55. M. D. Green*, H. Koelbl, J. Baselga, A. Galid, V. Guillem, P. Gascon, S. Siena, R.
- 56. По данным исследований, проведенных на животных, G-CSF играет положительную роль в профилактике и лечении иммунных и
- 57. Нейропротекторные свойства G-CSF G-CSF: перспективные направления G-CSF-рецептор имеется на нейронах различных участков головного и спинного мозга,
- 58. Применение G-CSF обусловлено его свойством стимулировать стволовые клетки и таким образом способствовать образованию новых кровеносных сосудов
- 59. Treatment With AX200 (G-CSF) for Acute Ischemic Stroke Клиническое испытание, фаза II Период:12/2004–03/2007 Спонсор: Axaron Bioscience
- 60. Колониестимулирующие факторы: многообещающее направление, но пока не утверждены для лечения инсульта Масштабные КИ пока не проводились.
- 61. Нейтропения у ВИЧ-инфицированных Клинические исследования филграстима показали, что уменьшение нейтропении при ВИЧ снижает уровень заболеваемости и
- 62. Нейтропения у новорожденных ER Gillan, RD Christensen, Y Suen, et al. A Randomized, Placebo-Controlled Trial of
- 64. Скачать презентацию
















































 Мир геометрических фигур
Мир геометрических фигур Презентация на тему Организация и содержание физминутки на уроке
Презентация на тему Организация и содержание физминутки на уроке Мы за Новый мир! Движение за Новый Коммунизм
Мы за Новый мир! Движение за Новый Коммунизм Как выполнить выгрузкуотчетности в электронном виде из программ системы 1С:Предприятие
Как выполнить выгрузкуотчетности в электронном виде из программ системы 1С:Предприятие Неиспользуемые здания в коммунальной собственности Мостовского района, планируемые к продаже в 2012 году
Неиспользуемые здания в коммунальной собственности Мостовского района, планируемые к продаже в 2012 году СПП нерасчлененной структуры
СПП нерасчлененной структуры Курсовая работа
Курсовая работа Транспортное средство. Характеристика непрофильного актива
Транспортное средство. Характеристика непрофильного актива «Определение характерных черт портрета успешного предпринимателя »Проект Подготовили: Любченко Алёна и Няргинен ВикторияРуков
«Определение характерных черт портрета успешного предпринимателя »Проект Подготовили: Любченко Алёна и Няргинен ВикторияРуков И.И. Шишкин
И.И. Шишкин Круг обучения. Готовим профессионалов.
Круг обучения. Готовим профессионалов. Конституция Тыва
Конституция Тыва «Дело-КС» Автоматизация делопроизводства
«Дело-КС» Автоматизация делопроизводства Охрана материнства и детства в свете приоритетных правительственных программ Директор Департамента медико-социальных проблем с
Охрана материнства и детства в свете приоритетных правительственных программ Директор Департамента медико-социальных проблем с Тема проекта:«Здоровьесберегающие компоненты математического образования младшего школьника в свете стандарта второго поколен
Тема проекта:«Здоровьесберегающие компоненты математического образования младшего школьника в свете стандарта второго поколен Тургенев и Виардо
Тургенев и Виардо Менеджер по компенсациям и льготам. Профпереподготовка
Менеджер по компенсациям и льготам. Профпереподготовка 7 период развития соц.работы
7 период развития соц.работы Рынок труда: состав, состояние и перспективы развития.
Рынок труда: состав, состояние и перспективы развития. Игровые технологии в младшем школьном возрасте
Игровые технологии в младшем школьном возрасте Открытки с 9 мая
Открытки с 9 мая О введении комплексного курса
О введении комплексного курса Презентация на тему Народы России
Презентация на тему Народы России  Изменчивость. Мутации
Изменчивость. Мутации Презентация на тему Мастерство педагога
Презентация на тему Мастерство педагога Сирень 1945 года
Сирень 1945 года Методы составления и анализа семантического ядра
Методы составления и анализа семантического ядра Презентация на тему Одиночество
Презентация на тему Одиночество