Содержание
- 2. Положение в периодической системе КИСЛОРОД и СЕРА элементы VIA группы периодической системы Элементы этой группы имеют
- 3. Строение атома КИСЛОРОДА Электронные конфигурации атома: Степени окисления КИСЛОРОДА: -2, 0, +2 Валентность кислорода равна двум
- 4. Аллотропия КИСЛОРОДА Два аллотропных видоизменения химического элемента кислорода: кислород О2 озон О3 ВАСИЛИЙ КАДЕВИЧ 2008г.
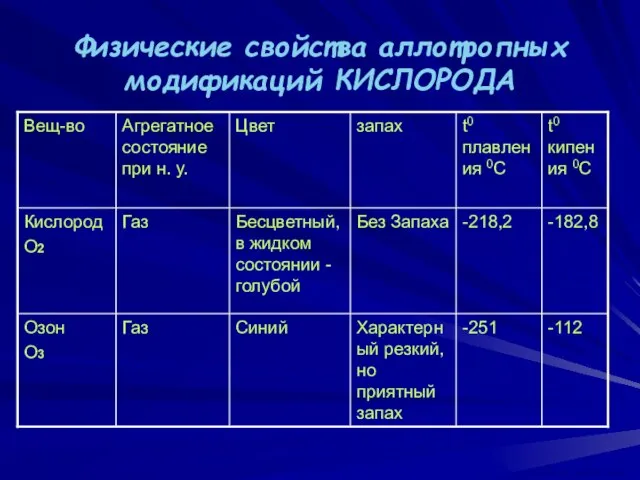
- 5. Физические свойства аллотропных модификаций КИСЛОРОДА ВАСИЛИЙ КАДЕВИЧ 2008г.
- 6. Озон химически активнее кислорода: Активность озона объясняется тем, что при его разложении образуется молекула кислорода и
- 7. Получение озона Реакция идет с поглощением энергии при прохождении электрического разряда через кислород, например во время
- 8. Получение кислорода Кислород (O2) в лаборатории получают разложением перманганата калия KMnO4 (марганцовки). 2KMnO4 = K2MnO4 +
- 9. В лаборатории кислород можно так же получать разложением других солей при нагревании 2KNO3=>2KNO2+O2 2KClO3=>2KCl+3O2 В промышленности
- 10. Химические свойства КИСЛОРОДА Кислород непосредственно реагирует со всеми простыми веществами, кроме золота, платины и галогенов. В
- 11. Взаимодействие с активными металлами Горение магния 2Mg + O2= 2MgO ВАСИЛИЙ КАДЕВИЧ 2008г.
- 12. Взаимодействие с другими неметаллами Горение серы в кислороде S + O2= SO2 ВАСИЛИЙ КАДЕВИЧ 2008г.
- 13. Горение углерода в кислороде С+О2= СО2 Горение фосфора в кислороде 4P + 5O2 = 2P2O5 ВАСИЛИЙ
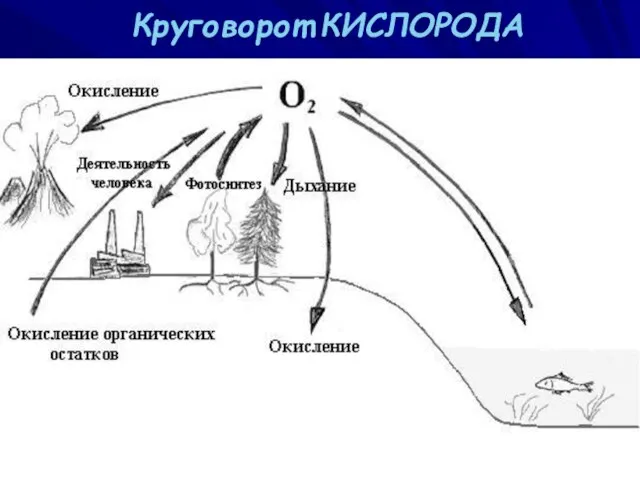
- 14. Круговорот КИСЛОРОДА
- 15. Применение КИСЛОРОДА В химической промышленности В производстве взрывчатых смесей При сварке и резке металлов В космической
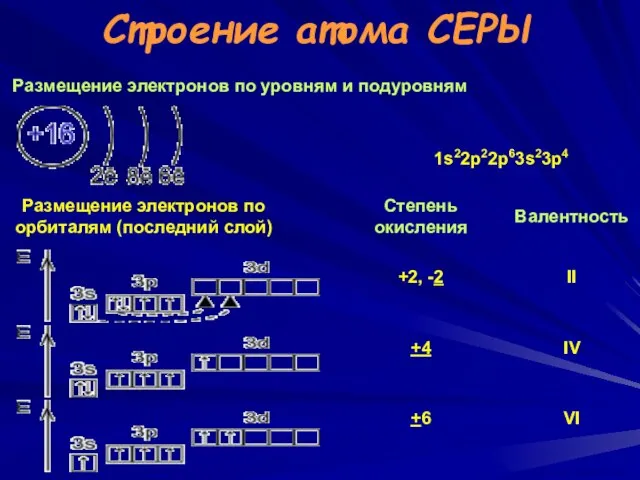
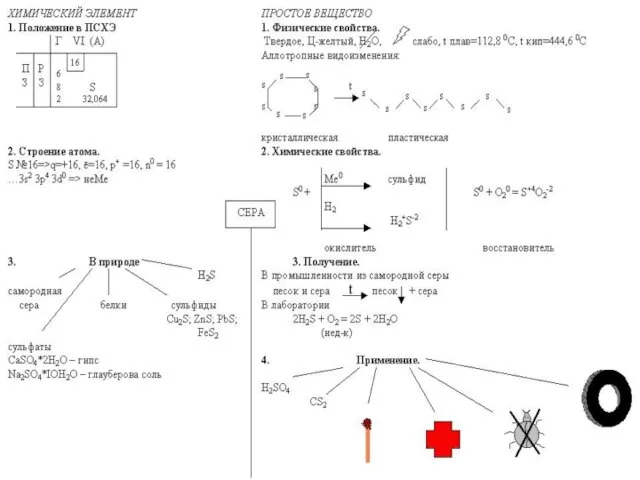
- 16. Строение атома СЕРЫ Размещение электронов по уровням и подуровням ВАСИЛИЙ КАДЕВИЧ 2008г.
- 17. Аллотропия СЕРЫ 1) ромбическая (α - сера) - S8 t°пл. = 113°C; ρ = 2,07 г/см3
- 18. Получение СЕРЫ 1. Промышленный метод - выплавление из руды с помощью водяного пара. 2. Неполное окисление
- 19. Химические свойства СЕРЫ Окислительные свойства серы (S0 + 2ē => S-2) 1) Сера реагирует со щелочными
- 20. Восстановительные свойства сера проявляет в реакциях с сильными окислителями: (S0 - 2ē => S+2; S0- 4ē
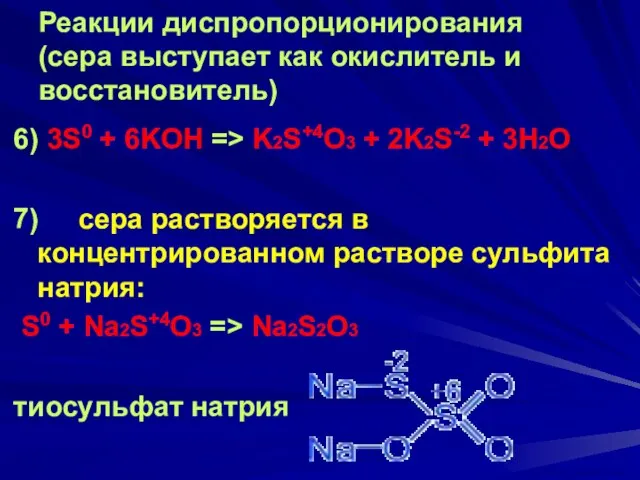
- 21. Реакции диспропорционирования (сера выступает как окислитель и восстановитель) 6) 3S0 + 6KOH => K2S+4O3 + 2K2S-2
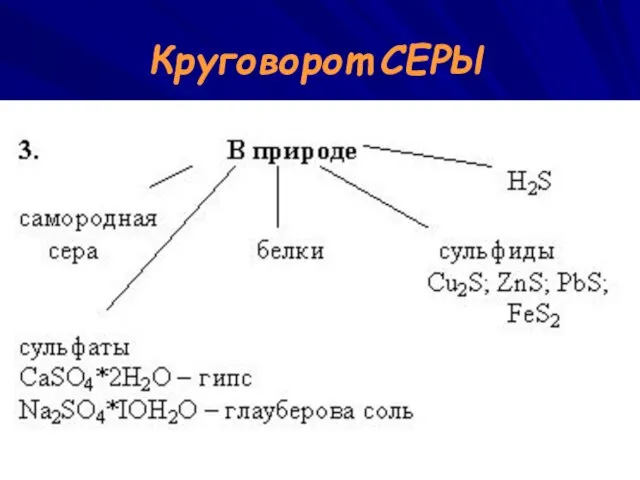
- 22. Круговорот СЕРЫ
- 23. Применение СЕРЫ Вулканизация каучука Получение эбонита Производство спичек, пороха В борьбе с вредителями сельского хозяйства Для
- 26. Скачать презентацию

















 Методика ServQual
Методика ServQual Катя Царева представляет картины
Катя Царева представляет картины Общение и коммуникация
Общение и коммуникация PROTsEDURNYE_I_PROTsESSUAL_NYE_PRAVOOTNOShENIYa
PROTsEDURNYE_I_PROTsESSUAL_NYE_PRAVOOTNOShENIYa RAZREZY
RAZREZY Концепт-дизайн салонов маникюра LAKMODA
Концепт-дизайн салонов маникюра LAKMODA Презентация на тему Научно-практическая конференция
Презентация на тему Научно-практическая конференция Мы работаем на периметре незнания
Мы работаем на периметре незнания Об авторе Установка Ремонт камина Акции Каталог Галерея работ Отзывы Контакты
Об авторе Установка Ремонт камина Акции Каталог Галерея работ Отзывы Контакты Логистика - основные рабочие статусы
Логистика - основные рабочие статусы Презентация на тему Викторина ПДД
Презентация на тему Викторина ПДД  Создание и ведение блогов и сайтов по учебным предметам
Создание и ведение блогов и сайтов по учебным предметам ПАПКА ИНДИВИДУАЛЬНОЙ РАБОТЫ СЛУШАТЕЛЯ КУРСОВ ПОВЫШЕНИЯ КВАЛИФИКАЦИИ УЧИТЕЛЕЙ РУССКОГО ЯЗЫКА В ШКОЛАХ С УЗБЕКСКИМ ЯЗЫКОМ ОБУЧЕН
ПАПКА ИНДИВИДУАЛЬНОЙ РАБОТЫ СЛУШАТЕЛЯ КУРСОВ ПОВЫШЕНИЯ КВАЛИФИКАЦИИ УЧИТЕЛЕЙ РУССКОГО ЯЗЫКА В ШКОЛАХ С УЗБЕКСКИМ ЯЗЫКОМ ОБУЧЕН Социальная психология практическое. Задание №8
Социальная психология практическое. Задание №8 Кадетский корпус МВД МЧС УГ №3 им. О.Г. Макарова. Проведение мероприятий, акций
Кадетский корпус МВД МЧС УГ №3 им. О.Г. Макарова. Проведение мероприятий, акций Былина как жанр. Герои былин
Былина как жанр. Герои былин Электронная почта. E-mail
Электронная почта. E-mail Осень. Магнитогорский педагогический колледж
Осень. Магнитогорский педагогический колледж Проект «мой Пушкин»
Проект «мой Пушкин» Sport in Britain
Sport in Britain Службы сопровождения в коррекционно-развивающем образовании
Службы сопровождения в коррекционно-развивающем образовании МГД-возмущениямагнитосферной плазмыУНЧ-диапазона
МГД-возмущениямагнитосферной плазмыУНЧ-диапазона Добро и зло. Понятие греха, раскаяния и воздаяния
Добро и зло. Понятие греха, раскаяния и воздаяния Презентация на тему Изделия из теста
Презентация на тему Изделия из теста Презентация на тему Игра как метод экологического воспитания
Презентация на тему Игра как метод экологического воспитания Презентация к уроку математики в 1 классе по УМК «Школа России»
Презентация к уроку математики в 1 классе по УМК «Школа России» Получение выкройки швейного изделия из журналов мод
Получение выкройки швейного изделия из журналов мод At the restaurant
At the restaurant