Содержание
- 2. В своей педагогической деятельности использую технологию развивающего обучения, направленную на обеспечение личности гимназиста. При данной технологии
- 3. Al
- 4. Использую компьютер для проверки и закрепления некоторых тем: «Типы химических связей», «Классы неорганических веществ» и др.
- 5. Химическая связь
- 6. Из нижеприведённых формул веществ выпишите формулы в данные столбцы: F2, BaI2, H2O, FeCI3,CaF2, Li3N, O2, CO,
- 7. Из нижеприведённых формул веществ выпишите формулы в данные столбцы: F2, BaI2, H2O, FeCI3,CaF2, Li3N, O2, CO,
- 8. Из нижеприведённых формул веществ выпишите формулы в данные столбцы: F2, BaI2, H2O, FeCI3,CaF2, Li3N, O2, CO,
- 9. Из нижеприведённых формул веществ выпишите формулы в данные столбцы: F2, BaI2, H2O, FeCI3,CaF2, Li3N, O2, CO,
- 10. Почему идут химические реакции
- 11. Задачи урока. Систематизировать и углубить знания учащихся о законе сохранения энергии и превращениях её при химических
- 12. План урока Закон сохранения энергии в химических реакциях. Экзо- и эндотермические реакции. Тепловой эффект реакции. Термохимические
- 13. Какой общий признак объединяет следующие реакции: Горение спирта Взрыв тротила Нейтрализация кислоты щелочью Взаимодействие натрия с
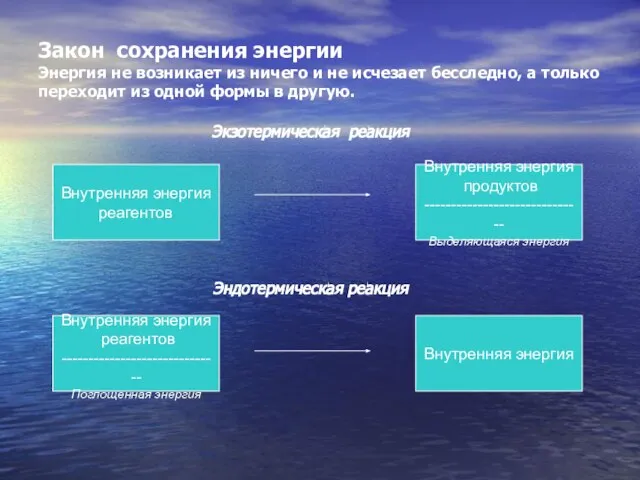
- 14. Закон сохранения энергии Энергия не возникает из ничего и не исчезает бесследно, а только переходит из
- 15. Тепловой эффект реакции. Термохимические уравнения . Как подсчитать тепловой эффект реакции? H2 + CI2 2HCI EH-H=436
- 16. Теплота образования соединения (Qобр)-это тепловой эффект реакции образования одного моля соединения из простых веществ, устойчивых в
- 17. Закон Г. И. Гесса Тепловой эффект химической реакции не зависит от промежуточных стадий ( при условии,
- 18. задача Исходя из следующих данных : CH4= C(графит) + 2H2 – 74,9 кДж, C (графит) +
- 20. Скачать презентацию















 Ху Цзисян
Ху Цзисян Гласные и согласные звуки и буквы
Гласные и согласные звуки и буквы Презентация Microsoft PowerPoint
Презентация Microsoft PowerPoint Електронна реєстрація фізичних осіб в якості підприємців
Електронна реєстрація фізичних осіб в якості підприємців 8
8 Презентация на тему Площадь параллелограмма, треугольника, трапеции
Презентация на тему Площадь параллелограмма, треугольника, трапеции Образ жизни народов мира. Королевство Испания
Образ жизни народов мира. Королевство Испания Легкая атлетика
Легкая атлетика Социальная значимость библиотеки и критерии оценки качества её деятельности
Социальная значимость библиотеки и критерии оценки качества её деятельности Перестрахование ипотечных обязательств по стандартам СК АИЖК
Перестрахование ипотечных обязательств по стандартам СК АИЖК математика
математика Файловая система
Файловая система Монетарная политика
Монетарная политика Слайд-шоу ГТО. Регистрация на сайте
Слайд-шоу ГТО. Регистрация на сайте Windows Movie Maker
Windows Movie Maker Итоги третьей четверти
Итоги третьей четверти Буква Ж
Буква Ж Опыт Австралии по освоению месторождений полезных ископаемых на территориях с трудными природными условиями
Опыт Австралии по освоению месторождений полезных ископаемых на территориях с трудными природными условиями Включение учащихся в познавательную и научно-исследовательскую деятельность – действенный путь развития устойчивой мотивации в
Включение учащихся в познавательную и научно-исследовательскую деятельность – действенный путь развития устойчивой мотивации в  Детство, опалённое войной
Детство, опалённое войной © Толоконникова С.В., учитель английского языка, школа 92.
© Толоконникова С.В., учитель английского языка, школа 92. Интеллектуальный турнир "Юные знатоки филологии"
Интеллектуальный турнир "Юные знатоки филологии" Что такое симметрия? Как получить симметричные детали?
Что такое симметрия? Как получить симметричные детали? Привалова Татьяна Николаевна
Привалова Татьяна Николаевна Презентация на тему:«Наш класс – самый спортивный класс!»
Презентация на тему:«Наш класс – самый спортивный класс!» Жизненный путь новомученицы Татианы Гримблит (1903-1937)
Жизненный путь новомученицы Татианы Гримблит (1903-1937) Гуманистические воспитательные системы: опыт построения и развития
Гуманистические воспитательные системы: опыт построения и развития Личностно-ориентированное обучение в начальной школе
Личностно-ориентированное обучение в начальной школе