Содержание
- 2. Предмет металлоорганической химии: соединения со связью металл-углерод Считается, что связь поляризована Mδ+−Cδ −
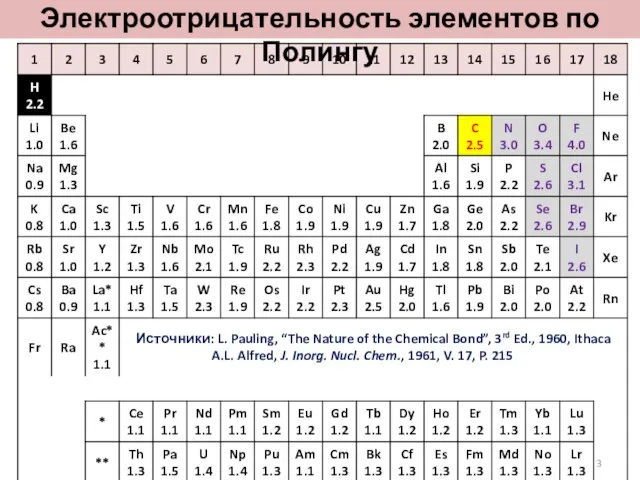
- 3. Электроотрицательность элементов по Полингу
- 4. Факторы, влияющие на электроотрицательность 1) Гибридизация атома углерода: EN(C) увеличивается с увеличением вклада s-орбитали в гибридные
- 5. 2) Степень окисления металла: EN(C) увеличивается с увеличением степени окисления элемента EN(Tl(I)) = 1.62 EN(Tl(III)) =
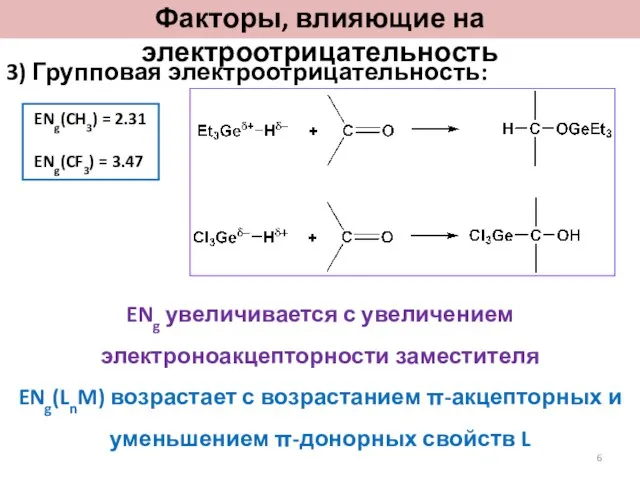
- 6. 3) Групповая электроотрицательность: ENg(CH3) = 2.31 ENg(CF3) = 3.47 ENg увеличивается с увеличением электроноакцепторности заместителя ENg(LnM)
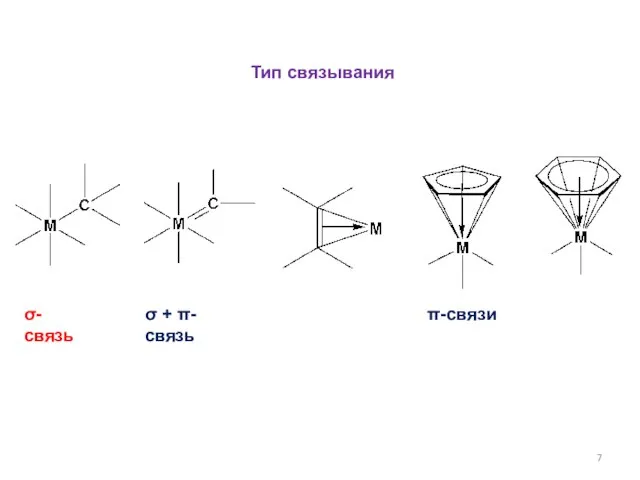
- 7. Тип связывания σ-связь σ + π-связь π-связи
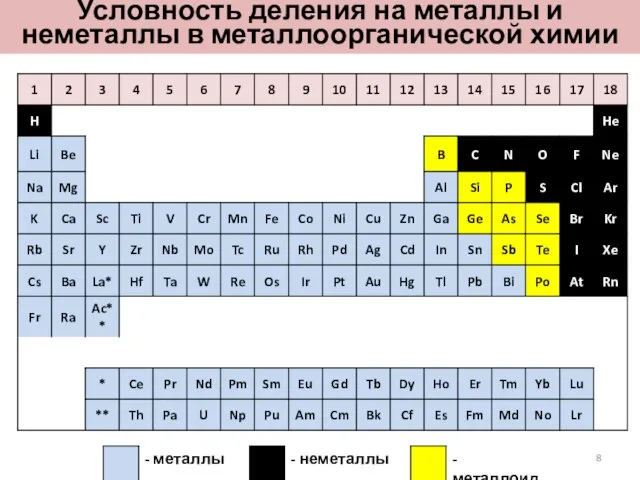
- 8. Условность деления на металлы и неметаллы в металлоорганической химии
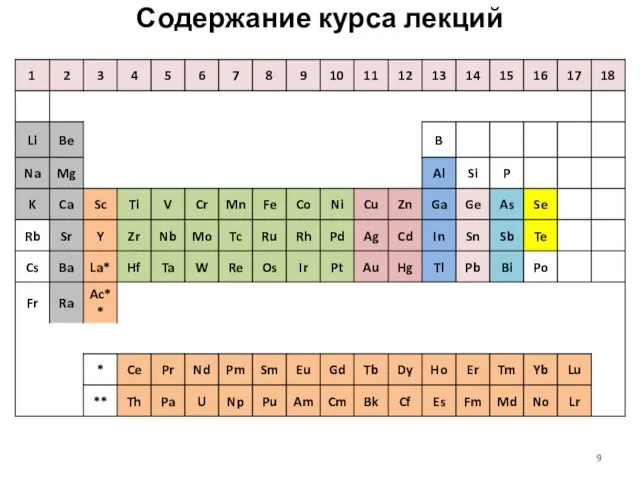
- 9. Содержание курса лекций
- 10. Литература Основная К. Эльшенбройх . Металлоорганическая химия. Пер. с нем. Ю.Ф.Опруненко и Д.С.Перекалина, Москва: БИНОМ. Лаборатория
- 11. Литература Дополнительная Comprehensive Organometallic Chemistry, 3-th ed., N. -Y., 2006 Методы элементоорганической химии. Т.В. Талалаева, К.
- 12. Литература Дополнительная Herrmann/Brauer , Synthetic Methods of Organometallic and Inorganic Chemistry, Ed. W.A. Herrmann, Thieme, in
- 13. Краткая история развития металлоорганической химии – основные события и люди
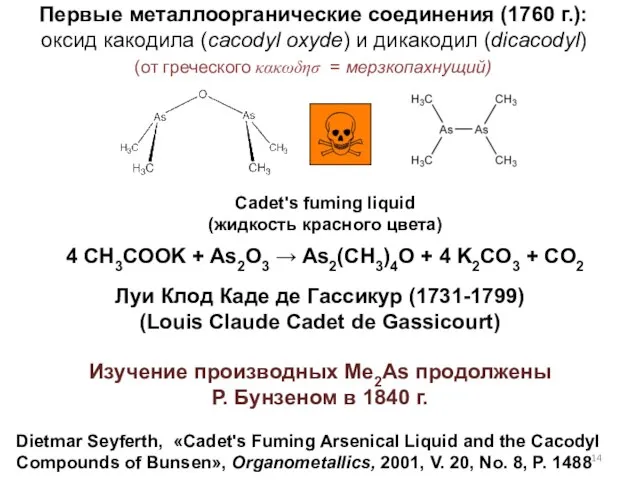
- 14. Dietmar Seyferth, «Cadet's Fuming Arsenical Liquid and the Cacodyl Compounds of Bunsen», Organometallics, 2001, V. 20,
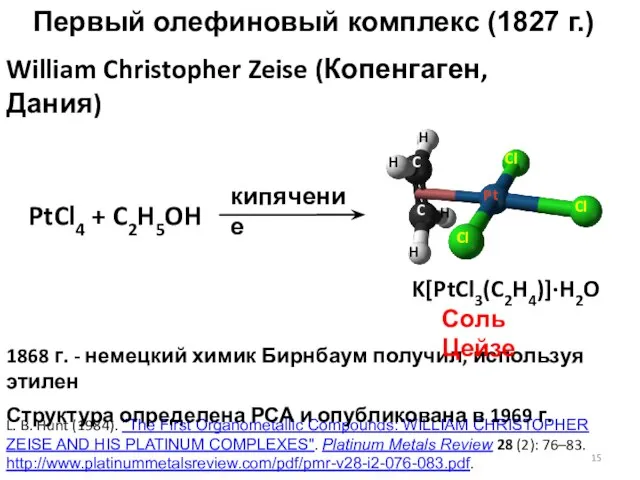
- 15. Первый олефиновый комплекс (1827 г.) William Christopher Zeise (Копенгаген, Дания) L. B. Hunt (1984). "The First
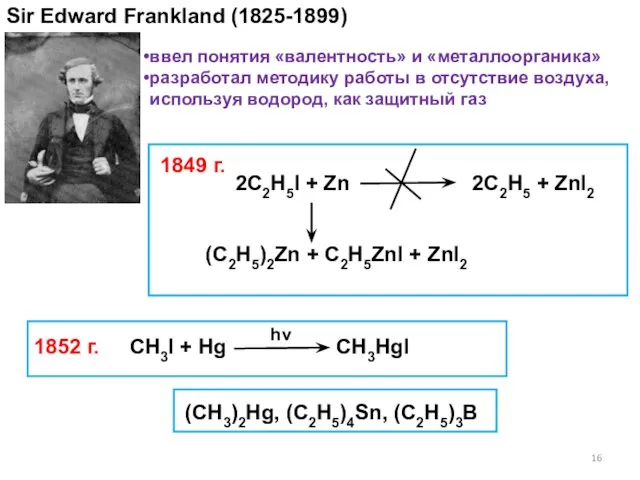
- 16. Sir Edward Frankland (1825-1899) 2C2H5I + Zn 2C2H5 + ZnI2 1849 г. 1852 г. ввел понятия
- 17. В последующие годы R2Hg и R2Zn сыграли очень большую роль в развитии металлоорганического синтеза Например: SiCl4
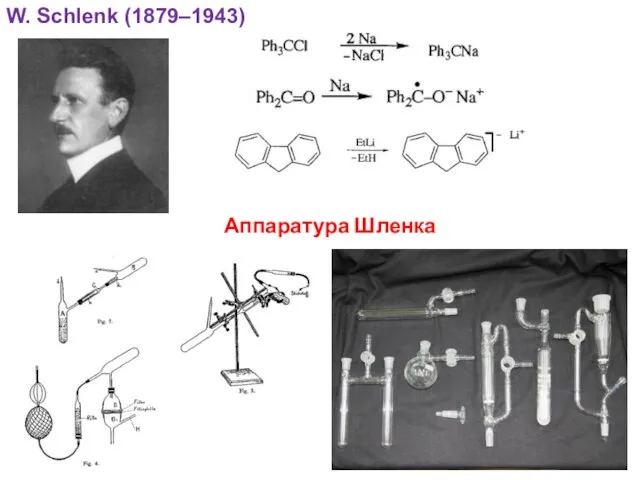
- 18. W. Schlenk (1879–1943) Аппаратура Шленка
- 19. Д.И. Менделеев (1834-1907) использовал знание о металлоорганических соединениях для предсказания новых элементов
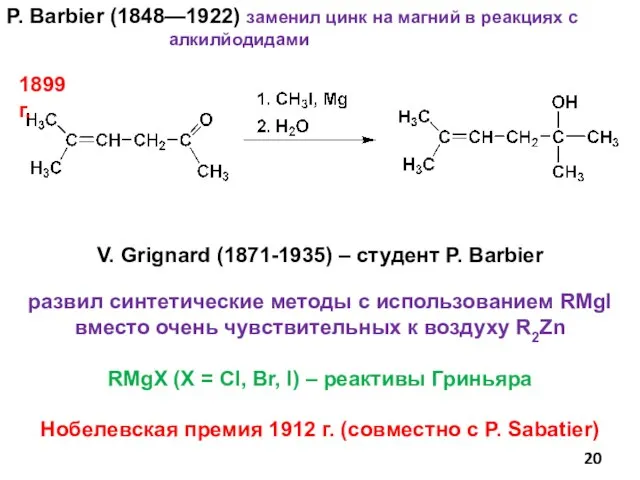
- 20. P. Barbier (1848—1922) заменил цинк на магний в реакциях с алкилйодидами V. Grignard (1871-1935) – студент
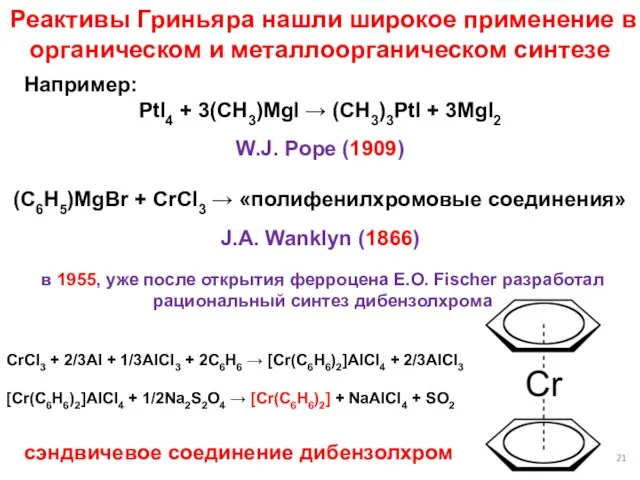
- 21. Реактивы Гриньяра нашли широкое применение в органическом и металлоорганическом синтезе Например: PtI4 + 3(CH3)MgI → (CH3)3PtI
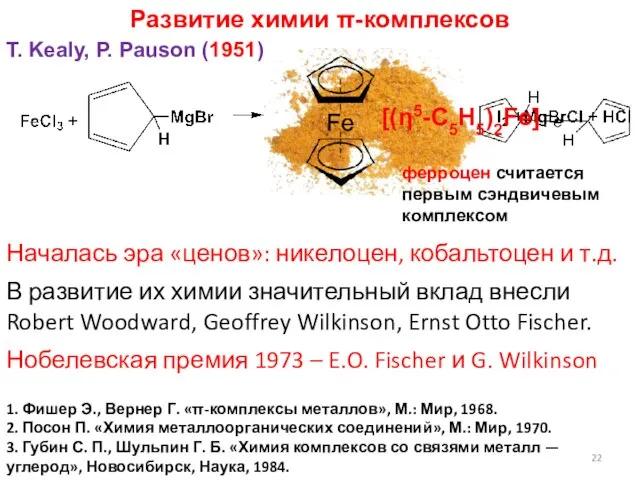
- 22. Развитие химии π-комплексов T. Kealy, P. Pauson (1951) 1. Фишер Э., Вернер Г. «π-комплексы металлов», М.:
- 23. Развитие химии π-комплексов 1959 г. R. Criegee (1902-1975) – синтез [(η4-C4Me4)NiCl2]2 1965 г. R. Petit –
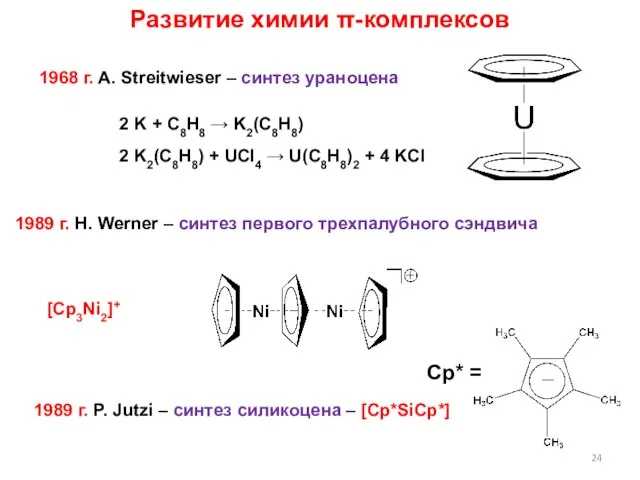
- 24. Развитие химии π-комплексов 1968 г. A. Streitwieser – синтез ураноцена 2 K + C8H8 → K2(C8H8)
- 25. 1989 г. H. Schnöckel – разработка синтеза AlCl(solv) и далее – [Cp*Al]4 1994 г. S. Harder
- 26. Карбонильные комплексы 1868 г. M.P. Schützenberger – синтез первого карбонильного комплекса [Pt(CO)Cl2]2 1890 г. L. Mond
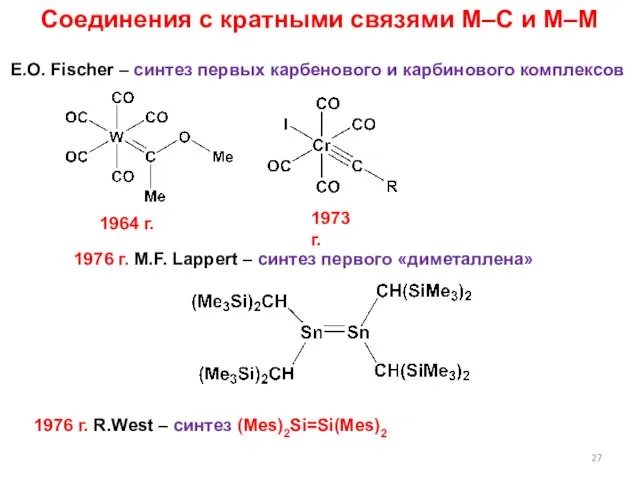
- 27. Соединения с кратными связями M–C и M–M E.O. Fischer – синтез первых карбенового и карбинового комплексов
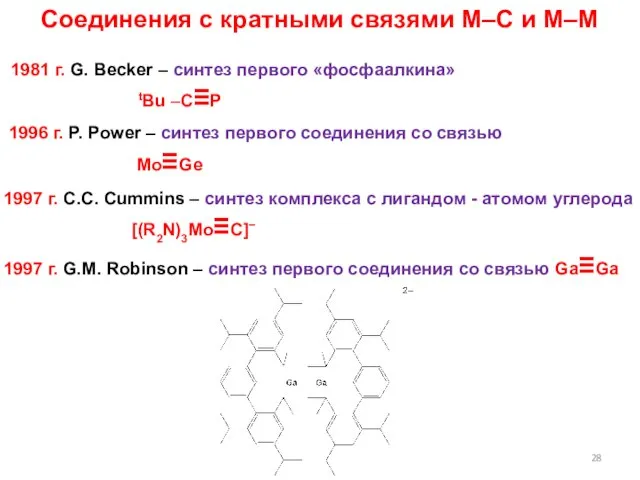
- 28. Соединения с кратными связями M–C и M–M 1981 г. G. Becker – синтез первого «фосфаалкина» tBu
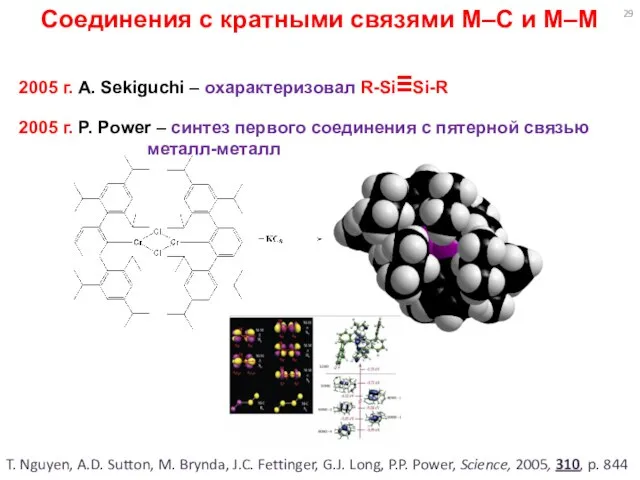
- 29. Соединения с кратными связями M–C и M–M 2005 г. A. Sekiguchi – охарактеризовал R-Si≡Si-R 2005 г.
- 30. 2004 г. E. Carmona – синтез первого соединения с пятерной связью металл-металл Соединения с необычными связями
- 31. История прикладной элементоорганической химии Катализ 1922 г. T. Midgley, T.A. Boyd – внедрили [Et4Pb] в качестве
- 32. История прикладной элементоорганической химии Катализ (Нобелевская премия 1973 г.) 1965 г. G. Wilkinson, R.S. Coffey –
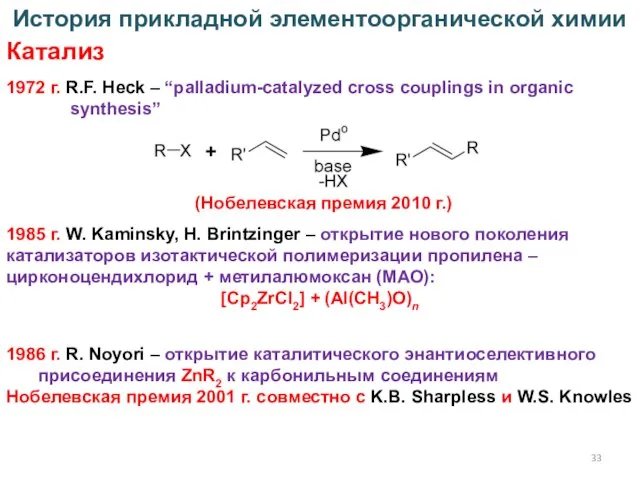
- 33. 1972 г. R.F. Heck – “palladium-catalyzed cross couplings in organic synthesis” История прикладной элементоорганической химии Катализ
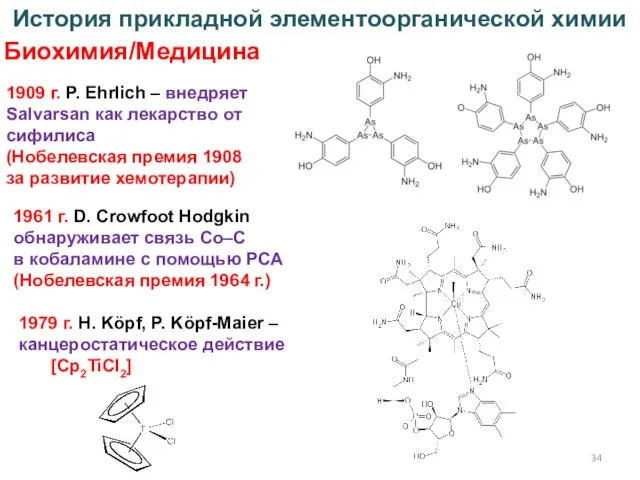
- 34. История прикладной элементоорганической химии Биохимия/Медицина 1909 г. P. Ehrlich – внедряет Salvarsan как лекарство от сифилиса
- 36. Скачать презентацию









![Развитие химии π-комплексов 1959 г. R. Criegee (1902-1975) – синтез [(η4-C4Me4)NiCl2]2 1965](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/362032/slide-22.jpg)
![1989 г. H. Schnöckel – разработка синтеза AlCl(solv) и далее – [Cp*Al]4](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/362032/slide-24.jpg)
![Карбонильные комплексы 1868 г. M.P. Schützenberger – синтез первого карбонильного комплекса [Pt(CO)Cl2]2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/362032/slide-25.jpg)



 Технология точения декоративных изделий, имеющих внутренние полости
Технология точения декоративных изделий, имеющих внутренние полости Украшаем новогодний стол. Декор для несладких блюд
Украшаем новогодний стол. Декор для несладких блюд Qatar airways
Qatar airways Евсеева Юлия, 7в класс
Евсеева Юлия, 7в класс Инфляция и антиинфляционная политика
Инфляция и антиинфляционная политика Долгосрочные прогнозы выбросов парниковых газов
Долгосрочные прогнозы выбросов парниковых газов КП 28.09
КП 28.09 Крымская война 1853-1856 гг. Оборона Севастополя
Крымская война 1853-1856 гг. Оборона Севастополя Презентация "Язычество древних славян. Духи" - скачать презентации по МХК
Презентация "Язычество древних славян. Духи" - скачать презентации по МХК Внеклассное мероприятие
Внеклассное мероприятие Проект "Школьная газета"
Проект "Школьная газета" Norwegian University of Science and Technology
Norwegian University of Science and Technology Історія, стан і перспективи розвитку виробництва виробів з деревини. Тема 12
Історія, стан і перспективи розвитку виробництва виробів з деревини. Тема 12 О подготовке к проведению государственной (итоговой) аттестации обучающихся, освоивших основные общеобразовательные программы с
О подготовке к проведению государственной (итоговой) аттестации обучающихся, освоивших основные общеобразовательные программы с Элементы таблицы Менделеева
Элементы таблицы Менделеева СРС на тему: Острая задержка мочи у детей
СРС на тему: Острая задержка мочи у детей I ВСЕМИРНЫЙ РЕКЛАМНЫЙ ФОРУМ
I ВСЕМИРНЫЙ РЕКЛАМНЫЙ ФОРУМ Предварительная подготовка к выезду
Предварительная подготовка к выезду Книжная и промышленная графика
Книжная и промышленная графика Утро четвертого дня - собираемся на онлайн-подключение
Утро четвертого дня - собираемся на онлайн-подключение ПРОГНОЗ ПОГОДЫ И ГРАФИКИ
ПРОГНОЗ ПОГОДЫ И ГРАФИКИ Комфортность и дискомфортность климатических условий
Комфортность и дискомфортность климатических условий Unit 1 Speaking about seasons and weather
Unit 1 Speaking about seasons and weather Устройство ПК и его характеристики
Устройство ПК и его характеристики Платформа Net
Платформа Net Алиментные обязательства супругов и бывших супругов (глава 14 СК).
Алиментные обязательства супругов и бывших супругов (глава 14 СК). Презентация на тему Изображение рельефа на планах и картах
Презентация на тему Изображение рельефа на планах и картах  Презентация на тему Подготовка к ЕГЭ по математике
Презентация на тему Подготовка к ЕГЭ по математике