Содержание
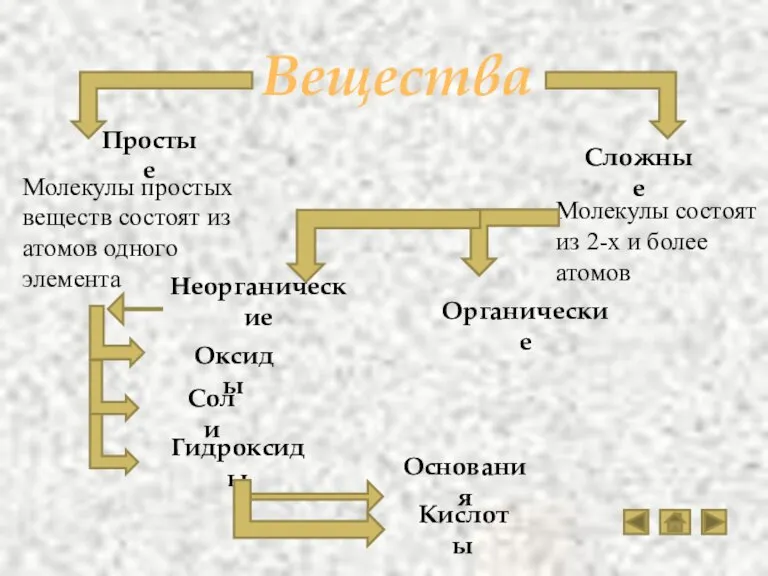
- 2. Вещества Простые Неорганические Органические Сложные Оксиды Соли Гидроксиды Кислоты Основания Молекулы простых веществ состоят из атомов
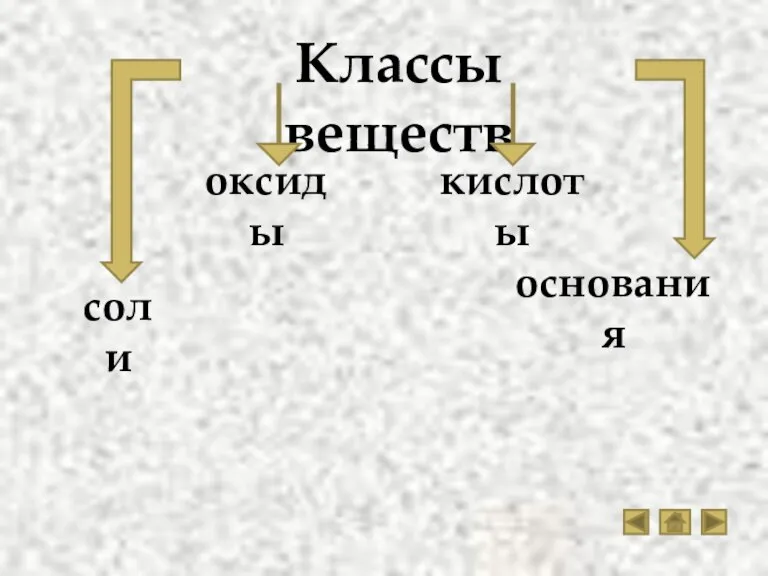
- 3. Классы веществ кислоты основания соли оксиды
- 4. Оксиды Солеобразующие Несолеобразующие это сложные вещества, состоящие из двух химических элементов, один из которых — кислород
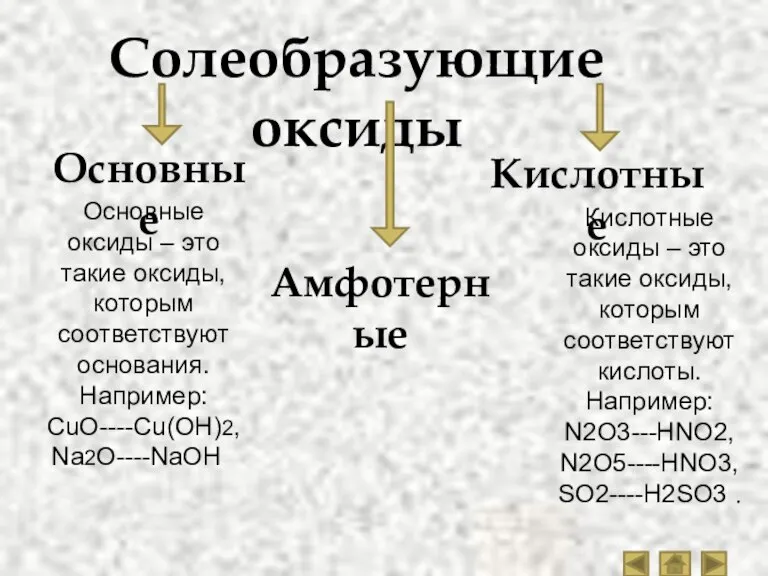
- 5. Солеобразующие оксиды Основные Амфотерные Кислотные Основные оксиды – это такие оксиды, которым соответствуют основания. Например: CuO----Cu(OH)2,
- 6. Основный оксид + кислота соль + вода. (реакция обмена) CuO + 2HNO3 = Cu(NO3)2 + H2O
- 7. Кислотный оксид + основание соль + вода. (реакция обмена) SO2 + 2NaOH = Na2SO3 + H2O
- 8. Кислоты Этот класс соединений широко распространен в природе. В желудке человека содержится сильная бескислородная одноосновная соляная
- 9. Кислоты – это сложные вещества, которые состоят из атомов водорода и кислотного остатка.
- 10. Химические свойства кислот Кислота + основание соль + вода. (реакция обмена) HСl + NaOH = NaCl
- 11. Кислота + металл соль + водород. (реакция замещения) 1)Металл должен находиться в ряду стандартных электронных потенциалов
- 12. Основания – это сложные вещества, в состав которых входят атомы металла, связанные с одной или несколькими
- 13. Основания Водные растворы щелочей, мылкие на ощупь, разъедают кожу, ткань, изменяют окраску индикаторов. Нерастворимые основания этими
- 14. Свойства оснований Типичные реакции оснований Основание + оксид неметалла соль + вода. ( реакция обмена) 2KOH
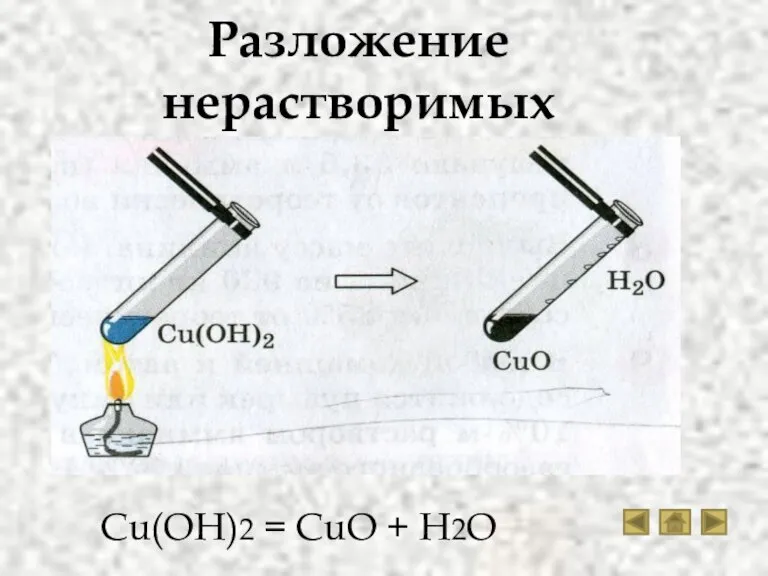
- 15. Разложение нерастворимых оснований Cu(OH)2 = CuO + H2O
- 16. Соли Соли – это сложные вещества, состоящие из атомов металлов и кислотных остатков.
- 17. Соли имеют самые различные цвета: а - медный купорос; б - дихромат калия; в - желтая
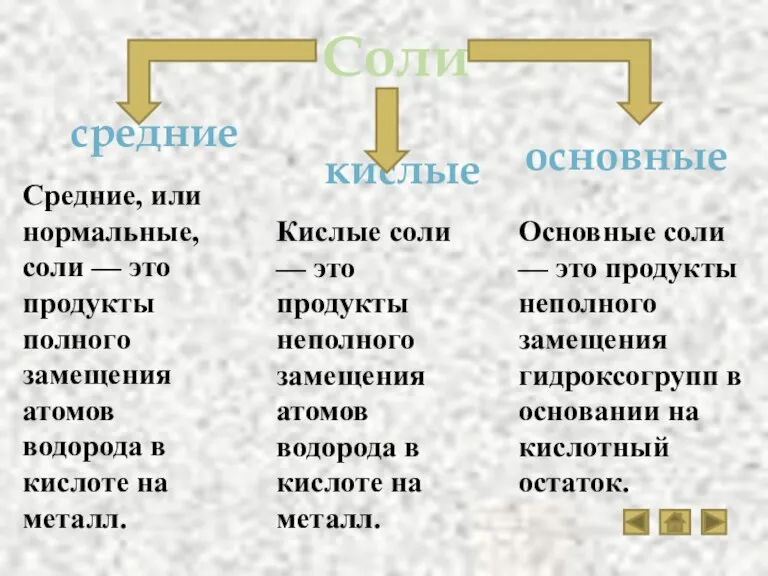
- 18. Соли кислые средние основные Средние, или нормальные, соли — это продукты полного замещения атомов водорода в
- 20. Скачать презентацию












 В. Гинуков. Условный портрет автора Слова
В. Гинуков. Условный портрет автора Слова Кафедра естественных наук
Кафедра естественных наук 249175
249175 Голосовой помощник Маруся
Голосовой помощник Маруся Девять предметов в системе счисления
Девять предметов в системе счисления Саморегулирующиеся организации «СРО Телеком» и СРО Телеком-Про»
Саморегулирующиеся организации «СРО Телеком» и СРО Телеком-Про» «Страницы семейного архива»
«Страницы семейного архива» Статистика терроризма
Статистика терроризма Социальные, этнические, конфессиональные и культурные различия личности
Социальные, этнические, конфессиональные и культурные различия личности Опиливание заготовок из сортового проката.Резание металла слесарной ножовкой.
Опиливание заготовок из сортового проката.Резание металла слесарной ножовкой. Гай Юлий Цезарь
Гай Юлий Цезарь Презентация на тему Новогодние игры со Снегурочкой и Дедом Морозом
Презентация на тему Новогодние игры со Снегурочкой и Дедом Морозом Презентация на тему Ёлочка из перьев
Презентация на тему Ёлочка из перьев Структура спонсорского пакета для чемпионата Санкт-Петербурга по водному поло.u
Структура спонсорского пакета для чемпионата Санкт-Петербурга по водному поло.u Заголовок Название раздела 1 Ленвендо Кто мы www.lenvendo.ru.
Заголовок Название раздела 1 Ленвендо Кто мы www.lenvendo.ru. ПОЛЯРИЗАЦИЯ И ДИФРАКЦИЯ СВЕТА
ПОЛЯРИЗАЦИЯ И ДИФРАКЦИЯ СВЕТА Тема урока: «Тайны поэзии Н.Гумилева»
Тема урока: «Тайны поэзии Н.Гумилева» Презентация на тему Лингвистический проект
Презентация на тему Лингвистический проект Цифровые автоматы, кодирование сигнала
Цифровые автоматы, кодирование сигнала Самодержавие Алексея Михайловича Тишайшего
Самодержавие Алексея Михайловича Тишайшего Презентация на тему Рулевое управление автомобиля
Презентация на тему Рулевое управление автомобиля Евгений Замятин. Роман-антиутопия "Мы“ как предупреждение потомкам
Евгений Замятин. Роман-антиутопия "Мы“ как предупреждение потомкам Модель управления имущественными комплексами вузов и вопросы распоряжения имуществом
Модель управления имущественными комплексами вузов и вопросы распоряжения имуществом Техника построения эллипсов во фронтальной плоскости проекций
Техника построения эллипсов во фронтальной плоскости проекций Нательные кресты XI – конца XIX вв. в экспозиции музея им. 1000-летия Брянска
Нательные кресты XI – конца XIX вв. в экспозиции музея им. 1000-летия Брянска Запатентован первый кассовый аппарат (1879)
Запатентован первый кассовый аппарат (1879) Система права
Система права Тест по рыбе
Тест по рыбе