Содержание
- 2. Используемые в работе приборы
- 3. Закон Бойля-Мариотта (изотермический процесс) T=const PV=const Устанавливаем начальный объём 152 мл Жмём на поршень и устанавливаем
- 4. Объём воздуха 152 мл, давление воздуха равно атмосферному давлению
- 5. Уменьшаем объём – увеличивается давление. Даём воздуху остыть до прежней температуры, а давлению стабилизироваться.
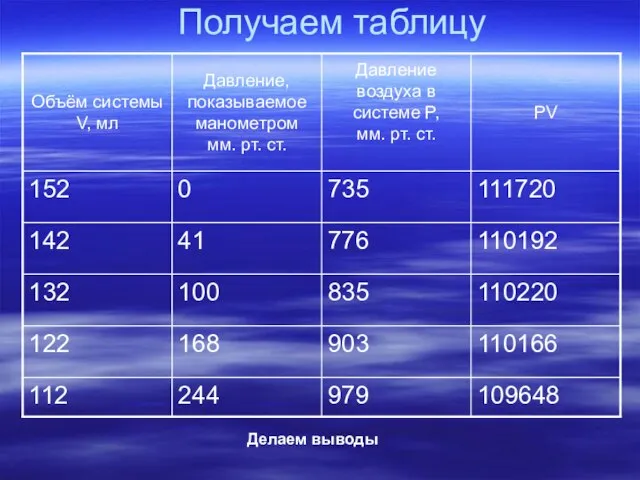
- 6. Получаем таблицу Делаем выводы
- 7. Закон Гей-Люссака(изобарный процесс) P = const V/T = const V = const * T
- 8. Увеличиваем температуру, давление тоже увеличивается
- 9. Чтобы давление сделать таким, каким оно и было надо увеличить объём с 52 до 54 мл
- 10. Продолжаем увеличивать температуру, давление от этого снова увеличивается
- 11. Чтобы вернуть прежнее давление, снова приходится увеличивать объём, теперь с 54 мл до 56 мл
- 12. Итоговая таблица измерений и вычислений
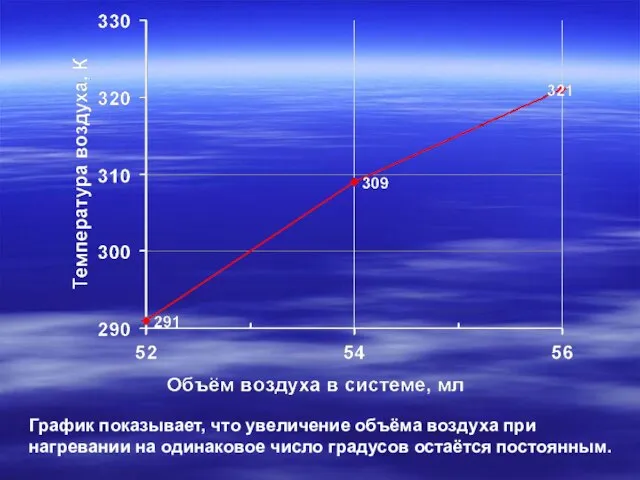
- 13. График показывает, что увеличение объёма воздуха при нагревании на одинаковое число градусов остаётся постоянным.
- 14. Вычислим коэффициент объёмного расширения воздуха при постоянном давлении Таким образом с повышением температуры на 1 градус
- 15. Закон Шарля (изохорный процесс) V = const P / T = const P = const *
- 16. Начальная температура воздуха 18 градусов. Давление воздуха в системе равно атмосферному. Манометр не показывает избыточного давления
- 17. Увеличили температуру, давление тоже увеличилось. Объём не меняется.
- 18. Продолжаем увеличивать температуру. Давление растёт.
- 20. Скачать презентацию















 Повторяем тему «Правила вычисления производной»
Повторяем тему «Правила вычисления производной» Занятие № 3 Речевые средства общения
Занятие № 3 Речевые средства общения Конституция ДНР
Конституция ДНР Основы композиции. Практическая работа
Основы композиции. Практическая работа Объявление онлайн-опрос ОМС
Объявление онлайн-опрос ОМС Презентация на тему Санкт-Петербург в романе: «Преступление и наказание». Современный Санкт-Петербург
Презентация на тему Санкт-Петербург в романе: «Преступление и наказание». Современный Санкт-Петербург  Концепция социально-экономического развития автономного округа
Концепция социально-экономического развития автономного округа Февральская лазурь
Февральская лазурь Разработка и пилотное внедрение административных регламентов исполнения государственных функций и административных регламенто
Разработка и пилотное внедрение административных регламентов исполнения государственных функций и административных регламенто Как сохранить здоровье?
Как сохранить здоровье? Обобщающее повторение фонетики, графики, орфоэпии и орфографии
Обобщающее повторение фонетики, графики, орфоэпии и орфографии Памятка студенту УниКИТа
Памятка студенту УниКИТа История отечественной художественной культуры
История отечественной художественной культуры Соловецкий монастырь- северное чудо России
Соловецкий монастырь- северное чудо России фруктовый фейерверк
фруктовый фейерверк Алгоритм ведения работы по контракту на оказание услуг по организации питания и обеспечению питьевого режима обучающихся
Алгоритм ведения работы по контракту на оказание услуг по организации питания и обеспечению питьевого режима обучающихся Презентация на тему Архимедова сила
Презентация на тему Архимедова сила  Основы уголовного права
Основы уголовного права Акцизы. Лекция 5
Акцизы. Лекция 5 Методический подход к духовно-нравственному воспитанию в работе Начертание христианского нравоучения
Методический подход к духовно-нравственному воспитанию в работе Начертание христианского нравоучения Проект Чертежник
Проект Чертежник Why I need study economics
Why I need study economics Роль и последствия экономической реформы 1965-1967 гг
Роль и последствия экономической реформы 1965-1967 гг Настольный теннис
Настольный теннис Химия элементов VIB подгруппы Cr, Mo, W
Химия элементов VIB подгруппы Cr, Mo, W Приспособленность городов России и городов Европы к велосипедам
Приспособленность городов России и городов Европы к велосипедам ФУНКЦИИ internet explorer 8
ФУНКЦИИ internet explorer 8 Привычки полезные и вредные
Привычки полезные и вредные