Содержание
- 2. Согласно общим законам термодинамического равновесия в изотермически-изобарных условиях все определяется значением энергии Гиббса: при самопроизвольном процессе
- 3. Следует отметить, что в случае химической реакции стехиометрические соображения не позволяют считать все изменения числа молей
- 4. Для всех веществ, формулы которых в уравнении химической реакции написаны слева, справедливо аналогичное условие dnk =
- 5. Таким образом, для решения проблемы химического равновесия необходимо вычислить выражение Σλiμi и приравнять эту сумму нулю.
- 6. Следовательно, Σ λiμi = Σ λiμ0i(T) + Σλi RT ln pi = 0 (9) Таким образом,
- 7. Стандартная энергия Гиббса при температуре T реакции может быть представлена выражением ΔG0T = ΔH0T - TΔ
- 8. Величина ΔС0p(T) – изменение стандартных теплоемкостей участников реакции ΔC0p = Σ λjC0p,j – Σ λi C0p,i
- 9. Для следующих химических реакций рассчитать константу равновесия Kp при различных температурах: 1. SiCl2 + H2 =
- 10. Вычисление равновесных выходов продуктов реакции Знание величины константы равновесия Kp позволяет установить не только вероятность протекания
- 11. Химическое равновесие Для гомогенной реакции в газовой фазе
- 12. Химическое равновесие Для гетерогенной химической реакции
- 13. Схема расчета равновесных выходов 1 Считая реагирующие газы идеальными и используя закон Дальтона, можно выразить равновесное
- 14. Схема расчета равновесных выходов 2 * Общее число моль в равновесии Σn = 3-2x pA =
- 15. Схема расчета равновесного выхода 3 pC =(x/(a+b-2x))Ptotal ; pA=((a-x)/(a+b-2x))Ptotal ; pB= ((b-2x)/(a+b-2x))Ptotal ; Kp= ((x(a+b-2x)2)/((a-x)(b-2x)2))Ptotal-2 3.
- 16. схема расчета равновесных выходов 4 pA= xPtotal/3 ; pB= 2xPtotal /3 ; pC= (1-x)Ptotal ; Kp=
- 17. Пример. Константа равновесия реакции диссоциации тетраоксида диазота N2O4(g) ↔ 2NO2(g) при 298 K равна Kp= 0.143.
- 18. Изучение химического равновесия: расчет стандартной константы равновесия и равновесного выхода для газофазной реакции с участием соединений
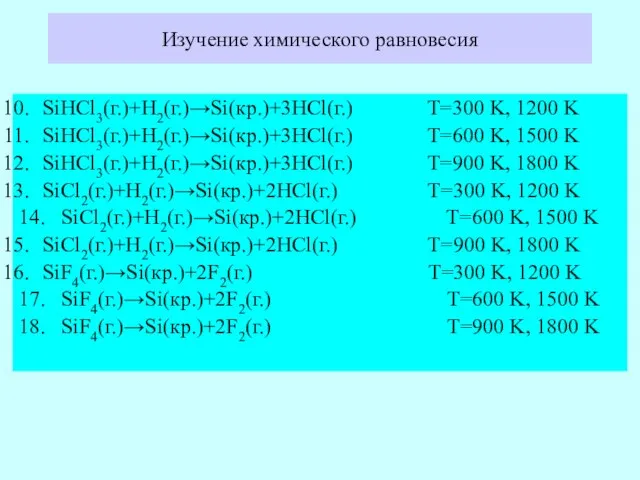
- 19. Изучение химического равновесия SiHCl3(г.)+H2(г.)→Si(кр.)+3HCl(г.) T=300 K, 1200 K SiHCl3(г.)+H2(г.)→Si(кр.)+3HCl(г.) T=600 K, 1500 K SiHCl3(г.)+H2(г.)→Si(кр.)+3HCl(г.) T=900 K,
- 20. SiCl4(г.)→Si(кр.)+2Cl2(г.) T=300 K, 1200 K 20. SiCl4(г.)→Si(кр.)+2Cl2(г.) T=600 K, 1500 K SiCl4(г.)→Si(кр.)+2Cl2(г.) T=900 K, 1800 K
- 21. Изучение химического равновесия: расчет стандартной константы равновесия и равновесного выхода для газофазной реакции с участием соединений
- 22. Изучение химического равновесия SiHCl3(г.)+H2(г.)→Si(кр.)+3HCl(г.) T=400 K, 1100 K SiHCl3(г.)+H2(г.)→Si(кр.)+3HCl(г.) T=700 K, 1400 K SiHCl3(г.)+H2(г.)→Si(кр.)+3HCl(г.) T=1000 K,
- 23. Изучение химического равновесия SiCl4(г.)→Si(кр.)+2Cl2(г.) T=400 K, 1100 K 20. SiCl4(г.)→Si(кр.)+2Cl2(г.) T=700 K, 1400 K SiCl4(г.)→Si(кр.)+2Cl2(г.) T=1000
- 28. Скачать презентацию
























 Агния Барто. Стихи
Агния Барто. Стихи Банк Вологжанин. Характеристика
Банк Вологжанин. Характеристика С Днем села
С Днем села Виды туризма. Спортивный туризм вид активного отдыха
Виды туризма. Спортивный туризм вид активного отдыха Беларускі правапіс: традыцыі, пераемнасць і перспектывы
Беларускі правапіс: традыцыі, пераемнасць і перспектывы Толерантность как ценностная основа инклюзивного образования
Толерантность как ценностная основа инклюзивного образования Электротехника. Трансформаторы
Электротехника. Трансформаторы Небесная сфера 11 класс
Небесная сфера 11 класс Волонтер: 1000 и 1 причина БЫТЬ
Волонтер: 1000 и 1 причина БЫТЬ Seoul
Seoul Оформление договора для победителей программы Старт
Оформление договора для победителей программы Старт Концепт «Алтай»
Концепт «Алтай» Сражение
Сражение Валютное регулирование и валютный контроль
Валютное регулирование и валютный контроль Participe passé
Participe passé Шелест Петро Юхимович
Шелест Петро Юхимович Колесо и Белка: как простроить взаимоотношения
Колесо и Белка: как простроить взаимоотношения "Мама, папа, я - спортивная семья!"
"Мама, папа, я - спортивная семья!" Портфолио Дидык Варвара
Портфолио Дидык Варвара 2887b54c-b32e-4e53-ba32-3085c15f9192
2887b54c-b32e-4e53-ba32-3085c15f9192 КОМПАНИЯ «ТОМЕДА»
КОМПАНИЯ «ТОМЕДА» Грамматическая семантика
Грамматическая семантика «Опыт внедрения ONIX и EDItX в России»
«Опыт внедрения ONIX и EDItX в России» Урочище Сундуки – сибирский Стоунхендж
Урочище Сундуки – сибирский Стоунхендж Портфолио учителя математики и информатики
Портфолио учителя математики и информатики Гармонизированные Технические спецификации Стандартизация на Европейском уровне
Гармонизированные Технические спецификации Стандартизация на Европейском уровне Презентация на тему Подвиги Геракла тест
Презентация на тему Подвиги Геракла тест  бизнес проект Кузина
бизнес проект Кузина