Содержание
- 2. Основные источники загрязнения атмосферы нитрозными газами: ряд производств химической промышленности; нефтеперерабатывающая промышленность; сжигание топлива.
- 3. В зависимости от степени окисления азота существуют следующие соединения азота с кислородом:
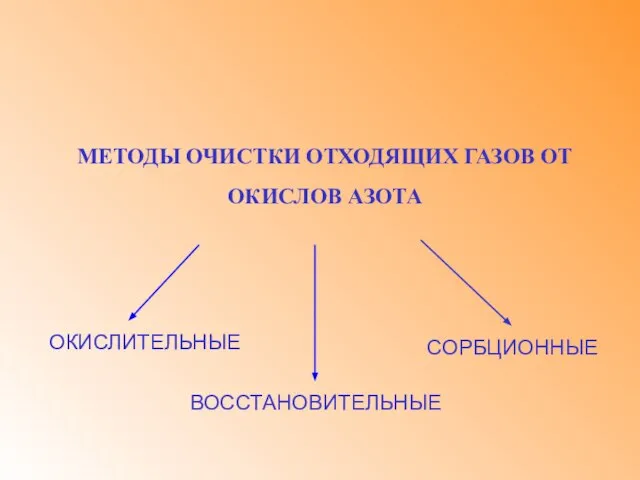
- 4. МЕТОДЫ ОЧИСТКИ ОТХОДЯЩИХ ГАЗОВ ОТ ОКИСЛОВ АЗОТА СОРБЦИОННЫЕ ОКИСЛИТЕЛЬНЫЕ ВОССТАНОВИТЕЛЬНЫЕ
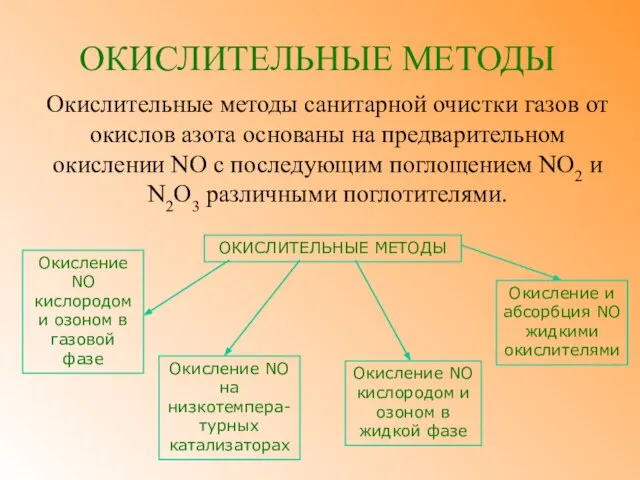
- 5. ОКИСЛИТЕЛЬНЫЕ МЕТОДЫ ОЧИСТКА ОТХОДЯЩИХ ГАЗОВ ОТ ОКИСЛОВ АЗОТА
- 6. ОКИСЛИТЕЛЬНЫЕ МЕТОДЫ Окислительные методы санитарной очистки газов от окислов азота основаны на предварительном окислении NO с
- 7. Окисление NO кислородом и озоном в газовой фазе Окислительные методы: Окисление окиси азота кислородом воздуха (8−10%
- 8. Окисление NO на низкотемпературных катализаторах Окислительные методы: В качестве катализаторов окисления окислов азота в практике санитарной
- 9. Окисление NO на низкотемпературных катализаторах Окислительные методы: Каталитическая активность перечисленных катализаторов убывает в следующей последовательности: гопкалит
- 10. Окисление NO на низкотемпературных катализаторах Окислительные методы: Наиболее активным является гопкалит, при чем его каталитическая активность
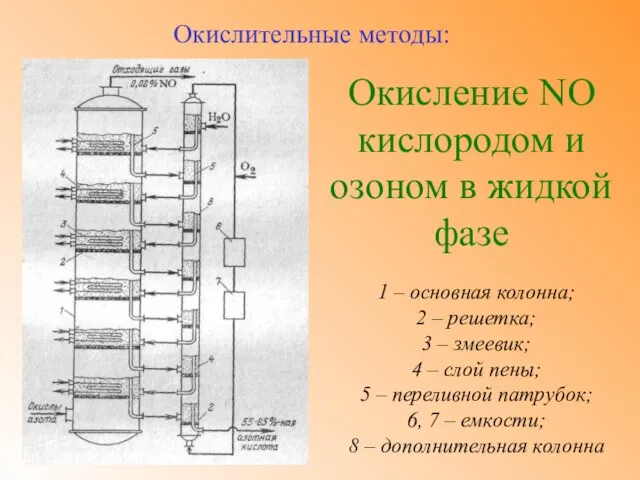
- 11. Окисление NO кислородом и озоном в жидкой фазе Окислительные методы: Окисление окиси азота в жидкой фазе
- 12. Окисление NO кислородом и озоном в жидкой фазе Окислительные методы: Процесс окисления и абсорбции окиси азота
- 13. Окисление NO кислородом и озоном в жидкой фазе Окислительные методы: Лимитирующей стадией процесса окисления NO в
- 14. Окисление NO кислородом и озоном в жидкой фазе Окислительные методы: 1 – основная колонна; 2 –
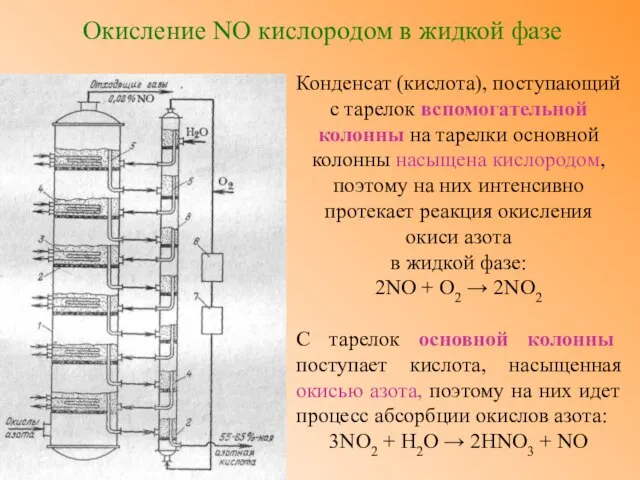
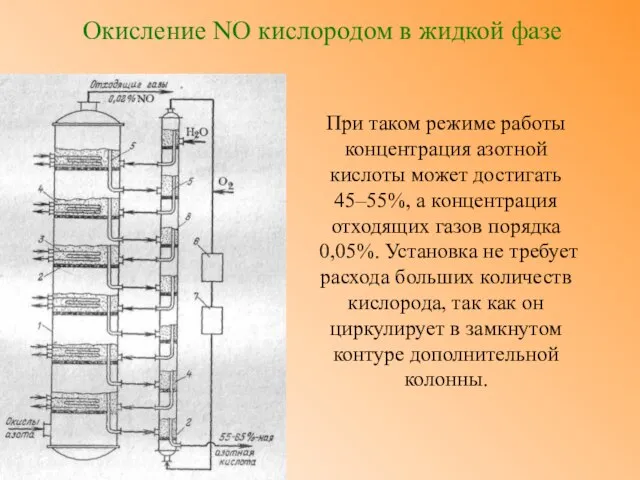
- 15. Окисление NO кислородом в жидкой фазе Конденсат (кислота), поступающий с тарелок вспомогательной колонны на тарелки основной
- 16. Окисление NO кислородом в жидкой фазе При таком режиме работы концентрация азотной кислоты может достигать 45–55%,
- 17. Окисление NO озоном в жидкой фазе Введение в жидкую фазу озона, способствует значительному увеличению скорости абсорбции
- 18. Окисление и абсорбция окислов азота жидкими окислителями Окислительные методы: К известным и наиболее используемым при санитарной
- 19. Окисление и абсорбция окислов азота жидкими окислителями Окислительные методы: Использование для окисления и абсорбции окислов азота
- 20. ВОССТАНОВИТЕЛЬНЫЕ МЕТОДЫ ОЧИСТКА ОТХОДЯЩИХ ГАЗОВ ОТ ОКИСЛОВ АЗОТА
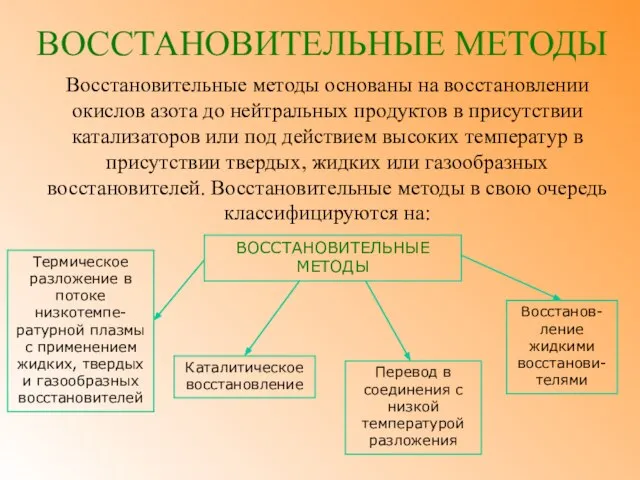
- 21. ВОССТАНОВИТЕЛЬНЫЕ МЕТОДЫ Восстановительные методы основаны на восстановлении окислов азота до нейтральных продуктов в присутствии катализаторов или
- 22. ВОССТАНОВИТЕЛЬНЫЕ МЕТОДЫ Степень окисления азота в кислородных соединениях в значительной степени определяется температурой. В присутствии кислорода
- 23. Термическое разложение NOх в потоке низкотемпературной плазмы с применением газообразных, жидких и твердых восстановителей Восстановительные методы:
- 24. Термическое разложение NOх в потоке низкотемпературной плазмы с применением газообразных, жидких и твердых восстановителей Восстановительные методы:
- 25. Термическое разложение NOх в потоке низкотемпературной плазмы с применением газообразных, жидких и твердых восстановителей Восстановительные методы:
- 26. Термическое разложение NOх в потоке низкотемпературной плазмы с применением газообразных, жидких и твердых восстановителей Восстановительные методы:
- 27. Термическое разложение NOх в потоке низкотемпературной плазмы с применением газообразных, жидких и твердых восстановителей Восстановительные методы:
- 28. Термическое разложение NOх в потоке низкотемпературной плазмы с применением газообразных, жидких и твердых восстановителей Восстановительные методы:
- 29. Термическое разложение NOх в потоке низкотемпературной плазмы с применением газообразных, жидких и твердых восстановителей Восстановительные методы:
- 30. Термическое разложение NOх в потоке низкотемпературной плазмы с применением газообразных, жидких и твердых восстановителей Восстановительные методы:
- 31. Термическое разложение NOх в потоке низкотемпературной плазмы с применением газообразных, жидких и твердых восстановителей Восстановительные методы:
- 32. Термическое разложение NOх в потоке низкотемпературной плазмы с применением газообразных, жидких и твердых восстановителей Восстановительные методы:
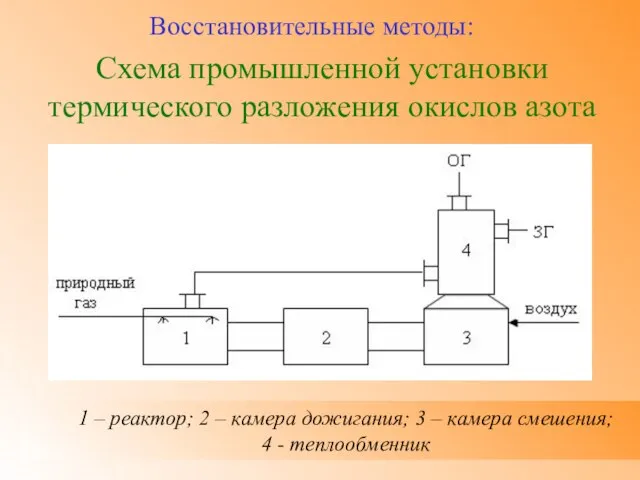
- 33. Схема промышленной установки термического разложения окислов азота Восстановительные методы: 1 – реактор; 2 – камера дожигания;
- 34. Каталитическое восстановление Восстановительные методы: Процесс каталитического восстановления происходит при контактировании нитрозных газов с газами-восстановителями на поверхности
- 35. Каталитическое восстановление Восстановительные методы: Эффективность процесса каталитического восстановления окислов азота определяется, прежде всего, активностью применяемого катализатора.
- 36. Каталитическое восстановление Восстановительные методы: Более дешевыми, но менее эффективными в эксплуатации (чувствительны к отравлениям, в частности
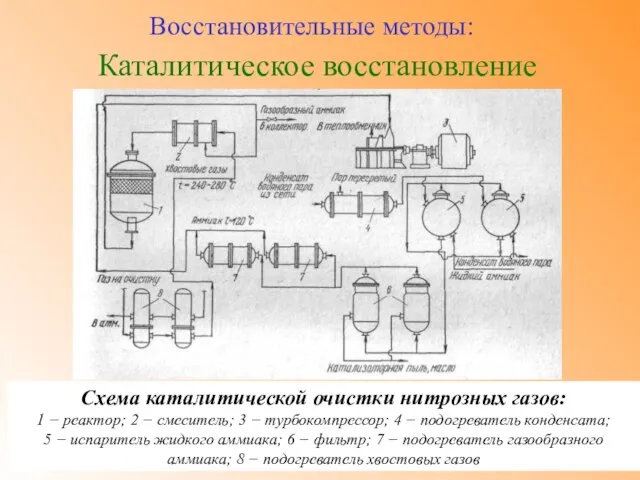
- 37. Каталитическое восстановление Восстановительные методы: Схема каталитической очистки нитрозных газов: 1 − реактор; 2 − смеситель; 3
- 38. Перевод в соединения с низкй температурой разложения Восстановительные методы: Суть этого метода заключается в том, что
- 39. Перевод в соединения с низкй температурой разложения Восстановительные методы: Образующиеся при этом аэрозоли нитрита и нитрата
- 40. Перевод в соединения с низкй температурой разложения Восстановительные методы: Преимущество данного метода состоит в том, что
- 41. Разложение окислов азота жидкими восстановителями Восстановительные методы: Для ряда производств, выбрасывающих, в атмосферу небольшие количества окислов
- 42. Разложение окислов азота жидкими восстановителями Восстановительные методы: Так, 20%-ные растворы NaHSO3 и Na2S2O3 при комнатной температуре
- 43. Разложение окислов азота жидкими восстановителями Восстановительные методы: В то время как сульфат и хлорид двухвалентного железа
- 44. Разложение окислов азота жидкими восстановителями Восстановительные методы: Поглотительная способность растворов зависит от концентрации в растворе их
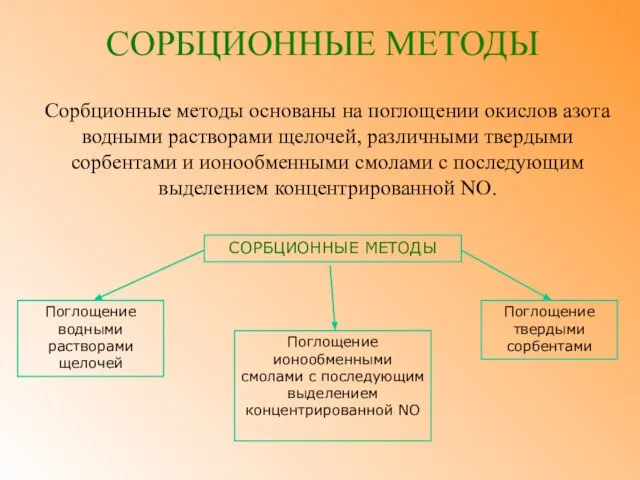
- 45. СОРБЦИОННЫЕ МЕТОДЫ Сорбционные методы основаны на поглощении окислов азота водными растворами щелочей, различными твердыми сорбентами и
- 46. Поглощение водными растворами щелочей Сорбционные методы: При санитарной очистке газов от окислов азота, характеризующихся высокой концентрацией
- 47. Поглощение водными растворами щелочей Сорбционные методы: При абсорбции окислов азота сравнительная активность щелочных растворов убывает в
- 48. Поглощение водными растворами щелочей Сорбционные методы: Процесс абсорбции окислов азота щелочами протекает в 2 стадии: 1
- 49. Адсорбция окислов азота твердыми сорбентами Сорбционные методы: Санитарная очистка газов от окислов азота с помощью таких
- 50. Адсорбция окислов азота твердыми сорбентами Сорбционные методы: В частности, при использовании активных углей при их контакте
- 51. Адсорбция окислов азота твердыми сорбентами Сорбционные методы: Адсорбционная способность силикагелей несколько ниже, чем у активных углей,
- 52. Адсорбция окислов азота твердыми сорбентами Сорбционные методы: Достаточно высокой поглотительной способностью характеризуются цеолиты (молекулярные сита). Поглотительная
- 53. Адсорбция окислов азота твердыми сорбентами Сорбционные методы: Для санитарной очистки газов от окислов азота используются такие
- 55. Скачать презентацию











































 Формирование национальной стратегии работы по обеспечению успешной социализации воспитанников интернатных учреждений в Республ
Формирование национальной стратегии работы по обеспечению успешной социализации воспитанников интернатных учреждений в Республ Парк Лефортово
Парк Лефортово ПСК. Лекция 2_Психологические основы коммуникации
ПСК. Лекция 2_Психологические основы коммуникации Конкурс молодых специалистов с инвалидностью Путь к карьере
Конкурс молодых специалистов с инвалидностью Путь к карьере Правовой фундамент государства
Правовой фундамент государства Земля Луна
Земля Луна Власть и общество в России: развитие взаимодействия и повышение эффективности гражданского участия
Власть и общество в России: развитие взаимодействия и повышение эффективности гражданского участия Ключевое преимущество программы Kempinski Discovery
Ключевое преимущество программы Kempinski Discovery Система классификации горнолыжных трасс
Система классификации горнолыжных трасс Инновационная образовательная программа московского городского психолого-педагогического университета
Инновационная образовательная программа московского городского психолого-педагогического университета Презентация на тему "Роль классного руководителя по формированию ученического коллектива в 5-м классе" - скачать презентации
Презентация на тему "Роль классного руководителя по формированию ученического коллектива в 5-м классе" - скачать презентации  Транспортный налог
Транспортный налог Проверка домашнего задания.
Проверка домашнего задания. Учебное пособие для студентов педагогических учебных заведений Педагогика как любовь
Учебное пособие для студентов педагогических учебных заведений Педагогика как любовь Презентация ОСО. Объединенный совет обучающихся ВГЛТУ
Презентация ОСО. Объединенный совет обучающихся ВГЛТУ Презентация на тему Самоиндукция
Презентация на тему Самоиндукция 2012г.
2012г. Классическая противомикробная терапия предполагает: этиотропность лечения: выбор и назначениеантибиотиков в соот
Классическая противомикробная терапия предполагает: этиотропность лечения: выбор и назначениеантибиотиков в соот Книжная печатная графика
Книжная печатная графика Рефлексия на уроках русского языка и литературы
Рефлексия на уроках русского языка и литературы Сущность биосоциальной природы психики и поведения человека
Сущность биосоциальной природы психики и поведения человека Инструменты анализа ключевых слов для западной аудитории
Инструменты анализа ключевых слов для западной аудитории Договор подряда
Договор подряда  Погода 6 класс
Погода 6 класс Секция маркетинговых исследователей Украинского Маркетинг Клуба MarketingJazzz Методы маркетинговых исследований в рознице: преимущ
Секция маркетинговых исследователей Украинского Маркетинг Клуба MarketingJazzz Методы маркетинговых исследований в рознице: преимущ Мышцы
Мышцы Организация обучения в рамках программы «Школа по уходу»
Организация обучения в рамках программы «Школа по уходу» Презентация на тему 26 ноября – Всемирный день информации
Презентация на тему 26 ноября – Всемирный день информации