Содержание
- 2. Тест – экспресс 1) Электронная конфигурация атома углерода? 2) Разновидности простого вещества, образованные одним и тем
- 3. ОТВЕТЫ 1) Аллотропные видоизменения 2) 1s22s22p 3) Четыре 4) Метан СН4, силан SiH4 5) ЭО2 6)
- 4. Фокус-покус для народа: Стоит лишь подуть сквозь воду, Как она легко-легко Превратиться в молоко! СО2 +
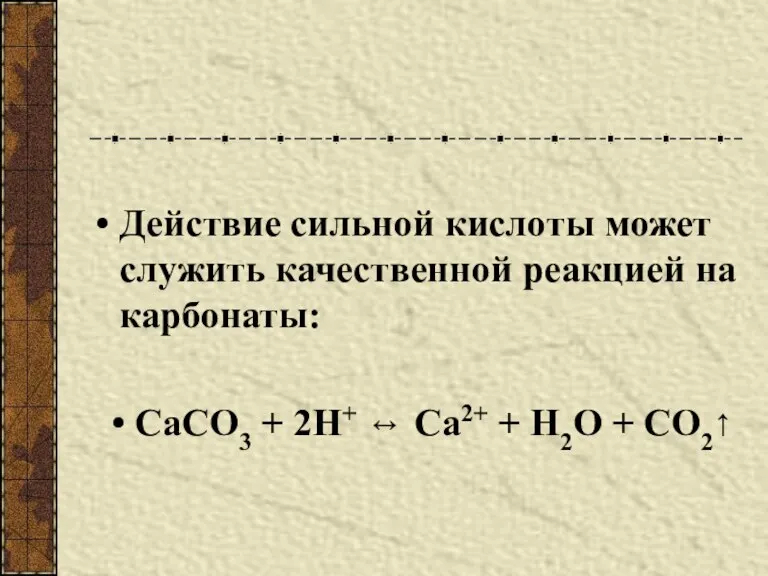
- 5. Действие сильной кислоты может служить качественной реакцией на карбонаты: СаСО3 + 2Н+ ↔ Са2+ + Н2О
- 6. Как можно собрать СО2 М(воздуха)=29, т.е. СО2 тяжелее воздуха Метод вытеснения воды невозможен из-за протекания реакции:
- 7. Угольная кислота диссоциирует ступенчато: 1.H2CO3 ↔ Н+ + HCO3- 2. HCO3- ↔ Н+ + CO32-
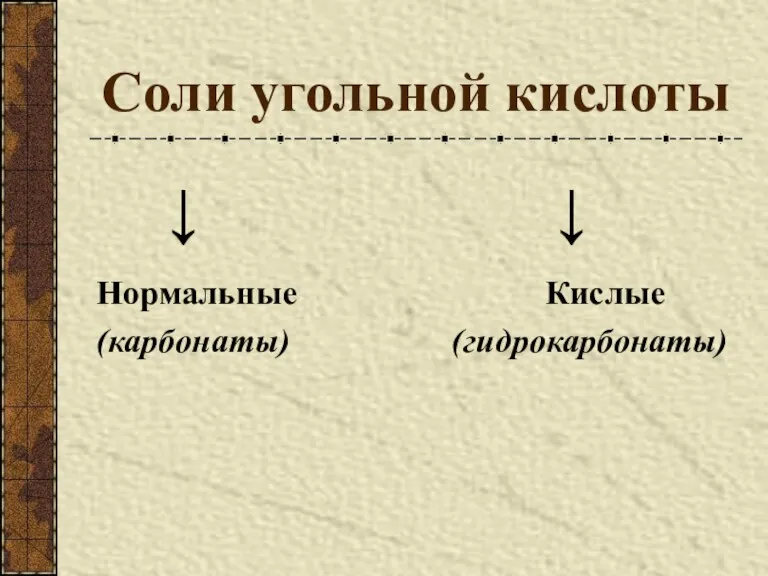
- 8. Соли угольной кислоты ↓ ↓ Нормальные Кислые (карбонаты) (гидрокарбонаты)
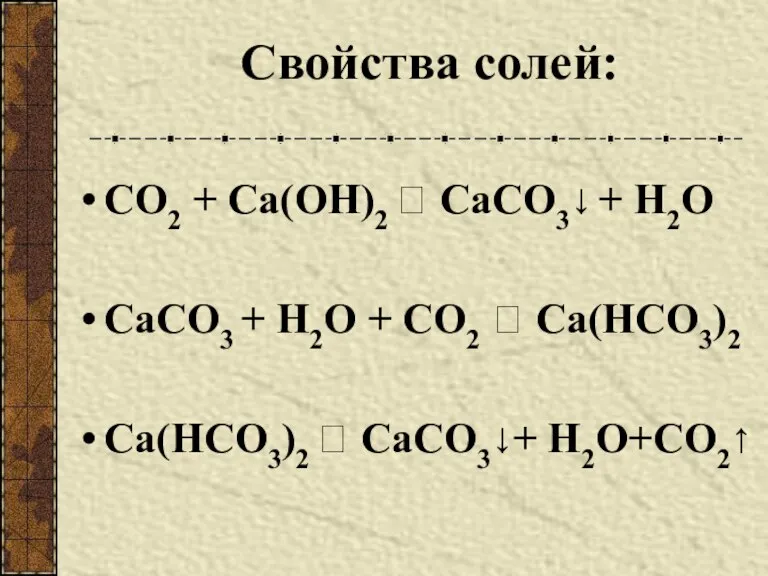
- 9. Свойства солей: СО2 + Са(ОН)2 ? СаСО3↓ + Н2О СаСО3 + Н2О + СО2 ? Са(НСО3)2
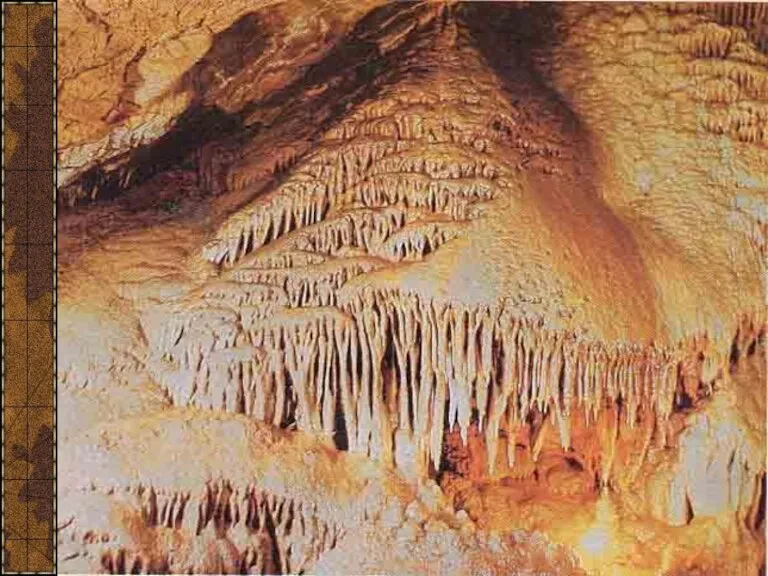
- 10. Красная пещера, или Кизил-Коба, самая крупная из 800 пещер Крыма. Она расположена в 3,5 км от
- 11. Сталагмиты
- 12. Сталактит «Пузатый»
- 13. Сталактит «Огненный»
- 17. Изучением карстовых пещер занимается наука – спелеология
- 18. Соли угольной кислоты: Мрамор, известняк, мел – СаСО3 На земле живут три брата Из семейства Карбонатов.
- 19. Доломит CaCO3. MgCO3 – обычно содержит глины и известняки, применяется для получения извести, солей магния, как
- 20. Сидерит FeCO3 – минерал бурого цвета, служит рудой для получения железа. Кальцинированная сода Na2CO3 – белый
- 21. Презентация разработки темы в курсе 9 класса. Подготовила учитель химии ОГРИНА СВЕТЛАНА ЮРЬЕВНА
- 23. Скачать презентацию




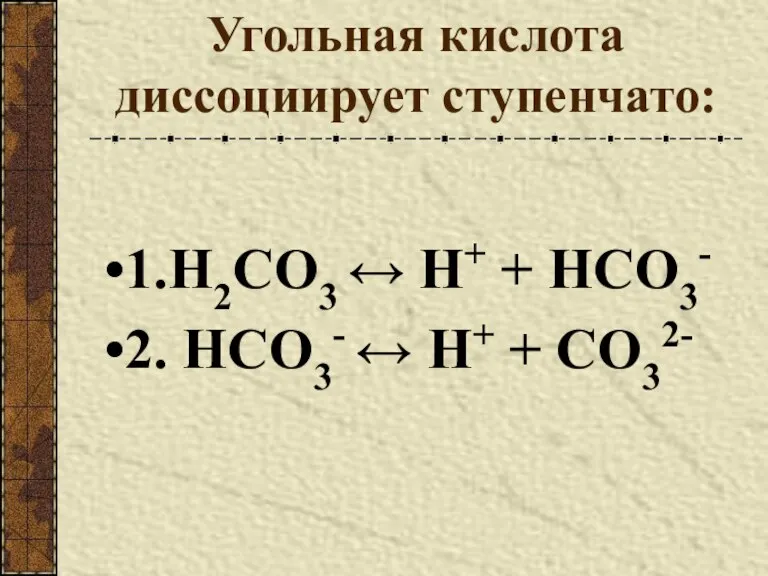











 Сохранение психологического здоровья учащихся и учителей
Сохранение психологического здоровья учащихся и учителей Земля Earth
Земля Earth Поэма Лермонтова Демон в картинах Михаила Врубеля
Поэма Лермонтова Демон в картинах Михаила Врубеля Капсула культуры
Капсула культуры VI школьная конференция исследовательских и проектных работ учащихся
VI школьная конференция исследовательских и проектных работ учащихся Козьма Прутков
Козьма Прутков Обобщение знаний по теме Зарубежная Европа
Обобщение знаний по теме Зарубежная Европа Металлы в строительстве
Металлы в строительстве Правонарушение и юридическая ответственность
Правонарушение и юридическая ответственность Виды структур управления
Виды структур управления Презентация на тему Дикие животные. Детская энциклопедия
Презентация на тему Дикие животные. Детская энциклопедия 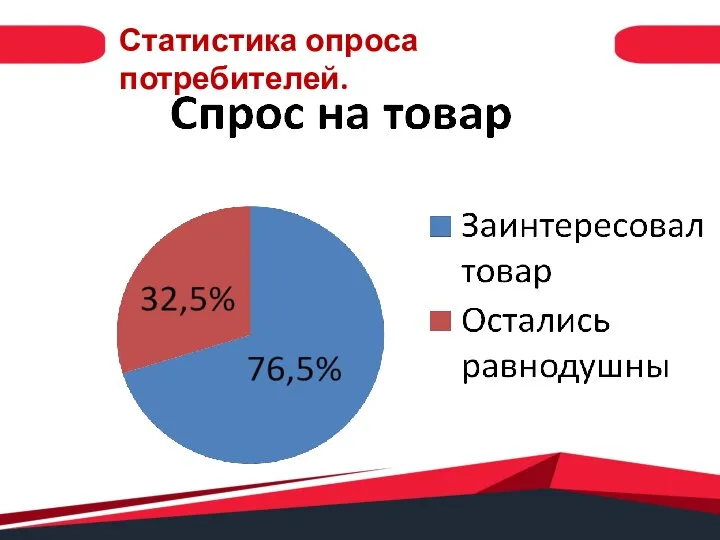 Спрос на товар. Статистика опроса потребителей
Спрос на товар. Статистика опроса потребителей Страны Восточной Европы
Страны Восточной Европы Современная модель музыкального воспитания детей
Современная модель музыкального воспитания детей Funny pancake day quiz
Funny pancake day quiz Рабочая документация классного руководителя
Рабочая документация классного руководителя Классицизм Живопись
Классицизм Живопись Рекомендации по написанию основной общеобразовательной программы дошкольного образовательного учреждения
Рекомендации по написанию основной общеобразовательной программы дошкольного образовательного учреждения Урок № 3. Линейная функция и ее график
Урок № 3. Линейная функция и ее график Художественный ансамбль собора Святого Петра в Риме
Художественный ансамбль собора Святого Петра в Риме WhirlpoolКондиционеры 2011
WhirlpoolКондиционеры 2011 Модель гражданско-патриотического воспитания школьников в условиях сельской малокомплектной школы
Модель гражданско-патриотического воспитания школьников в условиях сельской малокомплектной школы Свойства прямоугольного параллелепипеда
Свойства прямоугольного параллелепипеда Baby O детское очищающее молочко
Baby O детское очищающее молочко Опыт Австралии по освоению месторождений полезных ископаемых на территориях с трудными природными условиями
Опыт Австралии по освоению месторождений полезных ископаемых на территориях с трудными природными условиями Как написать эссе на немецком языке?
Как написать эссе на немецком языке? Виды энергий
Виды энергий 1C:ПРЕДПРИЯТИЕ 8.0
1C:ПРЕДПРИЯТИЕ 8.0