Слайд 2Выделяют следующие особенности комплексов переходных металлов, определяющих их каталитическую активность:
способность образовывать комплексы

с молекулами различных типов, которые, входя в координационную сферу металла – комплексообразователя, активируются, что обеспечивает легкость их дальнейшего взаимодействия.
Слайд 4Выделяют следующие особенности комплексов переходных металлов, определяющих их каталитическую активность:
образование комплексов с

координирующим ионом или атомом металла понижает энергию связи реагирующих молекул субстратов, что уменьшает энергии активации их последующих реакций по сравнению с некоординированными молекулами.
Слайд 5Выделяют следующие особенности комплексов переходных металлов, определяющих их каталитическую активность:
в координационной сфере

металла молекулы изменяют свои кислотные или основные свойства, и возникает возможность кислотно-основного взаимодействия при тех значениях рН, при которых свободная молекула не реагирует.
если имеется запрет по симметрии молекулярных орбиталей, препятствующий взаимодействию молекул, то при реакции в координационной сфере металла он может сниматься или значительно ослабляться.
металлокомплексный катализ позволяет осуществить реакции многоэлектронного окисления и восстановления, в которых молекула субстрата в координационной сфере сразу принимает или отдает несколько электронов.
Слайд 6Основные типы реакций, катализируемых комплексами металлов
Гидрирование:металлокомплексы на основе платиновых металлов, иридиевые и

комплексы, Al(C2H5)3 , катализаторы Циглера – Натты, также гидриды металлоценов
Синтезы с участием оксида углерода: октакарбонил Со, фосфиновые и фосфитные комплексы Rh, Ni(СО)4
Полимеризация, димеризация, олигомеризация олефинов и ацетиленов:катализаторы Циглера – Натты и др.
Окисление углеводородов в карбонильные соединения и эпоксиды:комплексы Pd, гексакарбонил молибдена Мо(СО)6 или ацетилацетонат ванадила VO(C3H7O2)2.
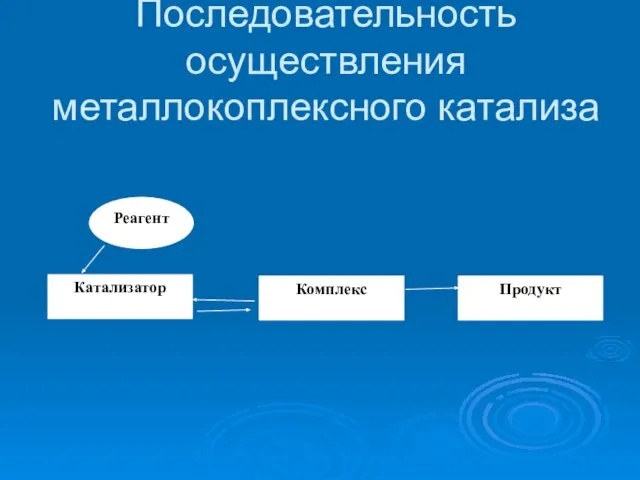
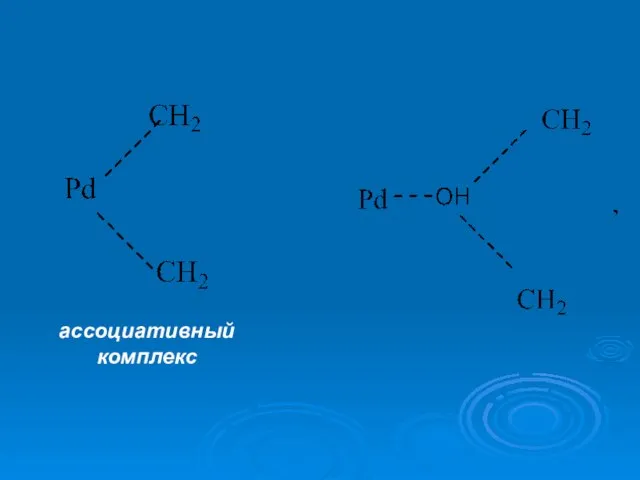
Слайд 7Последовательность осуществления металлокоплексного катализа
Слайд 8С2Н4+ O2=СН3СНО (уксусный ангидрид–ацетальдегид)
катализатором является комплексное соединение PdCl2. При этом протекают следующие

стадии:
1) PdCl2(С2Н4)(ОН-) PdCl2(С2Н4ОН) (Б1)
2) PdCl2(С2Н4ОН)- PdCl2+ СН3СНО+Н+ (Б2)
Б1, Б2 – окисленная и восстановленная форма палладия соответственно.
Слайд 10Каталитическая активность
где а – каталитическая активность; Ф – отражает величину свободной

энергии металл-лигандного комплекса – снижение закомплексованности (например для PdХ2-4, в ряду Х-=Br‑, Cl‑, F- повышается активность с понижением закомплексованности атомов палладия).
Слайд 12Ферменты
Ферменты (или энзимы) представляют собой высокоспециализированный класс белков, обеспечивающих высокие скорости химических

реакций, протекающих в клетках живых организмов.
Слово «фермент» происходит от латинского fermentum – закваска; другое установившееся название ферментов – энзимы – происходит от греческого en zyme – в дрожжах (термин предложил Ф. В. Кюне в 1878 г.)
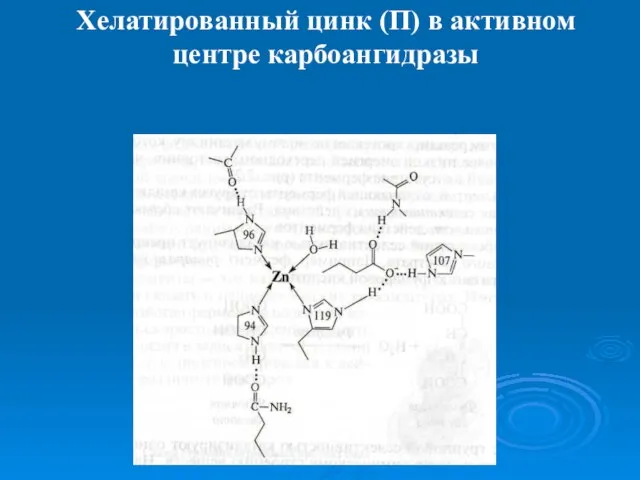
Слайд 14Хелатированный цинк (П) в активном
центре карбоангидразы
Слайд 15Схема, поясняющая механизм снижения энергии активации реакции за счет ферментативного катализа (индекс
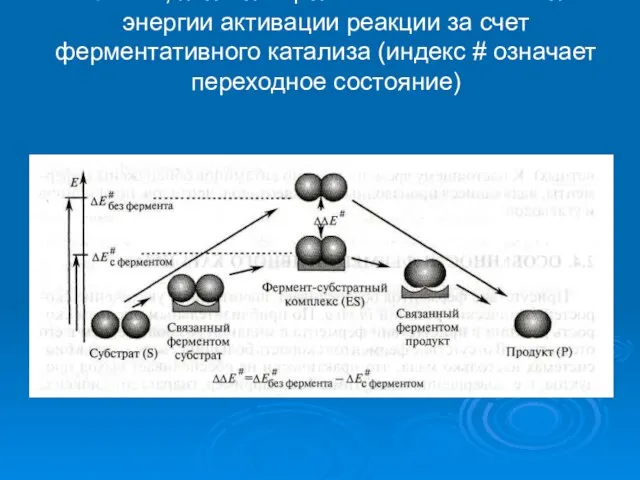
# означает переходное состояние)












 Проектирование полуботинок с настрочными берцами
Проектирование полуботинок с настрочными берцами Бюджет для граждан на 2022 год
Бюджет для граждан на 2022 год Ластоногие и Китообразные, Парнокопытные и Непарнокопытные, Хоботные
Ластоногие и Китообразные, Парнокопытные и Непарнокопытные, Хоботные РЕЗУЛЬТАТЫ РАБОТЫПОДСИСТЕМЫ «ВЕДЕНИЯ»
РЕЗУЛЬТАТЫ РАБОТЫПОДСИСТЕМЫ «ВЕДЕНИЯ» Переход к предоставлению услуги «Социальная поддержка ветеранов труда, лиц, проработавших в тылу в период Великой Отечественной в
Переход к предоставлению услуги «Социальная поддержка ветеранов труда, лиц, проработавших в тылу в период Великой Отечественной в Ивановское сельское поселение. Исполнение бюджета
Ивановское сельское поселение. Исполнение бюджета О компании Jura Elektroapparate AG
О компании Jura Elektroapparate AG The flag of the uk
The flag of the uk Желаем Вам приятного просмотра! Для смены слайдов нажимайте клавишу ПРОБЕЛ.
Желаем Вам приятного просмотра! Для смены слайдов нажимайте клавишу ПРОБЕЛ. На пути к Библиотеке 2.0: освоение перспективных интернет-технологий
На пути к Библиотеке 2.0: освоение перспективных интернет-технологий Расчёт на прочность при изгибе
Расчёт на прочность при изгибе Видеонаблюдение при проведении выборов депутатов Государственной Думы
Видеонаблюдение при проведении выборов депутатов Государственной Думы В царстве грибов
В царстве грибов Бизнес планирование предприятий
Бизнес планирование предприятий План мероприятий на каникулы
План мероприятий на каникулы Н. В. Гоголь в разделе «Что такое слово и словесность» пишет: "Говорится все, записывается немногое, и только то, что нужно. Отсюда зн
Н. В. Гоголь в разделе «Что такое слово и словесность» пишет: "Говорится все, записывается немногое, и только то, что нужно. Отсюда зн Значение природных ресурсов
Значение природных ресурсов Презентация 6-7 СРО Шевченко Д.В
Презентация 6-7 СРО Шевченко Д.В Как выполняли арифметические действия в Древнем Риме?
Как выполняли арифметические действия в Древнем Риме? Мастер-класс
Мастер-класс Презентация на тему: Проблемы подросткового возраста и его особенности
Презентация на тему: Проблемы подросткового возраста и его особенности Телекоммуникации
Телекоммуникации Сварные соединения и швы
Сварные соединения и швы Цапина Елена Михайловна Классный руководитель6 «а» класса Школа №9 г.Можга
Цапина Елена Михайловна Классный руководитель6 «а» класса Школа №9 г.Можга Презентация на тему Обучение грамоте и развитие речи
Презентация на тему Обучение грамоте и развитие речи Les meilleures montres dans le monde
Les meilleures montres dans le monde Презентация на тему Открытия Ломоносова в области физики
Презентация на тему Открытия Ломоносова в области физики  Маньяки… кто есть кто
Маньяки… кто есть кто