Слайд 2 Чистые индивидуальные химические вещества принято делить на две группы:
немногочисленную группу

простых веществ (их, с учётом аллотропных модификаций, насчитывается около 400 )
и очень многочисленную группу сложных веществ.
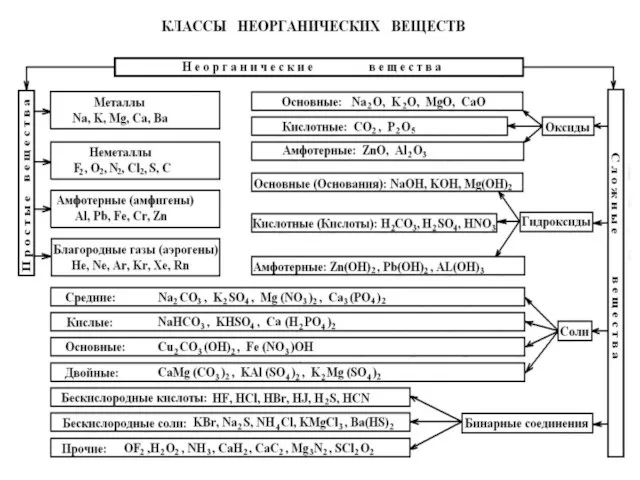
Приведём сводную таблицу классов неорганических веществ:
Слайд 4 Простые вещества образованы из атомов одного единственного элемента.
Как и элементы

имеются простые вещества:
МЕТАЛЛЫ,
НЕМЕТАЛЛЫ,
АМФОТЕРНЫЕ (АМФИГЕНЫ),
БЛАГОРОДНЫЕ ГАЗЫ.
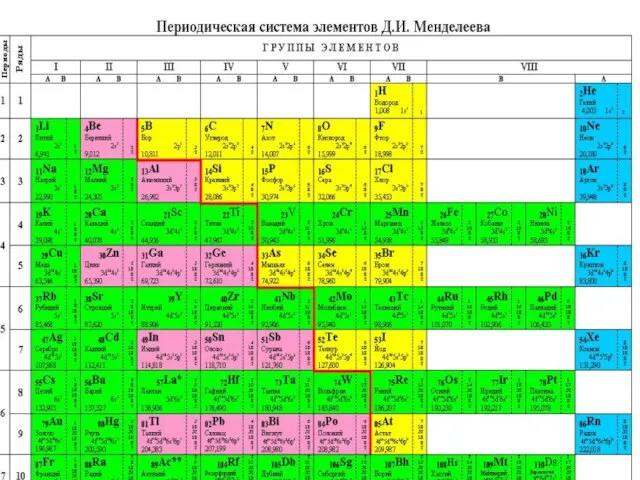
Все они определённым образом располагаются в периодической системе и обладают общими для каждого класса физическими и химическими свойствами.
Слайд 6 МЕТАЛЛЫ И НЕМЕТАЛЛЫ – два противоположных по своим свойствам класса неорганических

веществ.
АМФОТЕРНЫЕ ПРОСТЫЕ ВЕЩЕСТВА имеют двойственные свойства, присущие как металлам, так и неметаллам. Обладают более низкой восстановительной способностью по сравнению с типичными металлами. В ряду напряжений металлов примыкают к водороду.
Слайд 7 Среди сложных веществ особое место занимают:
ОКСИДЫ,
ГИДРОКСИДЫ,
СОЛИ.

Слайд 8Гидроксиды принято делить на три группы:
ОСНО́ВНЫЕ ГИДРОКСИДЫ (ОСНОВАНИЯ),
КИСЛОТНЫЕ ГИДРОКСИДЫ (КИСЛОТЫ),
АМФОТЕРНЫЕ ГИДРОКСИДЫ.

Слайд 9НАСЛЕДОВАНИЕ ХИМИЧЕСКИХ СВОЙСТВ В РЯДАХ ХАРАКТЕРИСТИЧЕСКИХ СОЕДИНЕНИЙ МЕТАЛЛОВ И НЕМЕТАЛЛОВ
С двумя классами

простых веществ МЕТАЛЛАМИ и НЕМЕТАЛЛАМИ генетически связаны соответствующие ряды характеристических соединений: оксидов и гидроксидов.
(ГЕНЕТИКА – наука о наследовании свойств).
Рассмотрим эти ряды.
Слайд 10ГЕНЕТИЧЕСКИЙ РЯД ТИПИЧНЫХ МЕТАЛЛОВ
Химическая связь в оксидах наиболее активных металлов носит
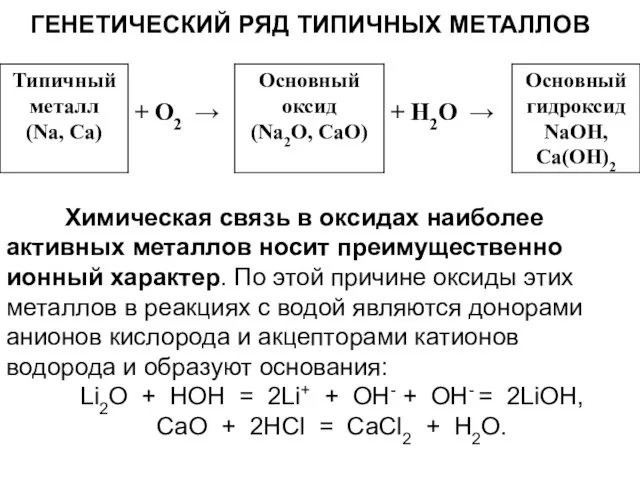
преимущественно ионный характер. По этой причине оксиды этих металлов в реакциях с водой являются донорами анионов кислорода и акцепторами катионов водорода и образуют основания:
Li2O + HOH = 2Li+ + OH- + OH- = 2LiOH,
CaO + 2HCl = CaCl2 + H2O.
Слайд 11ГЕНЕТИЧЕСКИЙ РЯД НЕМЕТАЛЛОВ
Химическая связь в оксидах неметаллов носит преимущественно ковалентный характер.

По этой причине оксиды неметаллов являются акцепторами гидроксид-ионов, и в реакции с водой отщепляют катионы водорода. При этом образуются кислоты. Отсюда название – кислотные оксиды.
SO3 + HOH = HSO4- + H+ = H2SO4,
SO3 + NaOH = HSO4- + Na+ = NaHSO4.
Слайд 12ГЕНЕТИЧЕСКИЙ РЯД АМФОТЕРНЫХ МЕТАЛЛОВ
Оксиды металлов, которым соответствуют элементы, расположенные вблизи линии

бор – астат (Al, Zn, Be и др.) проявляют амфотерные свойства, которые выражаются в их способности взаимодействовать как с кислотами, так и со щелочами:
Al2O3 + 6HCl = 2AlCl3 + 3H2O,
Al2O3 + 2KOH + 3H2O = 2K[Al(OH)4],
И кислотные и основные свойства таких оксидов выражены слабо, поэтому с водой амфотерные оксиды не реагируют.
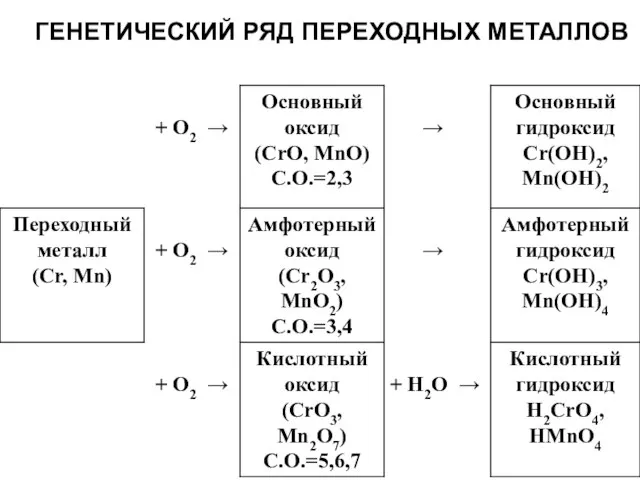
Слайд 13ГЕНЕТИЧЕСКИЙ РЯД ПЕРЕХОДНЫХ МЕТАЛЛОВ










 Цель и задачи
Цель и задачи Источники права в Японии
Источники права в Японии Храм Рождества Христова и преподобного Сергея Радонежского
Храм Рождества Христова и преподобного Сергея Радонежского Динамика участия учителей округа в первом туре конкурса «Педагогический дебют» Учебный год2007/082008/09 количество учителей-участнико
Динамика участия учителей округа в первом туре конкурса «Педагогический дебют» Учебный год2007/082008/09 количество учителей-участнико Волей
Волей Я шагаю по Москве
Я шагаю по Москве «Образ Воронежа в стихотворениях О.Э.Мандельштама и А.А.Ахматовой»
«Образ Воронежа в стихотворениях О.Э.Мандельштама и А.А.Ахматовой» Work and Travel USA
Work and Travel USA Перекупка товаров
Перекупка товаров Моя малая Родина
Моя малая Родина День открытых дверей Банка России
День открытых дверей Банка России Сочинение о роли абзаца
Сочинение о роли абзаца ДОМОХОЗЯЙСТВА
ДОМОХОЗЯЙСТВА Белгородский государственный технологический университет им. В.Г. Шухова
Белгородский государственный технологический университет им. В.Г. Шухова Прощай,АЗБУКА!
Прощай,АЗБУКА! Сонячний дух Коляда
Сонячний дух Коляда Спряжение глаголов
Спряжение глаголов Золотое Кольцо России
Золотое Кольцо России В бескрайнем море книг и журналов
В бескрайнем море книг и журналов Отделение ПОЧВОВЕДЕНИЯ приветствует вас – наших абитуриентов
Отделение ПОЧВОВЕДЕНИЯ приветствует вас – наших абитуриентов Називні речення
Називні речення Моё здоровье - в моих руках
Моё здоровье - в моих руках Презентация на тему Disney Princesses Strategic marketing
Презентация на тему Disney Princesses Strategic marketing  Развитие творческих способностей как средство самореализации личности
Развитие творческих способностей как средство самореализации личности STARS Среди своих 5770/2009
STARS Среди своих 5770/2009 Проблема бездуховности в повести М. А. Булгакова «Собачье сердце»
Проблема бездуховности в повести М. А. Булгакова «Собачье сердце» Латвия
Латвия Упорядковуємо та фільтруємо дані в таблицях
Упорядковуємо та фільтруємо дані в таблицях