Содержание
- 2. Коллоидная химия Дисперсная система Дисперсная фаза (раздробленная часть дисперсной системы) Дисперсионная среда (непрерывная часть дисперсной системы)
- 3. Признаки объектов коллоидной химии
- 4. Поперечный размер частицы (а) – диаметр для сферических частиц (d) и длина ребра для кубических частиц
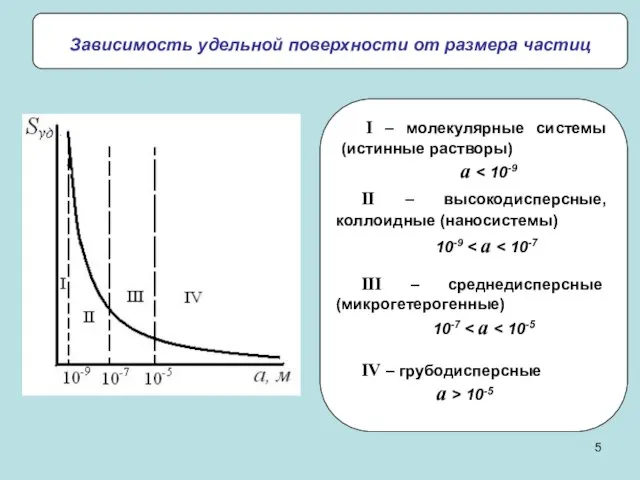
- 5. Зависимость удельной поверхности от размера частиц II – высокодисперсные, коллоидные (наносистемы) 10-9 III – среднедисперсные (микрогетерогенные)
- 6. Пример: Дисперсность частиц коллоидного золота 108 м-1. Принимая частицы золота в виде кубиков определить, какую поверхность
- 7. Особенности коллоидных систем 2. Термодинамическая неустойчивость 3. Невоспроизводимость (индивидуальность) 4. Способность к структурообразованию
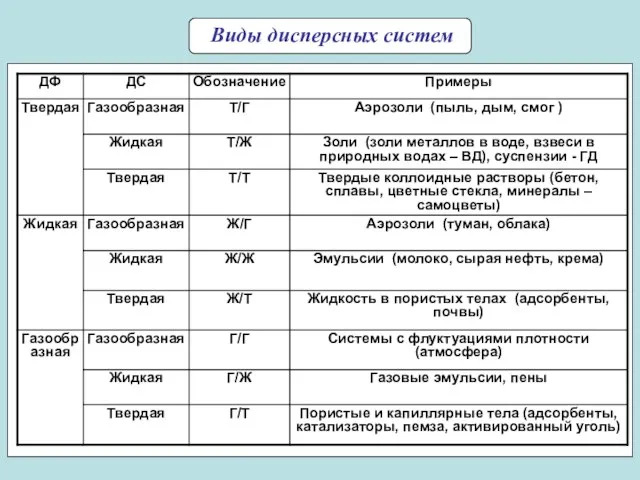
- 8. Виды дисперсных систем
- 9. Получение дисперсных систем измельчение крупных образцов вещества до частиц дисперсных размеров; химический состав и агрегатное состояние
- 10. Для облегчения диспергирования используют понизители твердости (электролиты, эмульсии, ПАВ и др.) Понизители твердости составляют 0,1 %
- 11. основаны на ассоциации молекул в агрегаты из истинных растворов; используют для получения высокодисперсных систем; не требуют
- 12. Стадии конденсации 2. Рост зародышей. 3. Формирование слоя стабилизатора (ДЭС).
- 13. Физические конденсационные методы
- 14. Химические конденсационные методы
- 16. 3. Реакции окисления Образование золя серы. 2H2Sр-р + O2 = 2S ↓+ 2H2O Строение мицеллы:
- 17. 4. Реакции гидролиза Получение золя гидроксида железа. FeCl3 + 3H2O = Fe(OH)3 ↓ + 3HCl Cтроение
- 18. Метод пептизации
- 19. Низкомолекулярные примеси (чужеродные электролиты) разрушают коллоидные системы. Диализ – отделение золей от низкомолекулярных примесей с помощью
- 20. Особенности коллоидных растворов Опалесценция (светорассеяние) наблюдается когда λ > d. Чем короче длина волны падающего света,
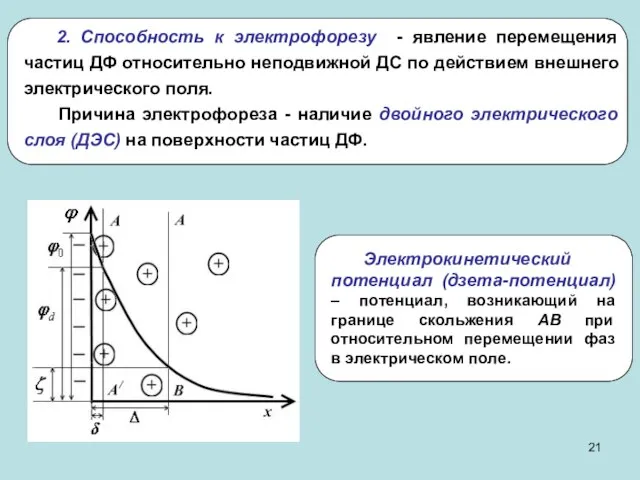
- 21. 2. Способность к электрофорезу - явление перемещения частиц ДФ относительно неподвижной ДС по действием внешнего электрического
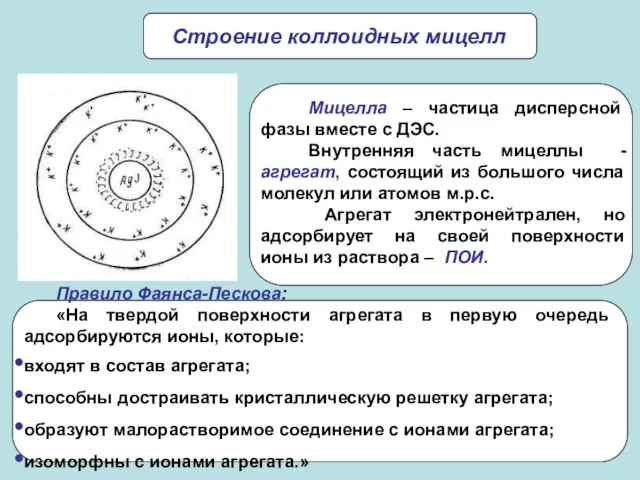
- 22. Строение коллоидных мицелл
- 24. Пример 1:
- 25. Устойчивость и коагуляция дисперсных систем
- 26. Коагуляция золей электролитами Все электролиты при определенной концентрации могут вызвать коагуляцию золя. Правило знака заряда: коагуляцию
- 27. Порог коагуляции (γ, Скр) – наименьшая концентрация электролита, достаточная для того, чтобы вызвать коагуляцию золя Коагулирующая
- 29. Скачать презентацию






















 Путешествие Алисы в страну Математики
Путешествие Алисы в страну Математики Отчет об исполнении бюджета за 2018 год
Отчет об исполнении бюджета за 2018 год Городское родительское собрание «За здоровье и безопасность наших детей»
Городское родительское собрание «За здоровье и безопасность наших детей» Презентация на тему Буква Х - презентация (1 класс)
Презентация на тему Буква Х - презентация (1 класс) основні орфограми
основні орфограми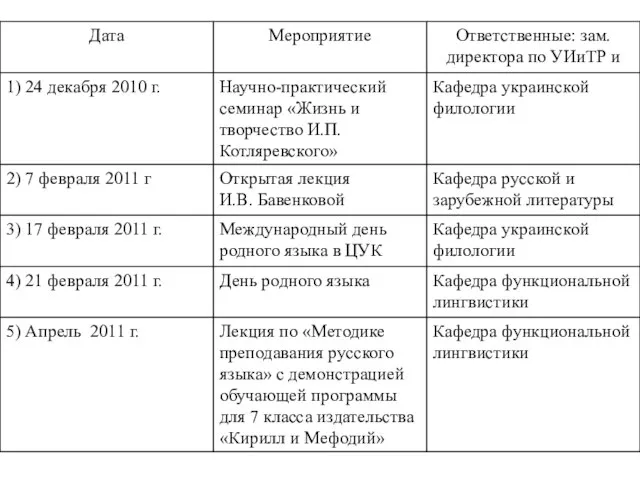 ДатаМероприятиеОтветственные: зам. директора по УИиТР и 1) 24 декабря 2010 г.Научно-практический семинар «Жизнь и творчество И.П. Котля
ДатаМероприятиеОтветственные: зам. директора по УИиТР и 1) 24 декабря 2010 г.Научно-практический семинар «Жизнь и творчество И.П. Котля общество как форма жизнедеятельности людей
общество как форма жизнедеятельности людей Шестидесятипятилетию победы СССР в Великой Отечественной войне посвящается
Шестидесятипятилетию победы СССР в Великой Отечественной войне посвящается Русский народный костюм
Русский народный костюм Лаппеенранта – не так далеко! Из Москвы и из Санкт-Петербурга легко добраться на автомобиле, на автобусе или поезде Из Лаппеенрант
Лаппеенранта – не так далеко! Из Москвы и из Санкт-Петербурга легко добраться на автомобиле, на автобусе или поезде Из Лаппеенрант Государственная программа Республики Коми «Развитие системы государственного и муниципального управления» на 2013-2020 годы (осно
Государственная программа Республики Коми «Развитие системы государственного и муниципального управления» на 2013-2020 годы (осно Презентация на тему Комарова "Наводнение"
Презентация на тему Комарова "Наводнение"  Назначение менеджера Практический кейс
Назначение менеджера Практический кейс Жизнь в первобытном обществе
Жизнь в первобытном обществе Аналитика рынка шинопроводов
Аналитика рынка шинопроводов Избирательное право и избирательные системы Республики Казахстан
Избирательное право и избирательные системы Республики Казахстан Значение и охрана птиц
Значение и охрана птиц Оперативная память
Оперативная память Презентация на тему Проблема общественного прогресса
Презентация на тему Проблема общественного прогресса  IT – Скорая. Организация по ремонту компьютеров
IT – Скорая. Организация по ремонту компьютеров Презентация на тему Луг
Презентация на тему Луг  Факторы, влияющие на здоровье человека Анализ фактора «питание» в Новосибирской области
Факторы, влияющие на здоровье человека Анализ фактора «питание» в Новосибирской области Тема. Статистика занятости и безработицы Определение численности и состава экономически активного и неактивного населения, зан
Тема. Статистика занятости и безработицы Определение численности и состава экономически активного и неактивного населения, зан Климат
Климат МОСКВА 2012
МОСКВА 2012 Презентация на тему Процесс стратегического планирования и его основные элементы
Презентация на тему Процесс стратегического планирования и его основные элементы  Презентация тв и мс мфпа
Презентация тв и мс мфпа Здание как сочетание различных объемов. Понятие модуля
Здание как сочетание различных объемов. Понятие модуля