Содержание
- 2. Проблема «дополнительных валентностей» CuSO4.4NH3 – Андрей Либавий, 1597 г. AgCl.2NH3 – И. Глаубер, 1648 г. CoCl3.6NH3
- 3. Двойная соль или комплексное соединение? KCr(SO4)2∙ 12H2O – хромокалиевые квасцы KCr(SO4)2∙ 12H2O = = K+ +
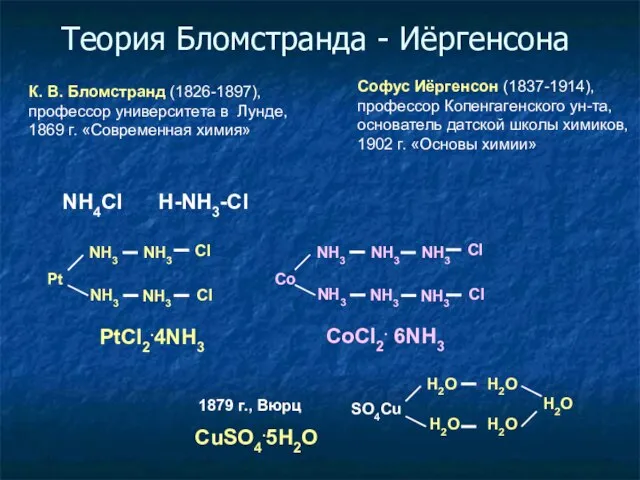
- 4. Теория Бломстранда - Иёргенсона К. В. Бломстранд (1826-1897), профессор университета в Лунде, 1869 г. «Современная химия»
- 5. Валентность постоянная или переменная? «Соединительная сила» Эдуард Франкланд, 1852 г. «Атомность» «Валентность» Г. Вихельгауз, 1868 г.
- 6. Рождение координационной теории Альфред Вернер «К вопросу о строении неорганических соединений». 1893 г. Главная и побочная
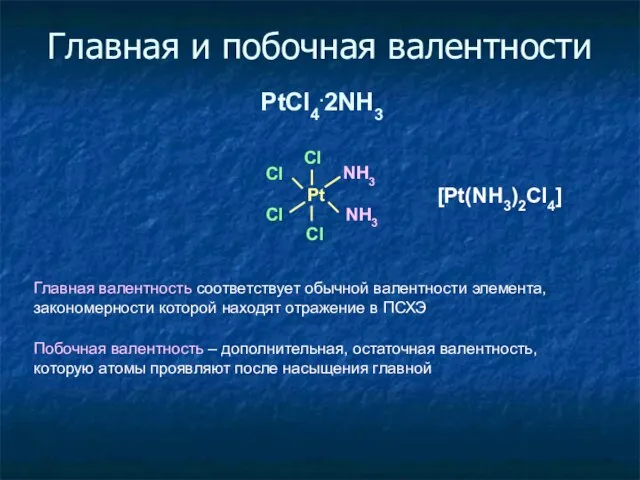
- 7. Главная и побочная валентности PtCl4.2NH3 Pt Cl Cl Cl Cl NH3 NH3 Главная валентность соответствует обычной
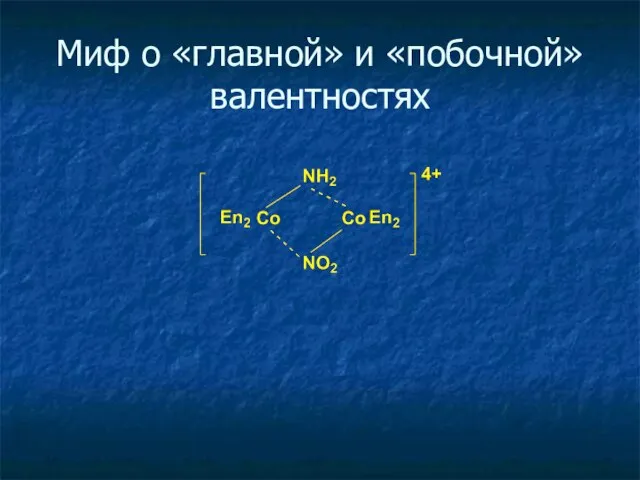
- 8. Миф о «главной» и «побочной» валентностях
- 9. Строение комплексного соединения K3 [Fe(CN)6] Ион- Комплексо- образователь Лиганды Координационное число Внутренняя сфера Внешняя сфера [Cu(NH3)4]Cl2
- 10. Номенклатура комплексных соединений K3 [Fe(CN)6] Гексацианоферрат(III) калия [Cu(NH3)4]Cl2 Хлорид тетраамминмеди(II) +3 +2 Порядок перечисления лиганд: Анионные:
- 11. Упражнение 1 Первое основание Рейзе [Pt(NH3)4](OH)2 Соль Чугаева [PtCl(NH3)5]Cl3 Соль Цейзе K[PtCl3C2H4] Пурпуреосоль [CoCl(NH3)5]Cl2 Кроцеосоль [Co(NO2)2(NH3)4]Cl
- 12. Упражнение 2 Гексанитрокобальтат(III) натрия Na3[Co(NO2)6] Гидроксид диамминсеребра(I) [Ag(NH3)2]OH реактив Толленса Тетраиодомеркурат(II) калия K2[HgI4] реактив Несслера Тетрароданомеркурат(II)
- 14. Вернер подтверждает Вернера 1893-4 гг. не были периодом утверждения теории. Вернер 20 лет не оставлял лаборатории
- 15. Ряды Вернера - Миолати 1 [Pt(NH3)6]Cl4 2 [Pt(NH3)5Cl]Cl3 3 [Pt(NH3)4Cl2]Cl2 4 [Pt(NH3)3Cl3]Cl 5 [Pt(NH3)2Cl4] 6 K[Pt(NH3)Cl5]
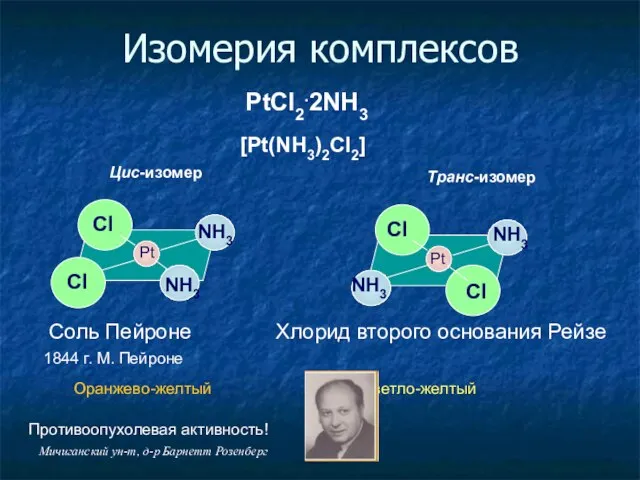
- 16. Изомерия комплексов PtCl2.2NH3 Pt Pt Cl Cl Cl Cl NH3 NH3 NH3 NH3 Соль Пейроне Хлорид
- 17. Сольватная изомерия
- 18. Механизм образования комплексного иона [Al(OH)4]-
- 19. Комплексные соединения в растворах Первичная диссоциация комплексных соединений K3[Fe(CN)6] = 3K+ + [Fe(CN)6]3- [Cu(NH3)4]SO4 = [Cu(NH3)4]2+
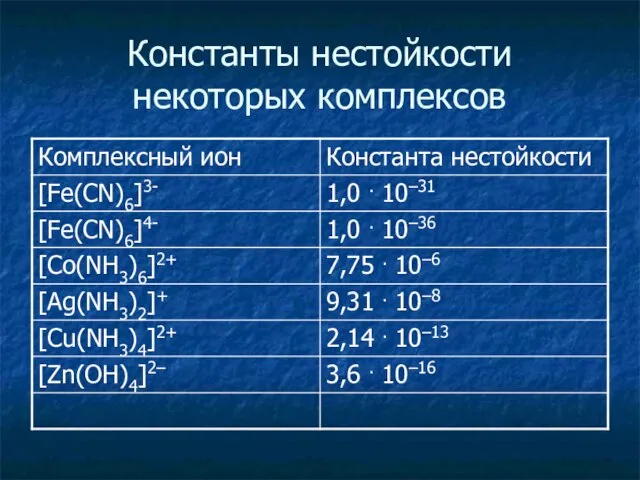
- 20. Вторичная диссоциация комплексов [Ag(NH3)2]+ [Ag(NH3)]+ + NH3 [Ag(NH3)]+ Ag+ + NH3 [Ag+] [NH3]2 KH = =
- 21. Константы нестойкости некоторых комплексов
- 22. Что же такое комплексы? Комплексные соединения – вещества, существующие как в кристаллическом состоянии, так и в
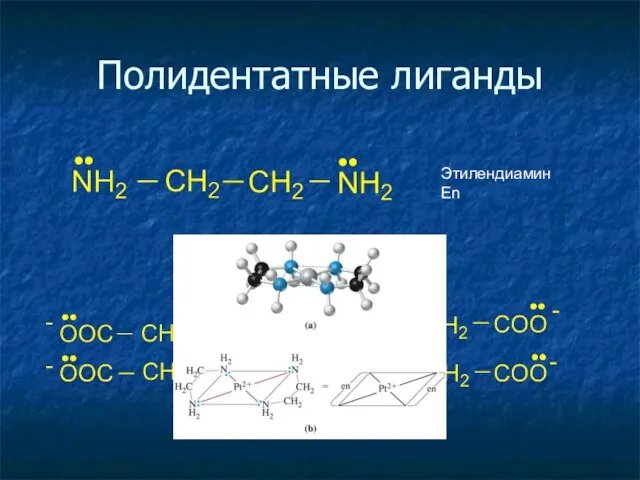
- 23. Полидентатные лиганды ЭДТА Этилендиамин En
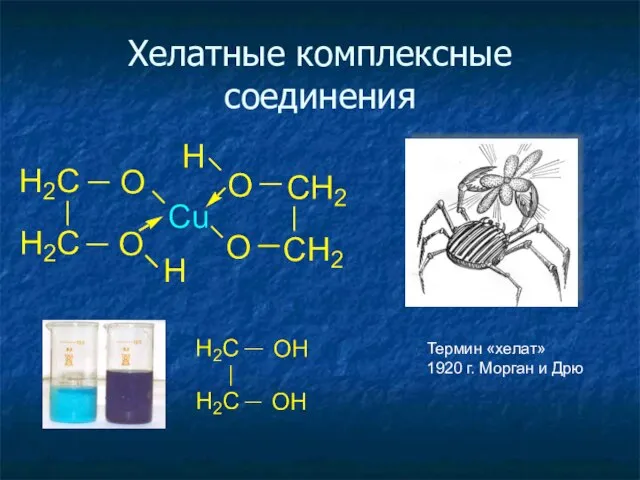
- 24. Хелатные комплексные соединения Термин «хелат» 1920 г. Морган и Дрю
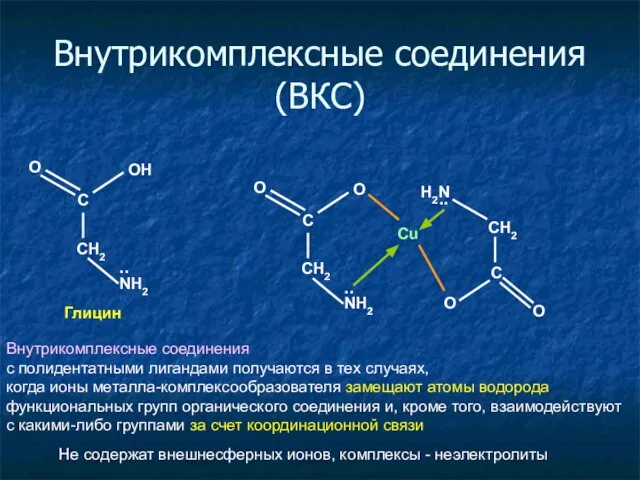
- 25. Внутрикомплексные соединения (ВКС) CH2 С OH NH2 .. Глицин O Cu CH2 С O NH2 ..
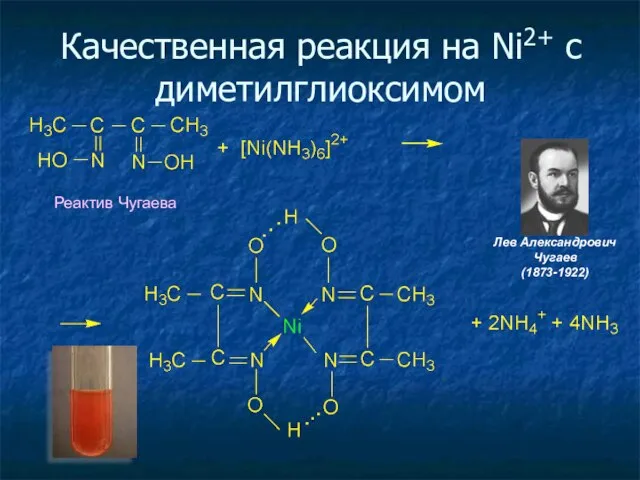
- 26. Качественная реакция на Ni2+ c диметилглиоксимом Реактив Чугаева Лев Александрович Чугаев (1873-1922)
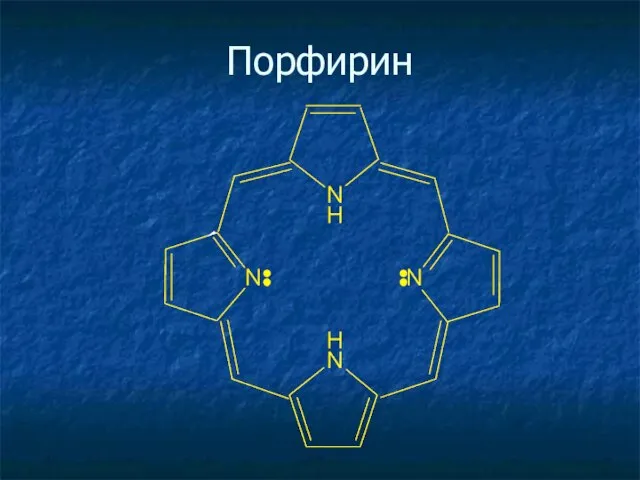
- 27. Порфирин
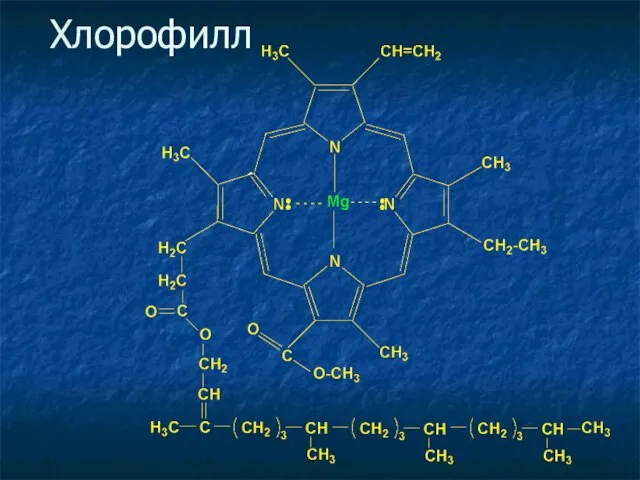
- 28. Хлорофилл
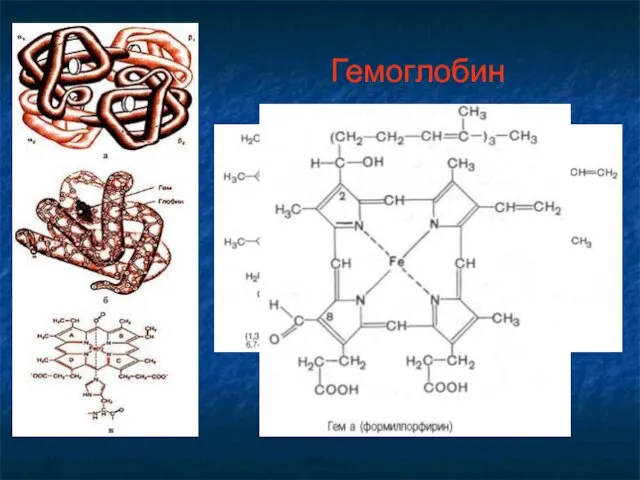
- 29. Гемоглобин
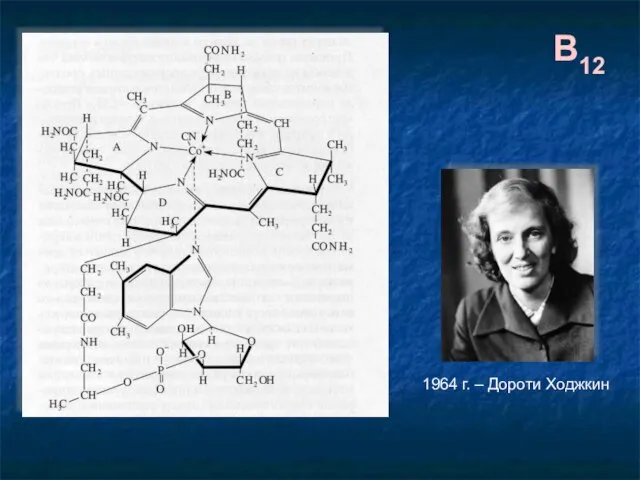
- 30. B12 1964 г. – Дороти Ходжкин
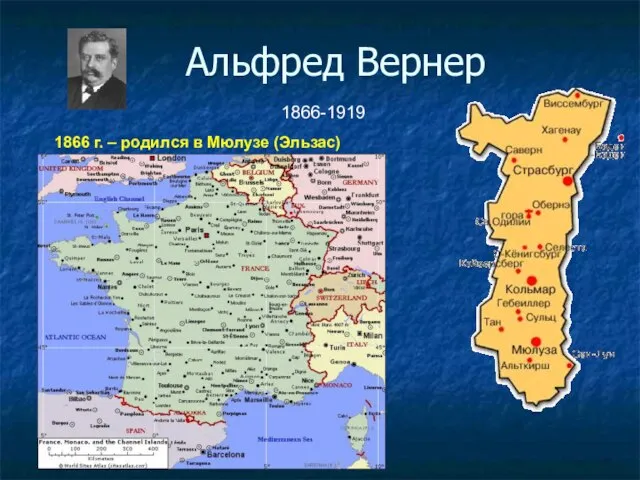
- 31. Альфред Вернер 1866-1919 1866 г. – родился в Мюлузе (Эльзас)
- 32. 1891 г. – конкурсная работа на звание приват-доцента «К теории сродства и валентности» 1891 г –
- 33. Альфред Вернер 1866-1919 В 1913 г. шведский король Густав V вручил Альфреду Вернеру золотую медаль лауреата
- 34. Спасибо за внимание!
- 36. Скачать презентацию




![Строение комплексного соединения K3 [Fe(CN)6] Ион- Комплексо- образователь Лиганды Координационное число Внутренняя](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/382099/slide-8.jpg)
![Номенклатура комплексных соединений K3 [Fe(CN)6] Гексацианоферрат(III) калия [Cu(NH3)4]Cl2 Хлорид тетраамминмеди(II) +3 +2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/382099/slide-9.jpg)
2 Соль Чугаева [PtCl(NH3)5]Cl3 Соль Цейзе K[PtCl3C2H4]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/382099/slide-10.jpg)
![Упражнение 2 Гексанитрокобальтат(III) натрия Na3[Co(NO2)6] Гидроксид диамминсеребра(I) [Ag(NH3)2]OH реактив Толленса Тетраиодомеркурат(II) калия](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/382099/slide-11.jpg)


![Ряды Вернера - Миолати 1 [Pt(NH3)6]Cl4 2 [Pt(NH3)5Cl]Cl3 3 [Pt(NH3)4Cl2]Cl2 4 [Pt(NH3)3Cl3]Cl](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/382099/slide-14.jpg)

![Механизм образования комплексного иона [Al(OH)4]-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/382099/slide-17.jpg)
![Комплексные соединения в растворах Первичная диссоциация комплексных соединений K3[Fe(CN)6] = 3K+ +](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/382099/slide-18.jpg)
![Вторичная диссоциация комплексов [Ag(NH3)2]+ [Ag(NH3)]+ + NH3 [Ag(NH3)]+ Ag+ + NH3 [Ag+]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/382099/slide-19.jpg)




 Роль физической культуры и спорта в нашей жизни
Роль физической культуры и спорта в нашей жизни Джеймс Олдридж
Джеймс Олдридж Соли аммония
Соли аммония Романовская игрушка
Романовская игрушка Построение автоматов
Построение автоматов Перевозка детей на воздушном транспорте
Перевозка детей на воздушном транспорте 1 Художній твір як явище мистецтва, новий ірреальний
1 Художній твір як явище мистецтва, новий ірреальний Сопровождение региональных инновационных площадок в 2022 году
Сопровождение региональных инновационных площадок в 2022 году Структура книги
Структура книги Котёл низкого давления
Котёл низкого давления Оставьте цветы весне
Оставьте цветы весне Презентация на тему Стресс, стрессовое состояние
Презентация на тему Стресс, стрессовое состояние  Актуальность, проблемы и перспективы развития профессионального признания в России Владивосток 2011
Актуальность, проблемы и перспективы развития профессионального признания в России Владивосток 2011 СИЛА ТОКА Кл t А q ЗАРЯД Дж U U q НАПРЯЖЕНИЕ А I I t РАБОТА с А q t ВРЕМЯ В q.
СИЛА ТОКА Кл t А q ЗАРЯД Дж U U q НАПРЯЖЕНИЕ А I I t РАБОТА с А q t ВРЕМЯ В q. Обязательства и ответственность по правам человека
Обязательства и ответственность по правам человека Учебные вопросы: Техника скоростной записи слов и предложений. Применение цветных ручек и карандашей при конспектировании
Учебные вопросы: Техника скоростной записи слов и предложений. Применение цветных ручек и карандашей при конспектировании Упражнения для мышц брюшного пресса (юноши)
Упражнения для мышц брюшного пресса (юноши) Вычисление площади криволинейной трапеции
Вычисление площади криволинейной трапеции Машиностроительное черчение
Машиностроительное черчение Хакасия – моя Родина!
Хакасия – моя Родина! Презентация на тему Как вести себя во время теракта
Презентация на тему Как вести себя во время теракта Мониторинг Active Session History c использованием ASH Viewer
Мониторинг Active Session History c использованием ASH Viewer История моды 20 века
История моды 20 века Союз поисковых отрядов
Союз поисковых отрядов Промоакции и их роль в продвижении товаров
Промоакции и их роль в продвижении товаров Christmas what are they doing fun
Christmas what are they doing fun Олимпийские игры
Олимпийские игры Как правильно передвигаться по загородной дороге?
Как правильно передвигаться по загородной дороге?