Содержание
- 2. Біосенсором, як правило, можна визначати лише один тип речовин, тоді як будь-який зразок може містити їхню
- 3. В літературі описано мультибіосенсори на основі напівпровідникових структур для одночасного визначення концентрацій глюкози і сечовини у
- 4. Зовнішній вигляд мультиперетворювачів виробництва Інституту хемо- і біосенсорики м. Мюнстер, Німеччина.
- 5. Кремнієва лінійка з 6-елементним масивом р-канальних іоноселективних польових транзисторів, виготовлених в Інституті фізики напівпровідників
- 6. Зовнішній вигляд приладу для роботи з мультисенсором на основі лінійки рН-ПТ.
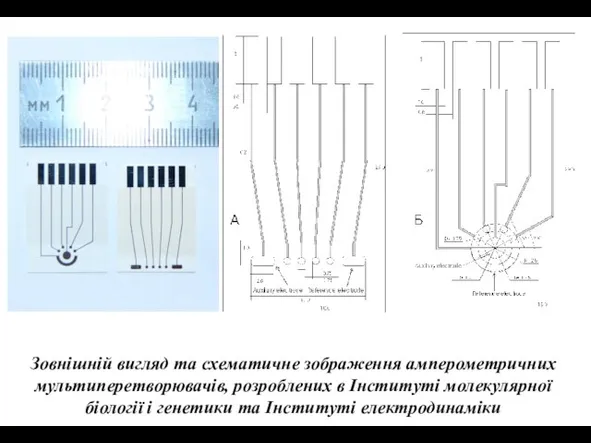
- 7. Зовнішній вигляд та схематичне зображення амперометричних мультиперетворювачів, розроблених в Інституті молекулярної біології і генетики та Інституті
- 8. Для підключення мультисенсору до установки було розроблено та виготовлено контактний пристрій, який мав у своєму складі
- 9. Зовнішній вигляд портативної системи для роботи з амперометричними мультибіосенсорами
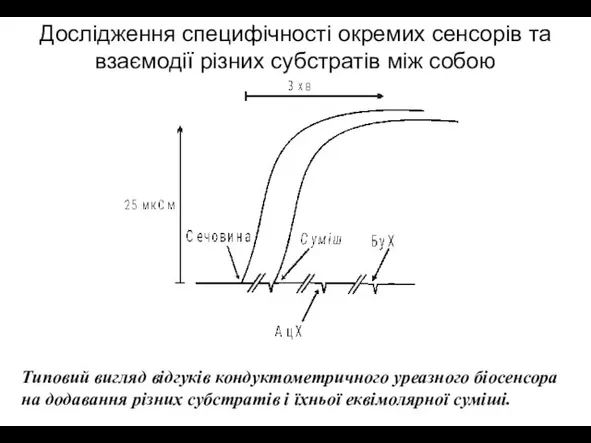
- 10. Дослідження специфічності окремих сенсорів та взаємодії різних субстратів між собою Типовий вигляд відгуків кондуктометричного уреазного біосенсора
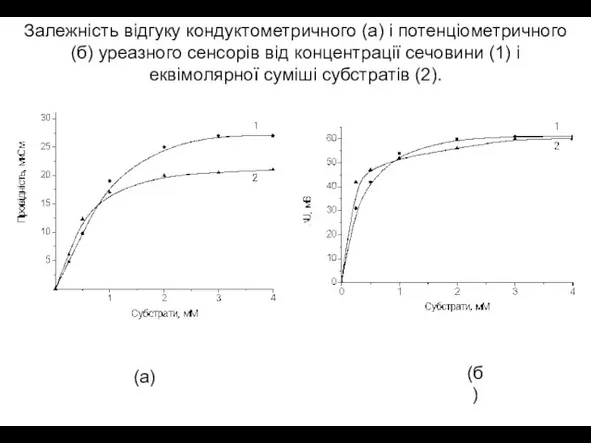
- 11. Залежність відгуку кондуктометричного (a) і потенціометричного (б) уреазного сенсорів від концентрації сечовини (1) і еквімолярної суміші
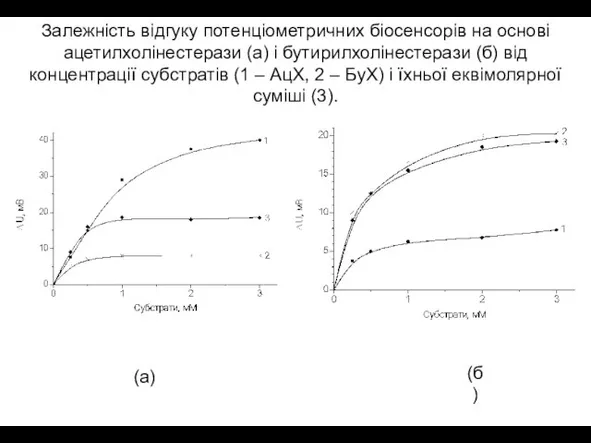
- 12. Залежність відгуку потенціометричних біосенсорів на основі ацетилхолінестерази (а) і бутирилхолінестерази (б) від концентрації субстратів (1 –
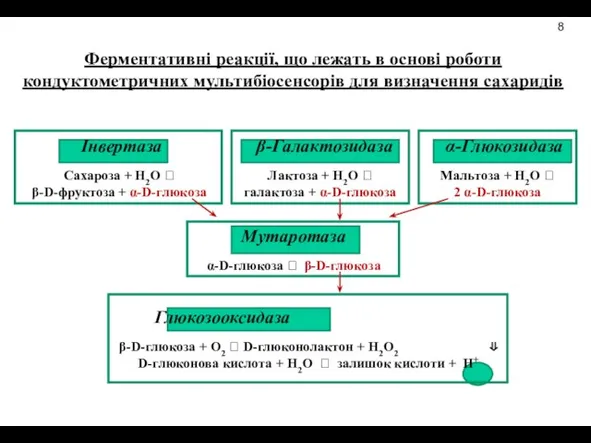
- 13. Ферментативні реакції, що лежать в основі роботи кондуктометричних мультибіосенсорів для визначення сахаридів 8
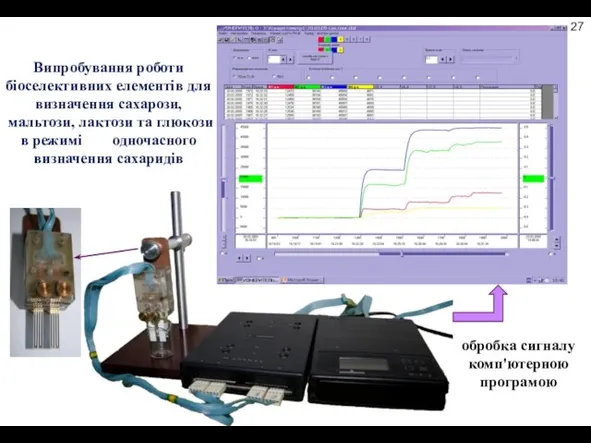
- 14. Випробування роботи біоселективних елементів для визначення сахарози, мальтози, лактози та глюкози в режимі одночасного визначення сахаридів
- 15. Мультисенсори на основі ферментного інгібіторного аналізу
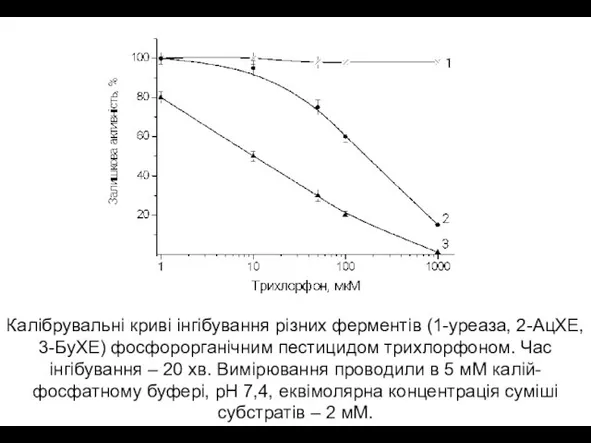
- 16. Калібрувальні криві інгібування різних ферментів (1-уреаза, 2-АцХЕ, 3-БуХЕ) фосфорорганічним пестицидом трихлорфоном. Час інгібування – 20 хв.
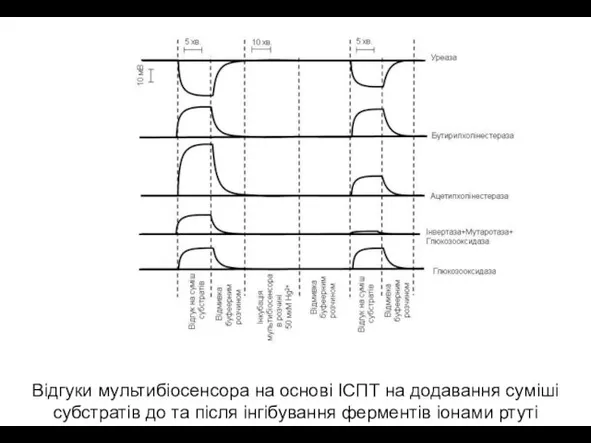
- 17. Відгуки мультибіосенсора на основі ІСПТ на додавання суміші субстратів до та після інгібування ферментів іонами ртуті
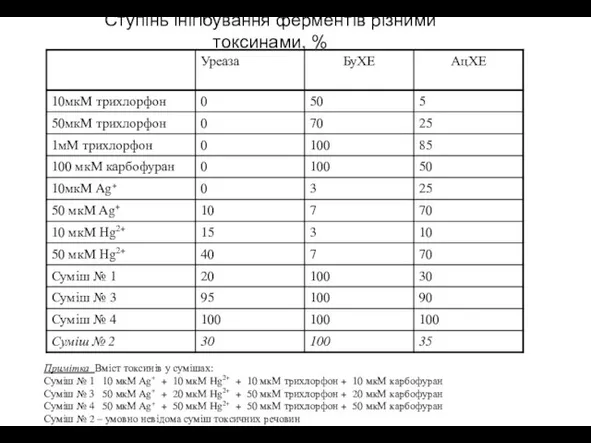
- 18. Ступінь інігібування ферментів різними токсинами, % Примітка Вміст токсинів у сумішах: Суміш № 1 10 мкМ
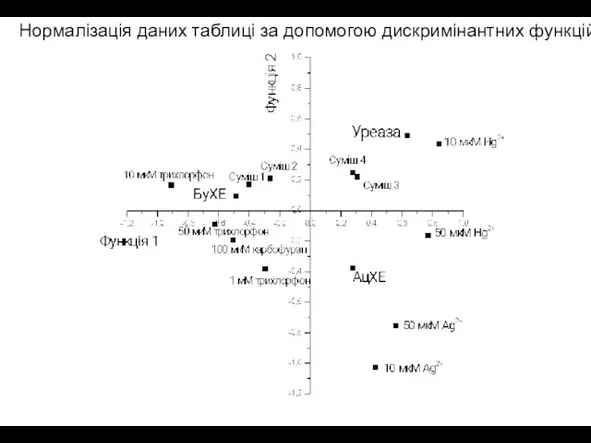
- 19. Для кількісного визначення суміші токсичних речовин у досліджуваній пробі користувалися дискримінантним функціональним аналізом. У цьому випадку
- 20. Нормалізація даних таблиці за допомогою дискримінантних функцій
- 21. Найбільш точне кількісне визначення складу суміші отримується за допомогою самонавчального методу штучних нейронних мереж. У цьому
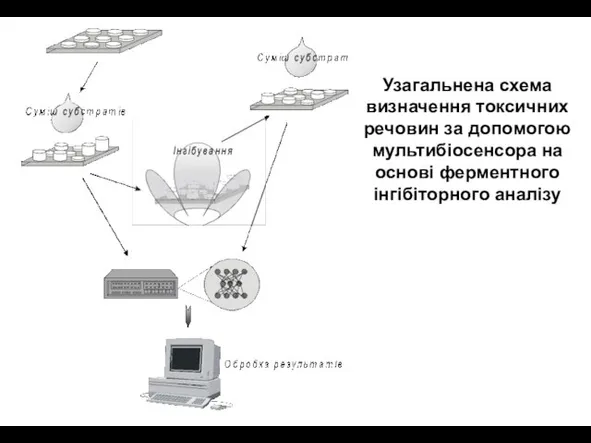
- 22. Узагальнена схема визначення токсичних речовин за допомогою мультибіосенсора на основі ферментного інгібіторного аналізу
- 23. Використання мікроорганізмів може призвести до вирішення частини проблем. Всі ферменти, що використовуються, повинні функціонувати одночасно в
- 24. Використання мікроорганізмів як природних мультиферментних систем Електрохімічні біосенсори на основі зелених мікроводоростей Chlorella vulgaris
- 25. Мікроводорості Chlorella vulgaris можна розглядати як природні мультиферментні системи, за допомогою яких після їхньої оптимізації можна
- 26. Принцип роботи біосенсора на основі зелених мікроводоростей Chlorella vulgaris базується на такій ферментативній реакції: фосфатаза субстрат
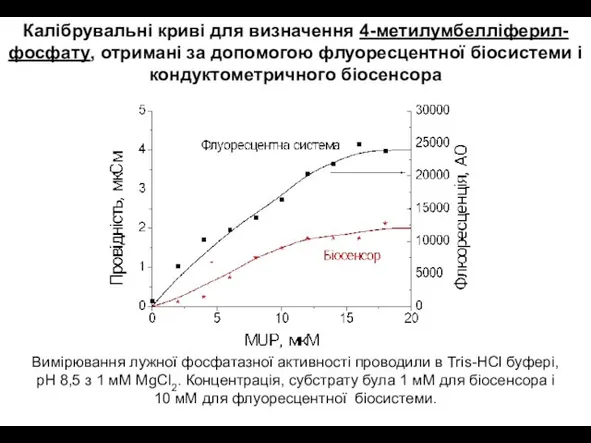
- 27. Вимірювання лужної фосфатазної активності проводили в Tris-HCl буфері, pH 8,5 з 1 мM MgCl2. Концентрація, субстрату
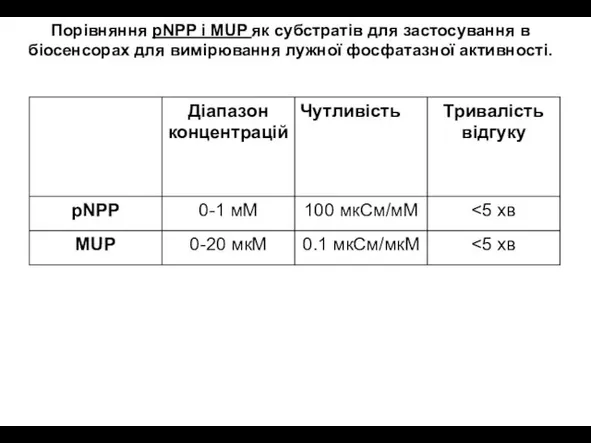
- 28. Порівняння pNPP і MUP як субстратів для застосування в біосенсорах для вимірювання лужної фосфатазної активності.
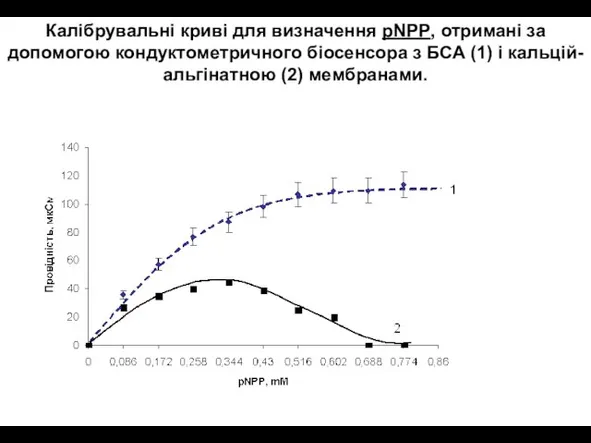
- 29. Калібрувальні криві для визначення pNPP, отримані за допомогою кондуктометричного біосенсора з БСА (1) і кальцій-альгінатною (2)
- 30. Як показано на Рис., сигнал біосенсора на основі кальцій-альгінатної мембрани зменшується при високих концентраціях pNPP (>0.3
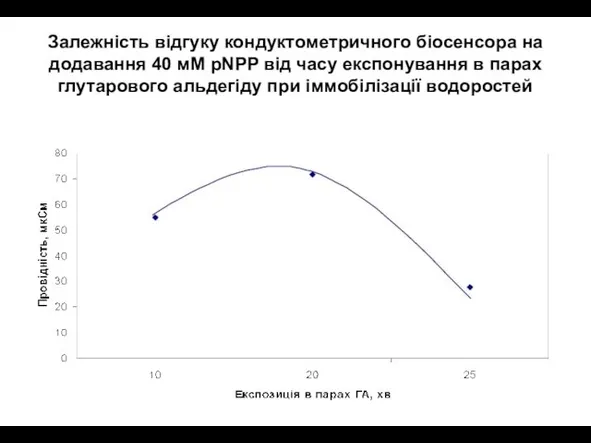
- 31. Залежність відгуку кондуктометричного біосенсора на додавання 40 мМ pNPP від часу експонування в парах глутарового альдегіду
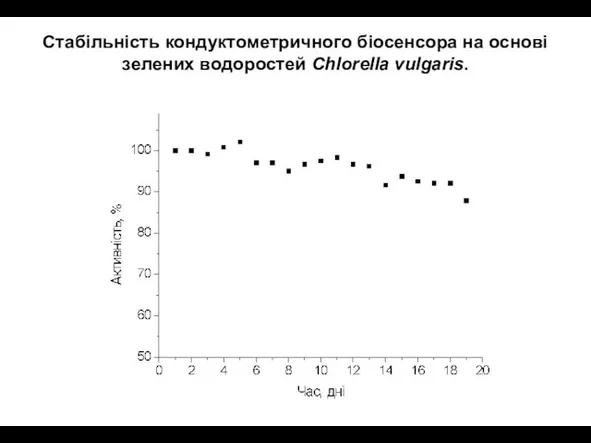
- 32. Стабільність кондуктометричного біосенсора на основі зелених водоростей Chlorella vulgaris.
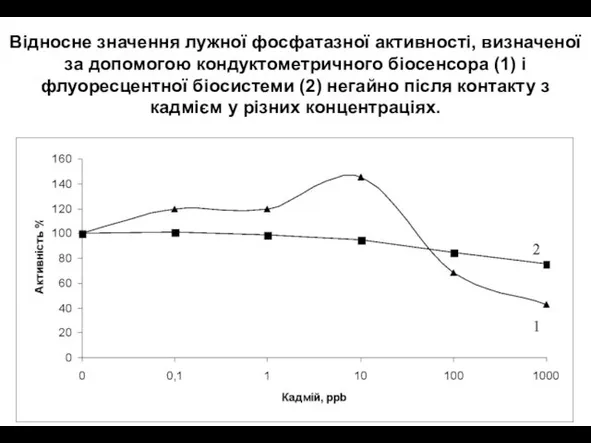
- 33. Відносне значення лужної фосфатазної активності, визначеної за допомогою кондуктометричного біосенсора (1) і флуоресцентної біосистеми (2) негайно
- 34. В обох випадках для малих концентрацій кадмію ( 1 години) іншими авторами, які пояснюють її клітинним
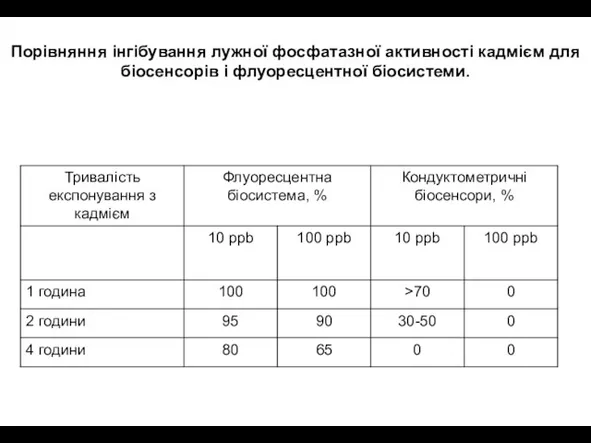
- 35. Порівняння інгібування лужної фосфатазної активності кадмієм для біосенсорів і флуоресцентної біосистеми.
- 36. При тривалому експонуванні спостерігали більш швидке інгібування, отримане за допомогою біосенсорів, ніж флуоресцентої біосистеми. Те ж
- 37. Показано, що за допомогою такої мультиферментної системи можна вивчати лужну фосфатазну активність Chlorella vulgaris та вплив
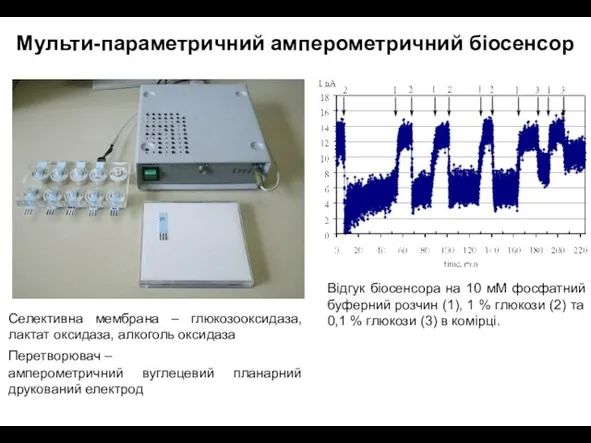
- 38. Мульти-ферментна електрохімічна система для експресної діагностики токсичних речовин Селективна мембрана – бутирил холінестераза, ацетилхолінестераза, уреаза Перетворювач
- 39. Відгук біосенсора на 10 мМ фосфатний буферний розчин (1), 1 % глюкози (2) та 0,1 %
- 40. Електронний ніс ГАЗ-1 Розпізнавання хімічних образів Масив сенсорів (8) являє собою набір кварцевих резонаторів, поверхя кожного
- 42. Скачать презентацию




















 Жилища древних южноуральцев
Жилища древних южноуральцев НАРУШЕНИЕ ЛЕКСИЧЕСКИХ НОРМ В СОВРЕМЕННОЙ РУССКОЙ РЕЧИ. ПОДГОТОВИЛ: ученик 9 к
НАРУШЕНИЕ ЛЕКСИЧЕСКИХ НОРМ В СОВРЕМЕННОЙ РУССКОЙ РЕЧИ. ПОДГОТОВИЛ: ученик 9 к СУФФИКСЫ –НИК-, -НИЩ-.
СУФФИКСЫ –НИК-, -НИЩ-. 20140324_samyy_umnyy_7_klass
20140324_samyy_umnyy_7_klass презентация (3)
презентация (3) Федеральное государственное унитарное предприятие«Всероссийский научно-исследовательский институт расходометрии»ФГУП «ВНИ
Федеральное государственное унитарное предприятие«Всероссийский научно-исследовательский институт расходометрии»ФГУП «ВНИ Проблемное обучения в современном образовании
Проблемное обучения в современном образовании Развитие гибкости младших школьников через использование игрового метода на уроках физической культуры
Развитие гибкости младших школьников через использование игрового метода на уроках физической культуры Смесеприготовительное оборудование
Смесеприготовительное оборудование Требования К ПРОВЕРКЕ ТЕТРАДЕЙ И ОФОРМЛЕНИЮ ПИСЬМЕННЫХ РАБОТ В ШКОЛЕ I СТУПЕНИ.
Требования К ПРОВЕРКЕ ТЕТРАДЕЙ И ОФОРМЛЕНИЮ ПИСЬМЕННЫХ РАБОТ В ШКОЛЕ I СТУПЕНИ. Понятие креативности. Технология решения творческих задач
Понятие креативности. Технология решения творческих задач Презентация на тему Трофическая структура БГЦ
Презентация на тему Трофическая структура БГЦ  «Оттепель» в духовной жизни
«Оттепель» в духовной жизни Описание картины осенней тематики
Описание картины осенней тематики Альпинистская подготовка
Альпинистская подготовка Бюджетная модель организации. Тема 7
Бюджетная модель организации. Тема 7 The Government Economic Policy
The Government Economic Policy  Презентация на тему Понятие функции (7 класс)
Презентация на тему Понятие функции (7 класс) МОУ "БУХОЛОВСКАЯ СОШ"
МОУ "БУХОЛОВСКАЯ СОШ" Понятие и функции заработной платы
Понятие и функции заработной платы Спорт-кейс
Спорт-кейс Тактика войск ПВО Сухопутных войск
Тактика войск ПВО Сухопутных войск Информация о заполнении документов на социальное питание
Информация о заполнении документов на социальное питание О формировании предпринимательских способностей. №70
О формировании предпринимательских способностей. №70 Тема урока: «Главные и второстепенные члены предложения» Цель урока: Актуализация и систематизация знаний учащихся о различных в
Тема урока: «Главные и второстепенные члены предложения» Цель урока: Актуализация и систематизация знаний учащихся о различных в Respiratory diseases
Respiratory diseases Уроки с использованием компьютерных технологий в учебном процессе
Уроки с использованием компьютерных технологий в учебном процессе Презентация на тему Наблюдение над словами-названиями признаков
Презентация на тему Наблюдение над словами-названиями признаков