Содержание
- 2. Рекомендуемая литература (основная и дополнительная) 1. Карпов Ю.А., Савостин А.П., Сальников В.Д. Аналитический контроль в металлургическом
- 3. История развития аналитической химии 14 век, Франция – отработан метод определения серебра и золота, основанный на
- 4. Методы аналитической химии Химический состав вещества - совокупность компонентов, из которых состоит вещество . Примечание -
- 5. Методы аналитической химии В зависимости от того, какие компоненты нужно обнаружить или определить, различают анализ элементный,
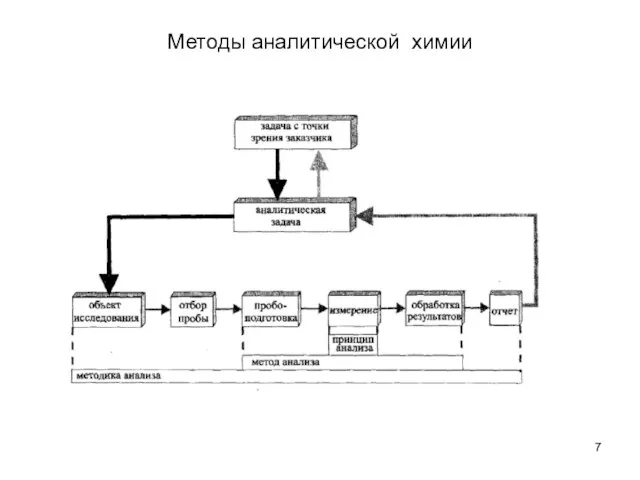
- 6. Методы аналитической химии Принцип анализа вещества- физическое явление или эффект, положенный в основу метода анализа вещества
- 7. Методы аналитической химии
- 8. Методы аналитической химии Химические методы основаны на проведении химических реакций между определяемым веществом и веществом-реагентом. Идентификация
- 9. Методы аналитической химии Аналитические признаки – свойства анализируемого вещества, или продуктов его превращения, позволяющие судить о
- 10. Гравиметрия Гравиметрический анализ заключается в выделении вещества в чистом виде и его взвешивании. Это абсолютный (безэталонный)
- 11. Гравиметрия Требования к осаждаемой форме: - осадок должен быть практически нерастворим. Концентрация в растворе после осаждения
- 12. Гравиметрия Требования к гравиметрической форме : - гравиметрическая форма должна быть стехиометрическим соединением известного состава. -
- 13. Гравиметрия Источники загрязнения осадков 1. При совместном осаждении разных ионов (например, гидроксид железа (III) и алюминия)
- 14. Гравиметрия Окклюзия – захват посторонних ионов в процессе образования осадка. Количество и вид загрязняющих веществ зависят
- 15. Гравиметрия Примеры неорганических осадителей
- 16. Гравиметрия Методы отгонки В этих методах часть анализируемого объекта должна быть летучей или превращаться в летучую
- 17. Титриметрические методы Титрование – процесс прибавления небольшими порциями стандартного раствора реагента, называемого титрантом, к анализируемому раствору
- 18. Титриметрические методы Масса вещества определяется с учетом его молекулярной массы Реакция заканчивается при достижении точки стехиометричности
- 19. Титриметрические методы Классификация титриметрических методов
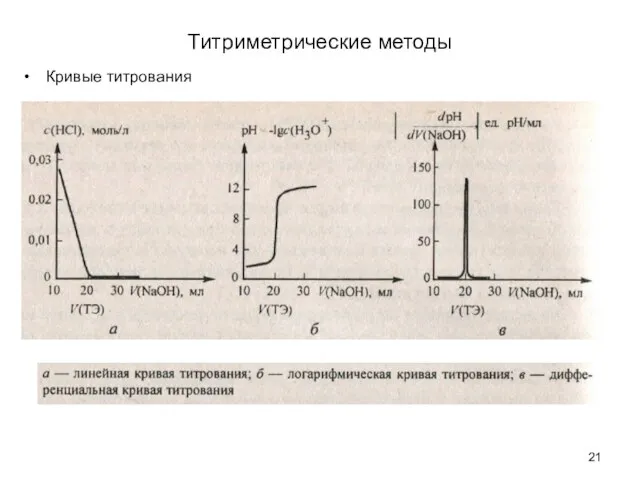
- 20. Титриметрические методы Кривые титрования
- 21. Титриметрические методы Кривые титрования
- 22. Титриметрические методы Реакция титрования должна отвечать требованиям: 1. Быть строго стехиометрической 2. Протекать быстро 3. Иметь
- 23. Титриметрические методы Требования к стандартным веществам: 1. Состав соединения должен соответствовать химической формуле. 2. Вещество должно
- 24. Титриметрические методы Способы выражения концентрации в титрометрическом анализе. Молярная концентрация с(А) — количество растворенного вещества А
- 25. Титриметрические методы Способы выражения концентрации в титрометрическом анализе. Титр Т(А) растворенного вещества А — это масса
- 26. Титриметрические методы Виды титрования: Прямое титрование – определяемое вещество непосредственно титруется стандартным раствором.
- 27. Титриметрические методы Виды титрования: Обратное титрование – титрование непрореагировавшего вещества, которое добавлено в избытке к анализируемому
- 28. Титриметрические методы Виды титрования Косвенное титрование (заместительное титрование) – титрование, при котором определяемое вещество не реагирует
- 29. Титриметрические методы Виды титрования Пример косвенного титрования. Определение нитратов 1) NaNO3+4Zn+7NaOH+6H2O→NH3 ↑+ 4 Na2[Zn(OH)4] X B
- 30. Титриметрические методы . Кислотно-основное титрование H2O ↔ H+ + OH- (С учетом образования иона гидроксония H2O
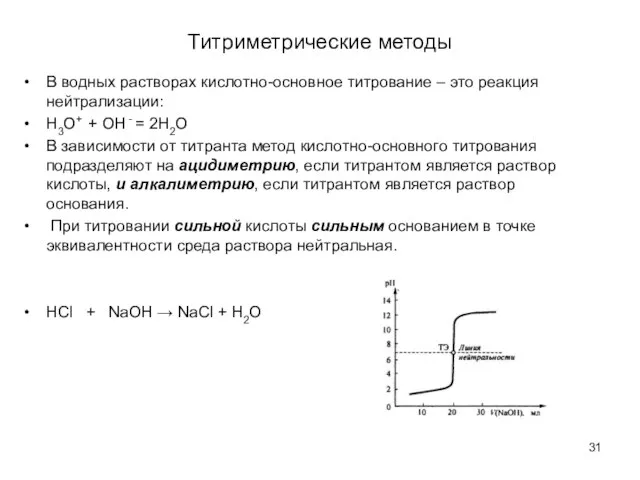
- 31. Титриметрические методы В водных растворах кислотно-основное титрование – это реакция нейтрализации: Н3O+ + OH - =
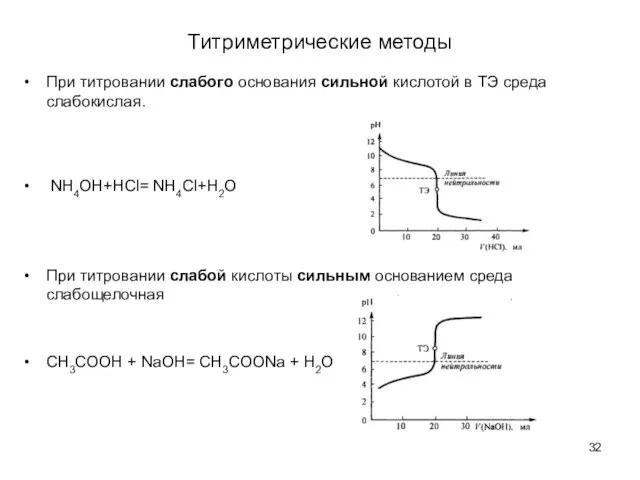
- 32. Титриметрические методы При титровании слабого основания сильной кислотой в ТЭ среда слабокислая. NH4OH+HCl= NH4Cl+H2O При титровании
- 33. Титриметрические методы Титрование многоосновных кислот Константы электролитической диссоциации К1 = 1,1*10-2 К2= 2,0*10-7 К3 = 3,6*10-13
- 34. Титриметрические методы Индикаторами называются вещества, изменяющие свою окраску в зависимости от pH среды. По своей химической
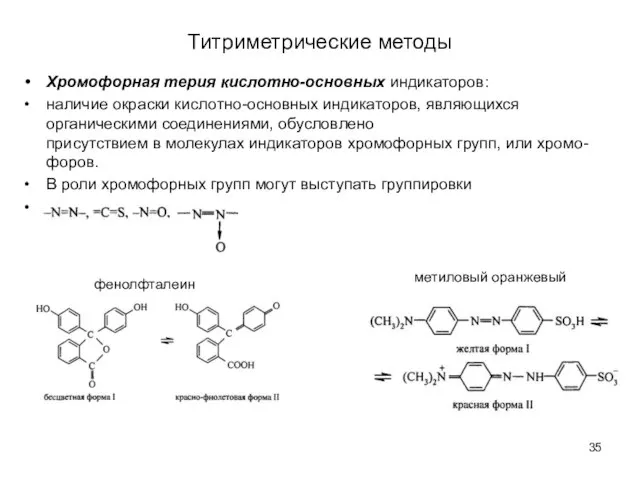
- 35. Титриметрические методы Хромофорная терия кислотно-основных индикаторов: наличие окраски кислотно-основных индикаторов, являющихся органическими соединениями, обусловлено присутствием в
- 36. Титриметрические методы ВЫБОР ИНДИКАТОРА ПО ПРОДУКТАМ РЕАКЦИИ В случае экспрессного анализа, когда нет возможности провести титрование
- 37. Титриметрические методы ВЫБОР ИНДИКАТОРА ПО КРИВОЙ ТИТРОВАНИЯ
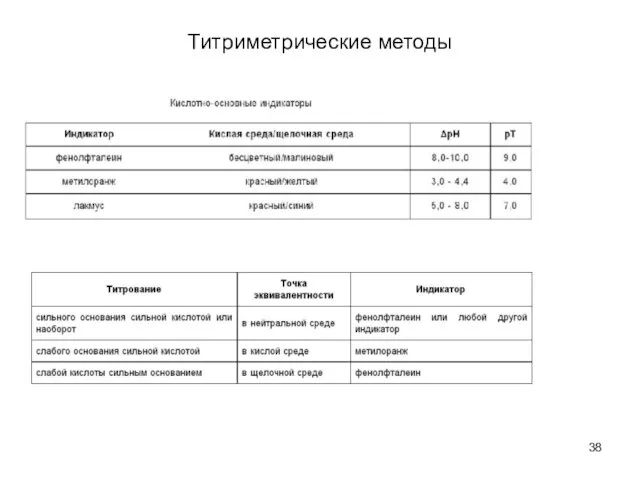
- 38. Титриметрические методы
- 39. Титриметрические методы
- 40. Титриметрические методы Комплексонометрическое титрование Комплексонометрическое титрование основано на взаимодействии ионов металлов с полиаминкарбоновыми кислотами. Наиболее часто
- 41. Титриметрические методы Окислительно-восстановительное титрование Способы обнаружения конца титрования - исчезновение или появление окраски титранта или определяемого
- 43. Скачать презентацию


































 Отрасли права
Отрасли права Sistemul solar
Sistemul solar АЛЕРГІЯ
АЛЕРГІЯ Основные виды банковских рисков
Основные виды банковских рисков  Собор Василия Блаженного.
Собор Василия Блаженного. Ольховский И. А., Бабушкин В.А., Малахов В.Н *, Исхаков Т.Р. РОО "Красноярская краевая ассоциация медицинской лабораторной диагностик
Ольховский И. А., Бабушкин В.А., Малахов В.Н *, Исхаков Т.Р. РОО "Красноярская краевая ассоциация медицинской лабораторной диагностик МОУ «Афанасовская СОШ Корочанского района Белгородской области»
МОУ «Афанасовская СОШ Корочанского района Белгородской области» HARWEST GROUP. Поставщик кабельно-проводниковой и электротехнической продукции
HARWEST GROUP. Поставщик кабельно-проводниковой и электротехнической продукции Генные технологии и биоэтика
Генные технологии и биоэтика Психические процессы
Психические процессы Ценник. Наименование. Цена
Ценник. Наименование. Цена Слышишь голос соловья? Это - Родина твоя. Видишь звездочки Кремля? Это - Родина твоя. Школа, где твои друзья, Это - Родина твоя. Руки ма
Слышишь голос соловья? Это - Родина твоя. Видишь звездочки Кремля? Это - Родина твоя. Школа, где твои друзья, Это - Родина твоя. Руки ма Презентация на тему Музыкальная живопись и живописная музыка (5 класс)
Презентация на тему Музыкальная живопись и живописная музыка (5 класс) Квадратные уравнения
Квадратные уравнения Бизнес-геймификация на личной странице ВКонтакте. Лиды на автомате за счёт автоматизации и личного бренда
Бизнес-геймификация на личной странице ВКонтакте. Лиды на автомате за счёт автоматизации и личного бренда Великая Отечественная война
Великая Отечественная война Презентация на тему Печоро-Илычский заповедник
Презентация на тему Печоро-Илычский заповедник Slide 1 BA-BU
Slide 1 BA-BU The hippies
The hippies Я, Мишко, учень 8-А класу Я, Марійка, учениця 8-Б класу Я, Назар, учень 8-Б класу Я, Оленка, учениця 8-А класу Ми працюємо над проектом Чоти
Я, Мишко, учень 8-А класу Я, Марійка, учениця 8-Б класу Я, Назар, учень 8-Б класу Я, Оленка, учениця 8-А класу Ми працюємо над проектом Чоти Салат из крабовых палочек с кукурузой
Салат из крабовых палочек с кукурузой Пиявки
Пиявки Прямой поставщик товаров из Китая
Прямой поставщик товаров из Китая Преимущества сотрудничества с «Миром рекламы» по размещению в Интернете
Преимущества сотрудничества с «Миром рекламы» по размещению в Интернете Гиппократ. Описания свойств сангвиников, холериков, флегматиков
Гиппократ. Описания свойств сангвиников, холериков, флегматиков Цвет. Основы цветоведения
Цвет. Основы цветоведения Япония 日本
Япония 日本 Страна под настроение
Страна под настроение