Содержание
- 2. Проверка домашнего материала: Как назвали способность атомов некоторых химических элементов к самопроизвольному излучению? Как были названы
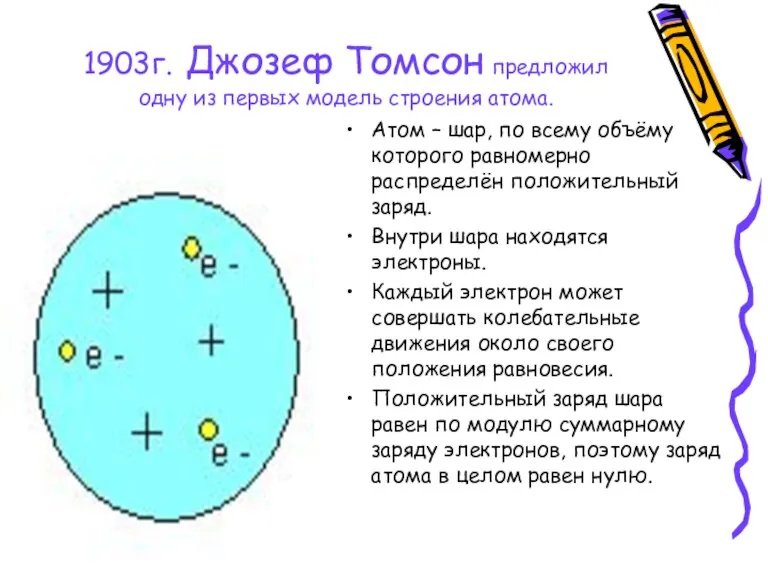
- 3. 1903г. Джозеф Томсон предложил одну из первых модель строения атома. Атом – шар, по всему объёму
- 4. Модель Томсона нуждалась в экспериментальной проверке. Важно было проверить, действительно ли положительный заряд распределён по всему
- 5. Идея опыта Резерфорда: Зондировать атом альфа–частицами. Альфа-частицы возникают при распаде радия. Масса альфа-частицы в 8000 раз
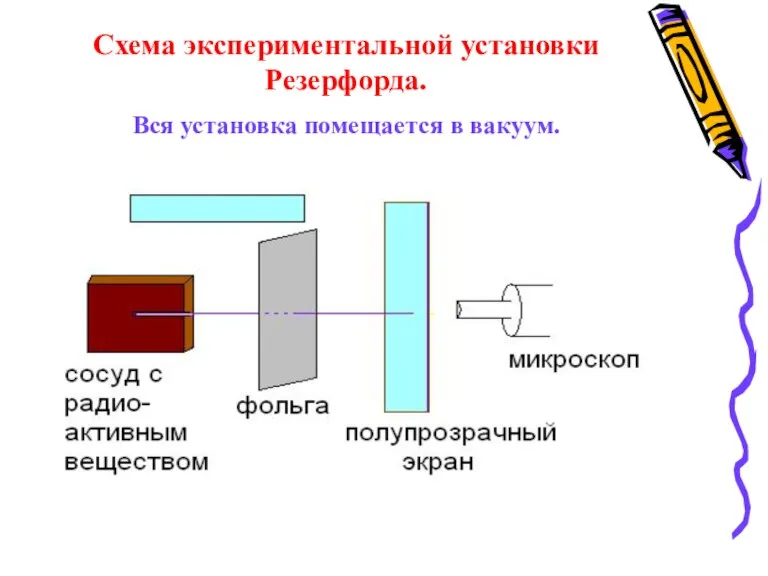
- 6. Схема экспериментальной установки Резерфорда. Вся установка помещается в вакуум.
- 7. В ходе эксперимента обнаружили: 1. В отсутствии фольги – на экране появлялся светлый кружок напротив канала
- 8. Противоречие модели Томсона с экспериментом: 1. Так как масса электронов мала, они не могут заметно изменить
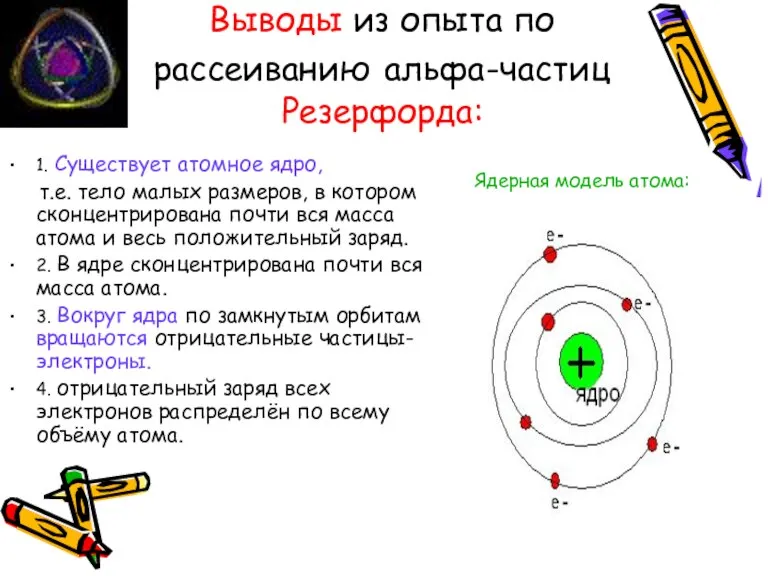
- 9. Выводы из опыта по рассеиванию альфа-частиц Резерфорда: 1. Существует атомное ядро, т.е. тело малых размеров, в
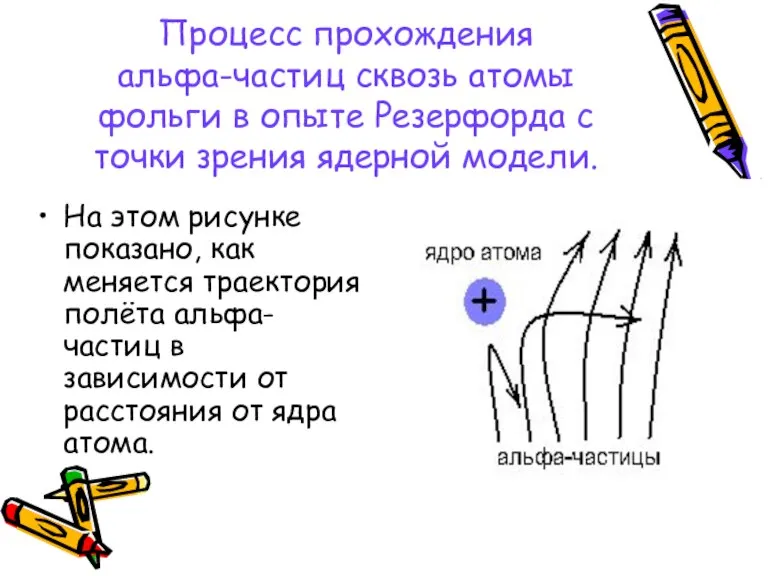
- 10. Процесс прохождения альфа-частиц сквозь атомы фольги в опыте Резерфорда с точки зрения ядерной модели. На этом
- 11. Недостаток планетарной модели атома: Нельзя объяснить факт существования атома; Нельзя объяснить устойчивость атома.
- 13. Скачать презентацию






 Особенности истории России. Место России в мировом историческом процессе
Особенности истории России. Место России в мировом историческом процессе Оппортунистические инфекции
Оппортунистические инфекции  Всемирный день борьбы со СПИДом
Всемирный день борьбы со СПИДом Доказательная медицина и стандарты медицинской деятельности
Доказательная медицина и стандарты медицинской деятельности Система счетов и двойная запись
Система счетов и двойная запись Презентация на тему Лепка из пластилина
Презентация на тему Лепка из пластилина  Ночевала тучка золотая
Ночевала тучка золотая Revision
Revision Материально-производственная деятельность человека.
Материально-производственная деятельность человека. Как помочь ребёнку быть внимательным.
Как помочь ребёнку быть внимательным. Защитники земли русской. Работы учеников
Защитники земли русской. Работы учеников Презентация на тему ПОЛИТИЧЕСКИЙ ПРОГНОЗ: сущность, научные основы и принципы
Презентация на тему ПОЛИТИЧЕСКИЙ ПРОГНОЗ: сущность, научные основы и принципы  Словообразование (6 класс)
Словообразование (6 класс) 1 сентября. Классный час «От пера до компьютера».
1 сентября. Классный час «От пера до компьютера». Грамматические особенности перевода арабских фильмов на русский язык
Грамматические особенности перевода арабских фильмов на русский язык 1.3.2 Логические элементы ЭВМ
1.3.2 Логические элементы ЭВМ HTML
HTML Психологический климат в трудовом коллективе
Психологический климат в трудовом коллективе НОУ СОШ Гармония
НОУ СОШ Гармония Китайско-конфуцианская цивилизация
Китайско-конфуцианская цивилизация Каракули. Упражнение 2
Каракули. Упражнение 2 Презентация на тему Треугольники 7 класс геометрия
Презентация на тему Треугольники 7 класс геометрия  Moral Crisis in south Africa
Moral Crisis in south Africa Промоагентство
Промоагентство Презентация на тему Проблема темперамента и характера
Презентация на тему Проблема темперамента и характера Мой творческий путь в прозе и стихах
Мой творческий путь в прозе и стихах ПРОГРАММА«ТРИ ШАГА К УНИКАЛЬНОМУ СЕРВИСУ»GLOBAL SOLUTIONS Ltd.
ПРОГРАММА«ТРИ ШАГА К УНИКАЛЬНОМУ СЕРВИСУ»GLOBAL SOLUTIONS Ltd. Политические режимы. Типы политических режимов
Политические режимы. Типы политических режимов