Содержание
- 2. Она изучает только равновесные состояния тел, §§ Введение 02 Термодинамика или общая теория теплоты, изучает общие
- 3. 03 Молекулярная физика изучает строение и свойства вещества, исходя из атомно-молекулярного представления (статистический подход) и рассматривает
- 4. При нормальных условиях 1) В 1 см3 воздуха содержится 27 000 000 000 000 000 000
- 5. §§ Термодинамическая система это совокупность макроскопических тел, обменивающихся энергией между собой и с другими телами Физические
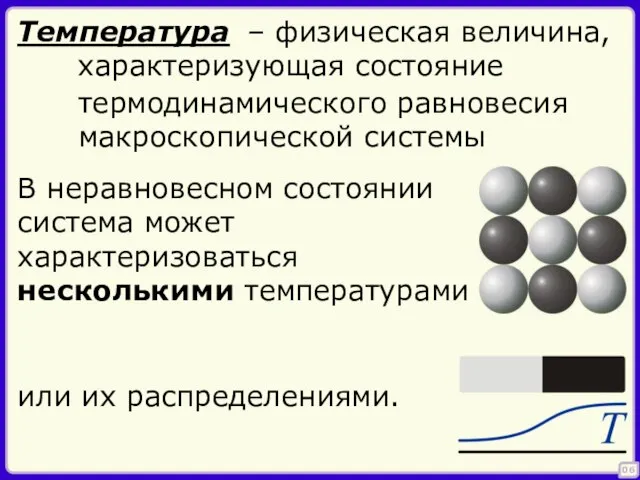
- 6. – физическая величина, характеризующая состояние 06 Температура термодинамического равновесия макроскопической системы В неравновесном состоянии система может
- 7. 07 Давление равная отношению силы, действующей по нормали на некоторую площадку – физическая величина, к величине
- 8. §§ Уравнение состояния 08 Состояние некоторой массы газа определяется тремя ТД параметрами: p – давление, V
- 9. §§ Идеальный газ 09 это модель среды (как с.м.т. или а.т.т.), определяемая положениями: 1) суммарный объем
- 10. а также при низком давлении и при высокой температуре, 10 Нормальные условия P = 1 атм
- 11. 11 Уравнение Менделеева–Клапейрона – число молей газа M – молярная масса газа, кг/моль m – масса
- 12. 12 – концентрация молекул, м–3 kB = 1,38∙10–23 Дж/К – постоянная Больцмана Замечание Уравнение Менделеева–Клапейрона оказывается
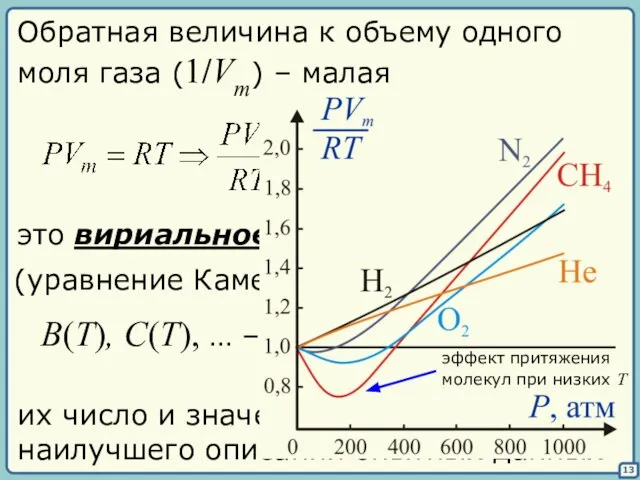
- 13. 13 Обратная величина к объему одного моля газа (1/Vm) – малая это вириальное уравнение состояния (уравнение
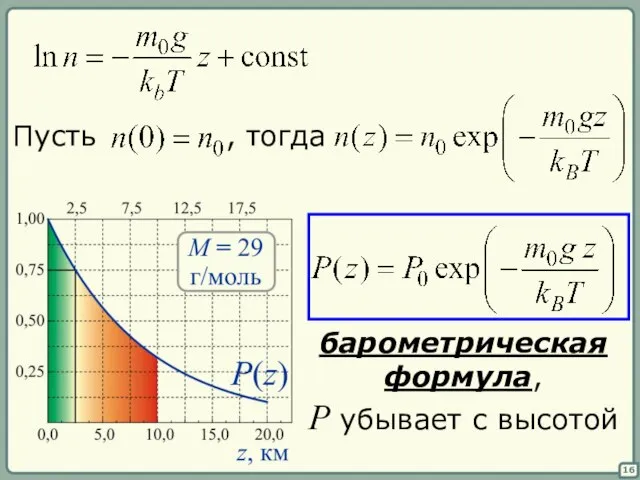
- 14. §§ Барометрическая формула 14 Если на газ в сосуде действует сила, то концентрация молекул установится в
- 15. 15 Пусть вычислим интеграл от обеих частей
- 16. 16 барометрическая формула, P убывает с высотой
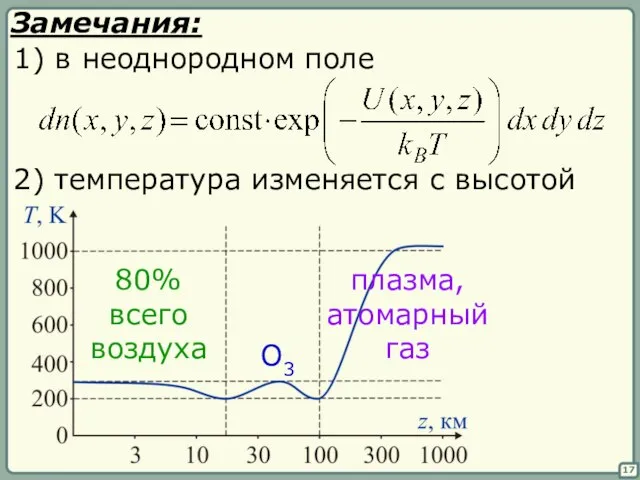
- 17. 17 Замечания: 1) в неоднородном поле 2) температура изменяется с высотой 80% всего воздуха плазма, атомарный
- 18. §§ Учет объема молекул 18 На очень малых расстояниях между молекулами действуют силы отталкивания N –
- 19. 19 Основное уравнение МКТ: или Пусть b – минимальный объем 1 моля (объемная поправка) тогда –
- 20. 20 Величина b обычно принимает значения 15–60 см3/моль При увеличении температуры b уменьшается вместе с радиусом
- 21. §§ Внутреннее давление 21 На больших расстояниях между молекулами действуют силы притяжения В центре – практически
- 22. 22 Пусть x – расстояние от стенки сосуда, U(x) – потенциальная энергия молекулы согласно распределению Больцмана
- 23. 23 Концентрация молекул возле стенки V – объем сосуда Тогда Сила, действующая на пристеночную молекулу пропорциональна
- 24. 24 a – константа для данного газа – уравнение Дитеричи ≈
- 25. 25 – уравнение Ван-дер-Ваальса
- 26. 26 P – давление газа на стенку сосуда – внутреннее давление – давление газа при исчезновении
- 27. §§ Изобары реального газа 27 Каждый реальный газ представляет собой ненасыщенный (перегретый) пар, т.е. при соответствующем
- 28. 28 А: жидкость, T = 273 K A-B: расширение жидкости при нагревании При дальнейшем подведении тепла
- 29. 29 C: T = 373 K В сосуде – жидкость и влажный пар (содержит капельки жидкости,
- 30. – фазовые переходы I-го рода, сопровождающиеся поглощением или выделением теплоты, 30 Кипение и конденсация изменением состояния
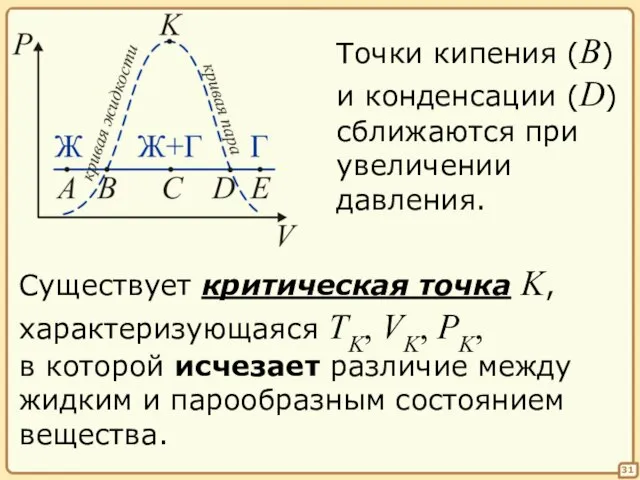
- 31. 31 Точки кипения (B) и конденсации (D) сближаются при увеличении давления. Существует критическая точка K, характеризующаяся
- 32. §§ Изотермы реального газа 32 Рассмотрим диаграмму Эндрюса – семейство реальных изотерм. Штриховка – область жидкой
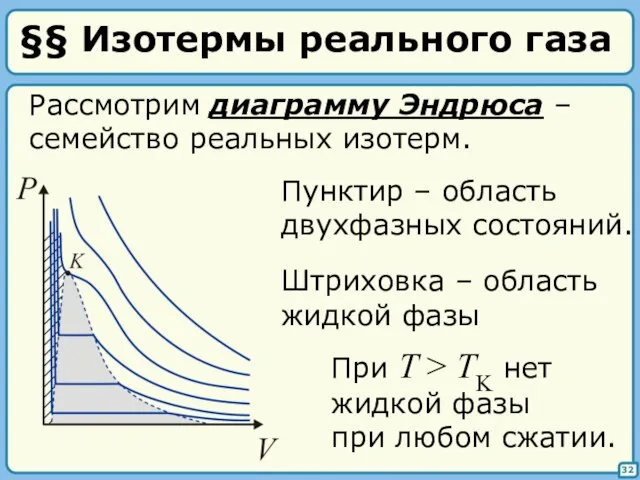
- 33. 33 1-2-3 – переход пар-жидкость, минуя двухфазную область. Участок BD – область фазового перехода (P,T =
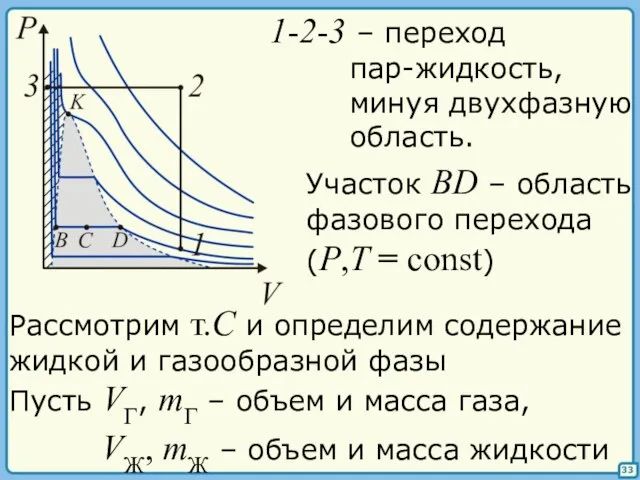
- 34. 34 VГ VЖ Тогда (т.к. эта функция должна быть линейной и в крайних точках совпадать с
- 35. §§ Изотермы Ван-дер-Ваальса 35 Рассмотрим уравнение состояния – функция, определяющая вид изотерм
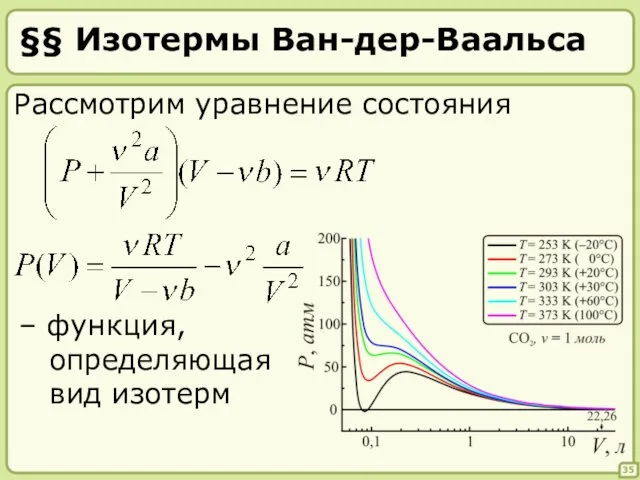
- 36. 36 §§ Об уравнениях состояния Для описания состояния газа в широком интервале P, V, T необходимо
- 37. 37 Уравнение ВДВ хорошо описывает состояние газа при низком давлении и T > TK Для сжатых
- 38. §§ Степени свободы молекулы 38 Число независимых координат, полностью определяющих положение тела в пространстве, называется числом
- 39. 39 колебательные степени свободы Поскольку положения N атомов в молекуле определяют 3N координат, то iкол =
- 40. 40 гипотеза Больцмана (з-н Максвелла) в т.с., находящейся в состоянии равновесия, на каждую поступательную и вращательную
- 41. 41 Пример: одноатомная молекула (только поступ. движение) Пример: двухатомная молекула с жесткой связью – вращением относительно
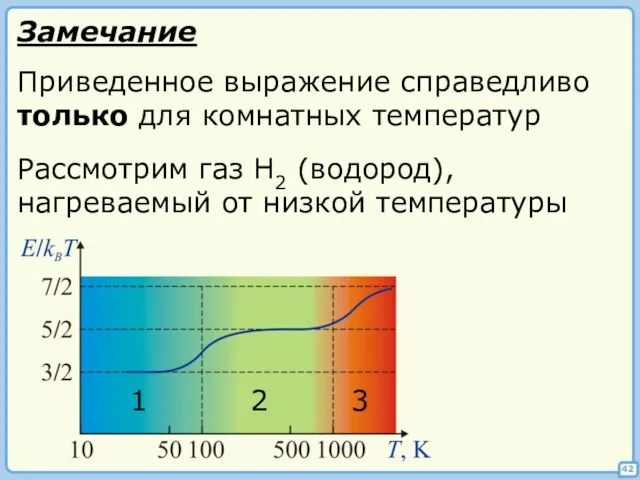
- 42. 42 Приведенное выражение справедливо только для комнатных температур Рассмотрим газ H2 (водород), нагреваемый от низкой температуры
- 43. 1) Для молекулы, состоящей из любого числа атомов, i = 3. Для возбуждения вращательной степени свободы
- 44. §§ Средняя скорость молекул 46 Средняя кинетическая энергия молекулы Средняя квадратичная скорость Средняя арифметическая скорость
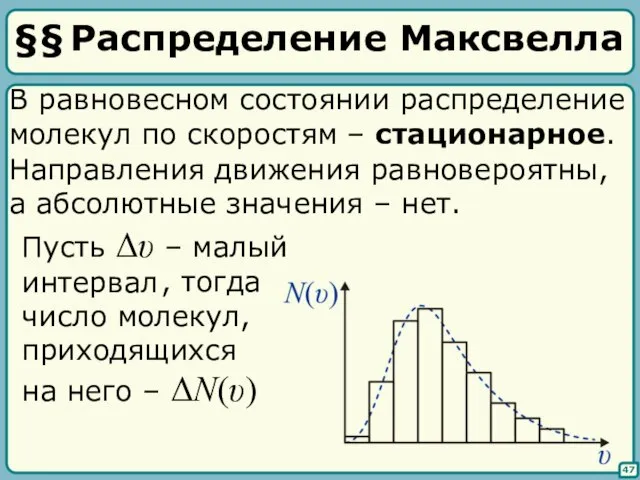
- 45. §§ Распределение Максвелла 47 В равновесном состоянии распределение молекул по скоростям – стационарное. Направления движения равновероятны,
- 46. 48 – функция распределения молекул по скоростям – функция распределения Максвелла
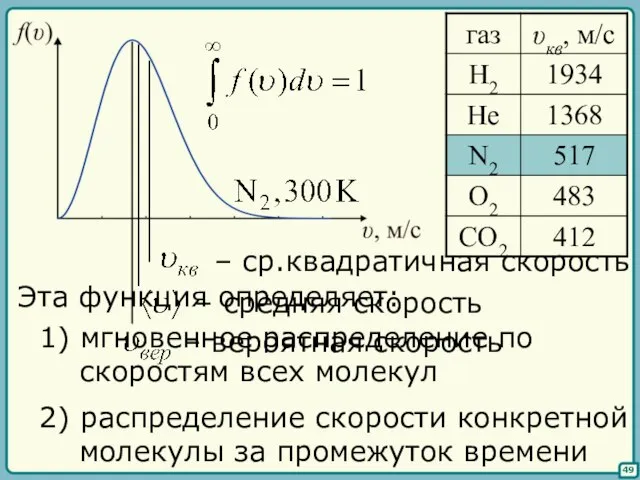
- 47. 49 Эта функция определяет: 1) мгновенное распределение по скоростям всех молекул 2) распределение скорости конкретной молекулы
- 48. (плотность вероятности) иметь молекуле данную скорость 50 Вычислим наиболее вероятную скорость Вычислим среднюю скорость. Учтем, что
- 49. 51 Тогда
- 50. 52 вероятная скорость: средняя скорость: ср. квадратичная: Замечание Если в сосуде несколько сортов молекул, то в
- 51. §§ Понятие температуры 53 Распределение молекул по скоростям у разряженного газа, находящегося при высокой температуре описывается
- 52. 54 В этой области часть реальных газов имеет распределение Ферми (кин. энергия у молекул остается и
- 53. 55 Понятие температуры сейчас не имеет наглядного молекулярно-кинетического представления. До создания квантовой теории, понятие температуры было
- 54. §§ Длина свободного пробега , n – концентрация 44 Пусть z – число соударений за время
- 56. Скачать презентацию










































 Образование Кармановское сельское поселение Гагаринского района Смоленской области
Образование Кармановское сельское поселение Гагаринского района Смоленской области Герои любимых сказок
Герои любимых сказок Летний пейзаж
Летний пейзаж Публичная презентация результатов педагогической деятельности Дубовой Людмилы Ивановны Тема: «Профильное обучение – важное ус
Публичная презентация результатов педагогической деятельности Дубовой Людмилы Ивановны Тема: «Профильное обучение – важное ус Что такое «Красная книга» 2 класс
Что такое «Красная книга» 2 класс Поэт, драматург, ученый-полиглот, музыкант, дипломат Александр Сергеевич Грибоедов.
Поэт, драматург, ученый-полиглот, музыкант, дипломат Александр Сергеевич Грибоедов. American Political System
American Political System  Природные источники углеводородов.
Природные источники углеводородов. Резьбы
Резьбы Мастер-класс Фотолаборатория + Лица Галактики
Мастер-класс Фотолаборатория + Лица Галактики Педагогическая лаборатория
Педагогическая лаборатория Гран-Транс-Авир
Гран-Транс-Авир БИОЛОГИЧЕСКИЕ РИТМЫ
БИОЛОГИЧЕСКИЕ РИТМЫ Поверхностно-активные вещества
Поверхностно-активные вещества Рекомендации по написанию основной общеобразовательной программы дошкольного образовательного учреждения
Рекомендации по написанию основной общеобразовательной программы дошкольного образовательного учреждения Корпоративный университет Homo Conscious. Тренинг по дипломной работе
Корпоративный университет Homo Conscious. Тренинг по дипломной работе Как представить свою школу в сети Интернет?
Как представить свою школу в сети Интернет? Начальная (максимальная) цена контракта, цена контракта, заключаемого с единственным поставщиком (подрядчиком, исполнителем)
Начальная (максимальная) цена контракта, цена контракта, заключаемого с единственным поставщиком (подрядчиком, исполнителем) «Интерьер кухни. Размещение Кухонного оборудования. Благоустройство кухни.»
«Интерьер кухни. Размещение Кухонного оборудования. Благоустройство кухни.» Семья и проблемы семейной политики
Семья и проблемы семейной политики Жить не по лжи
Жить не по лжи Лекция_7 ЭТД ФТД.ppt
Лекция_7 ЭТД ФТД.ppt Бизнес-Центр класса В+ «MAGISTRAL PLAZA» 1-ый Магистральный тупик, д.5
Бизнес-Центр класса В+ «MAGISTRAL PLAZA» 1-ый Магистральный тупик, д.5 Вулкан 8 класс
Вулкан 8 класс Презентация на тему Фразеологизмы - меткие изречения русского народа
Презентация на тему Фразеологизмы - меткие изречения русского народа Популяризация русского языка
Популяризация русского языка Муниципальное общеобразовательное учреждение средняя общеобразовательная школа №38 ( МОУ СОШ №38) г. Шахты Ростовской области
Муниципальное общеобразовательное учреждение средняя общеобразовательная школа №38 ( МОУ СОШ №38) г. Шахты Ростовской области Кременчуцький національний університет імені Михайла Остроградського
Кременчуцький національний університет імені Михайла Остроградського