Содержание
- 2. 1. Генетическая система координат. Строение оператора и промотора Методами молекулярной биологии в 70 х годах была
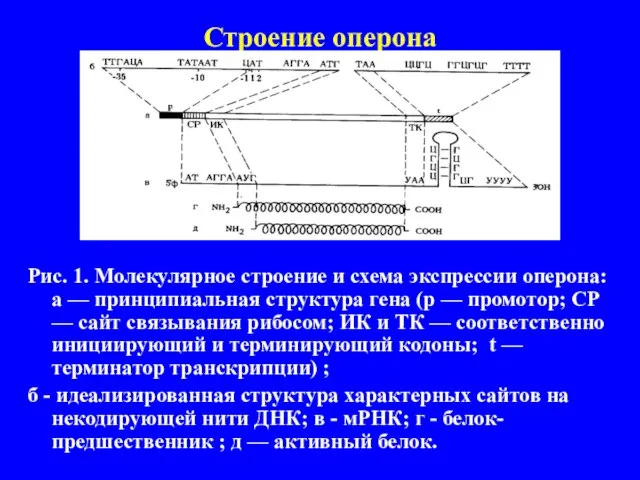
- 3. Строение оперона Рис. 1. Молекулярное строение и схема экспрессии оперона: а — принципиальная структура гена (р
- 4. На рисунке 1 использована принятая в молекулярной гене-тике система координат, в которой нуклеотиды нумеруются от границы
- 5. В состав промоторов всех изученных оперонов входят два участка с относительно постоянным составом и последовательностью нуклеотидов
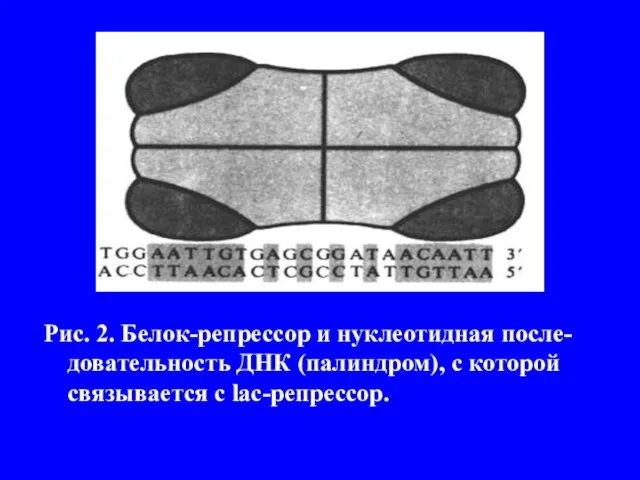
- 6. Последовательность нуклеотидов оператора (область ДНК от +1 до +24). лактозного оперона (Lac-оперона) образует симметричный палиндром (рис.
- 7. Рис. 2. Белок-репрессор и нуклеотидная после-довательность ДНК (палиндром), с которой связывается с lac-репрессор.
- 8. 2. Структура транскрибируемой области оперона. Терминация транскрипции. Результат транскрипции Транскрибируемая область оперона включает не только опе-ратор
- 9. Примерно с 37-го нуклеотида начинается ДНК первого структурного гена. Первый триплет (кодон в мРНК) называется инициирующим
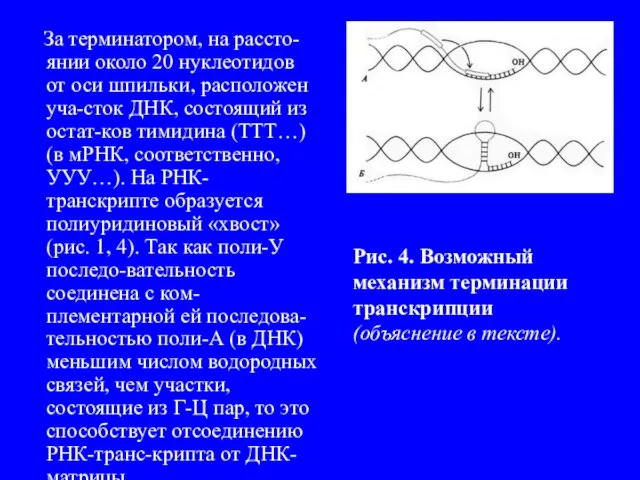
- 10. Предполагается, что образование шпилек в синтезированной моле-куле мРНК способствует её отсо-единению от ДНК-матрицы. Движение РНК-полимеразы по
- 11. За терминатором, на рассто-янии около 20 нуклеотидов от оси шпильки, расположен уча-сток ДНК, состоящий из остат-ков
- 12. На рис. 5 показана схема экспрессии лактозного оперона E.coli. Образовавша-яся в ходе транс-крипции полигенная (полицистронная) молекула
- 13. Трансляция мРНК начинается с посадки рибосом на мРНК, которая осуществляется благодаря комплементарности 3’–конца 16S рибосомной РНК
- 14. 3. Регулоны и аттенюаторы В ДНК бактерий существует и другой тип организа-ции генов. Некоторые группы структурных
- 15. Аттенюатор – это нуклеотидная последовательность с инвертированными повторами, расположенная между промотором и первым геном оперона. Вторичная
- 16. 4. Молекулярный механизм работы белка-репрессора Молекула активного Lac-репрессора это тетрамер, постро-енный из четырёх одинаковых полипептидных цепей
- 17. Удивительна точность, с которой молекула репрессора «опознаёт» операторный участок. Длина молекулы ДНК E. coli составляет 3,2
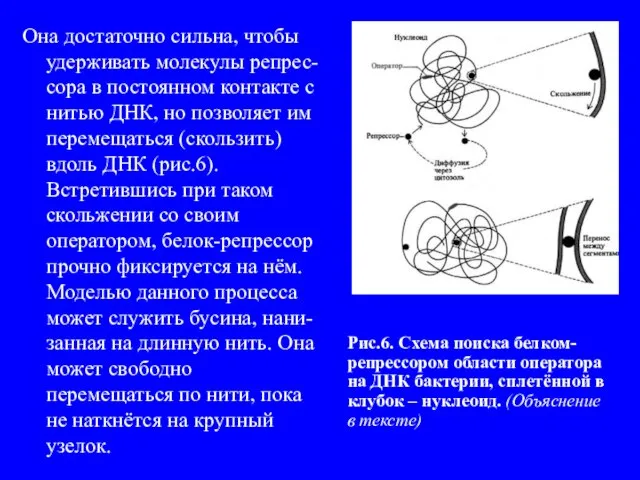
- 18. Она достаточно сильна, чтобы удерживать молекулы репрес-сора в постоянном контакте с нитью ДНК, но позволяет им
- 19. Поиск оператора молекулами репрессора облегчается благодаря особенностям строения как самого репрессора, так и операторного участка ДНК.
- 21. Скачать презентацию














 Паспорт объекта сети Харьковская региональная дирекция
Паспорт объекта сети Харьковская региональная дирекция Презентация на тему Средства для борьбы с насекомыми
Презентация на тему Средства для борьбы с насекомыми Задачи и методы современной психологии
Задачи и методы современной психологии Подходы к моделированию ГРА
Подходы к моделированию ГРА Технология продуктивного чтения или формирование типа правильной читательской деятельности
Технология продуктивного чтения или формирование типа правильной читательской деятельности Заработать в интернете без вложений и без продаж
Заработать в интернете без вложений и без продаж Понятие стратегического менеджмента
Понятие стратегического менеджмента Ультразвуковой уровнемер на микроконтроллере PIC16F628
Ультразвуковой уровнемер на микроконтроллере PIC16F628 Роза из бумаги
Роза из бумаги ОАО «Противокарстовая и береговая защита» 606019, Нижегородская обл., г.Дзержинск, ул.Гастелло, 10/15 Тел./факс (8313) 25-98-01 E-mail:
ОАО «Противокарстовая и береговая защита» 606019, Нижегородская обл., г.Дзержинск, ул.Гастелло, 10/15 Тел./факс (8313) 25-98-01 E-mail:  Готовимся к части С
Готовимся к части С EBG Customer Training Map
EBG Customer Training Map Виды и назначение технологических карт
Виды и назначение технологических карт Учредитель: Администрация Городского округа «Город Волжск». Адрес:425000, ул. Коммунистическая, д.1.
Учредитель: Администрация Городского округа «Город Волжск». Адрес:425000, ул. Коммунистическая, д.1. Презентация на тему Русь и Золотая Орда (6 класс)
Презентация на тему Русь и Золотая Орда (6 класс) Анализ системы подготовки и аттестации кадров предприятия туризма. Задание 5
Анализ системы подготовки и аттестации кадров предприятия туризма. Задание 5 Нетрадиционная техника рисования граттаж Праздничный салют
Нетрадиционная техника рисования граттаж Праздничный салют сочинение
сочинение Проект « Профессии наших родителей»
Проект « Профессии наших родителей» Натюрморт
Натюрморт Ц у н а м и
Ц у н а м и Публичная презентация результатов педагогической деятельностии инновационной работыучителя начальных классов МКОУ «Лицей се
Публичная презентация результатов педагогической деятельностии инновационной работыучителя начальных классов МКОУ «Лицей се Психологический климат в семье (8 класс)
Психологический климат в семье (8 класс) Игры с залом PowerPoint
Игры с залом PowerPoint Кулинарный поединок
Кулинарный поединок Food rap
Food rap ЗУП КОРП: реализованная функциональность и выпуск конфигурации Докладчик: Лохтин Т.О.
ЗУП КОРП: реализованная функциональность и выпуск конфигурации Докладчик: Лохтин Т.О. Правила судейства игры Баскетбол
Правила судейства игры Баскетбол