Содержание
- 2. Третичная структура ДНК: Начальный элемент упаковки – нуклеосома: сердцевину ее составляет октамер, состоящий из 4 димерных
- 3. Нуклеиновые кислоты и белки называют информационными молекулами, так как в чередовании их мономеров заложен определенный смысл.
- 4. Генетический код - это система записи информации о последовательности расположения аминокислот в белках с помощью последовательности
- 5. РЕПЛИКАЦИЯ – процесс удвоения ДНК, суть которого состоит в образовании идентичных копий ДНК для передачи генетической
- 6. 1 - топоизомераза (гираза) - обратимая нуклеаза, сначала она разрывает цепь ДНК, а по окончании репликации
- 7. В настоящее время процесс репликации у прокариот достаточно изучен, в то время как многие аспекты эукариотической
- 8. Движение хеликазы усиливает скрученность (супер-спирализацию) впереди нее. Убирают образующиеся супервитки ферменты топоизомеразы. Они разрывают фосфатную перемычку
- 9. 3. Терминация. Заканчивается репликация тогда, когда вся матричная ДНК скопирована. В образованной таким образом двойной спирали
- 10. «Молекулярные часы клетки» - теломеры Особенность репликации линейных молекул эукариот связана со сложностью репликации концевых участков
- 11. РЕПАРАЦИЯ ПОВРЕЖДЕНИЙ И ОШИБОК ДНК Передача генетической информации в неискаженном виде - важнейшее условие сохранения вида.
- 12. Генные мутации Изменения генетической программы ДНК клеток называются мутациями. Различают хромосомные мутации (изменение числа хромосом, хромосомные
- 13. МОЛЕКУЛЯРНЫЕ ОСНОВЫ ТРАНСКРИПЦИИ Транскрипция - это синтез всех видов РНК по матрице ДНК, осуществляемый ферментом ДНК-зависимой
- 14. РНК синтезируется комплементарно и антипараллельно транскрибируемой цепи ДНК. Рост цепи РНК идет только в направлении 5'
- 15. РНК-полимераза узнает промотор, покрывая 40-60 пар нуклеотидов. В промоторе узнается взаимное расположение двух AT-богатых участков. В
- 16. Цистрон - последовательность нуклеотидов ДНК, кодирующая один полипептид (в большинстве случаев - белок) или одну tРНК,
- 17. На всех этапах транскрипции необходимо участие специальных белковых факторов: А, В – факторов инициации, Е, Н,
- 18. На этом этапе действует ингибитор элонгации - стрептолидигин 3. Терминация У E.coli . большинство генов терминируются
- 19. У прокариот м-РНК синтезируется сразу в зрелом виде. У эукариот все первичные транскрипты , образующиеся с
- 20. Благодаря антикодону -триплету в средней части молекулы тРНК, комплементарному определенному кодону на мРНК, тРНК “читает” текст
- 21. Компоненты белоксинтезирующей системы: м-РНК - генетическая матрица - содержит линейную последовательность кодонов, определяющих первичную структуру белков
- 22. 1. ИНИЦИАЦИЯ ТРАНСЛЯЦИИ На рибосоме имеются два участка: П-сайт или пептидильный сайт, служащий для связывания с
- 23. 2. ЭЛОНГАЦИЯ ТРАНСЛЯЦИИ Элонгация - это рост полипептидной цепи от N-конца к С-концу, ступенчатое удлинение синтезируемой
- 24. Во время элонгации происходит важное событие - формирование пространственной структуры полипептидной цепи, от чего в значительной
- 25. 33 Регуляция синтеза белка Концентрация многих белков в клетке непостоянна и изменяется в зависимости от состояния
- 27. Скачать презентацию
Слайд 2 Третичная структура ДНК: Начальный элемент упаковки – нуклеосома: сердцевину ее составляет
Третичная структура ДНК: Начальный элемент упаковки – нуклеосома: сердцевину ее составляет
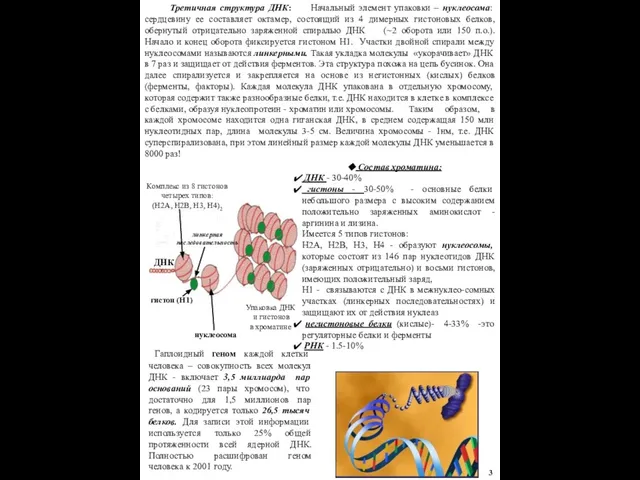
Гаплоидный геном каждой клетки человека – совокупность всех молекул ДНК - включает 3,5 миллиарда пар оснований (23 пары хромосом), что достаточно для 1,5 миллионов пар генов, а кодируется только 26,5 тысяч белков. Для записи этой информации используется только 25% общей протяженности всей ядерной ДНК. Полностью расшифрован геном человека к 2001 году.
3
Состав хроматина:
ДНК - 30-40%
гистоны - 30-50% - основные белки небольшого размера с высоким содержанием положительно заряженных аминокислот - аргинина и лизина.
Имеется 5 типов гистонов:
Н2А, Н2В, Н3, Н4 - образуют нуклеосомы, которые состоят из 146 пар нуклеотидов ДНК (заряженных отрицательно) и восьми гистонов, имеющих положительный заряд,
Н1 - связываются с ДНК в межнуклео-сомных участках (линкерных последовательностях) и защищают их от действия нуклеаз
негистоновые белки (кислые)- 4-33% -это регуляторные белки и ферменты
РНК - 1.5-10%
Слайд 3Нуклеиновые кислоты и белки называют информационными молекулами, так как в чередовании их
Нуклеиновые кислоты и белки называют информационными молекулами, так как в чередовании их

Функциональный потенциал ДНК
Функции ДНК двуедины:
1. Хранение наследственной информации и безошибочная ее передача при смене поколений. Это обеспечивается дублированием информации (репликации) каждой молекулы ДНК при делении клетки.
2. Передача генетической информации системам, строящим белковые молекулы. Она реализуется путем синтеза молекулы РНК, комплементарной участку одной из цепей ДНК. Этот участок – ген – несет информацию о структуре одной полипептидной цепи.
Обе функции основаны на том, что молекула ДНК служит матрицей: в первом случае
для репликации, во втором - для транскрипции.
4
Проект жизни вмещается в одной или нескольких молекулах ДНК, объединенных в понятие ГЕНОМ клетки или организма. Проект жизни переходит от поколения к поколению, для чего требуется точное копирование ДНК клетки. При этом ДНК распределяется между двумя дочерними клетками так, чтобы каждая получила точную копию всей информации о строении белковых молекул, специфичных для данного организма.
Поток генетической информации
(центральная догма молекулярной биологии)
Слайд 4 Генетический код - это система записи информации о последовательности расположения аминокислот в
Генетический код - это система записи информации о последовательности расположения аминокислот в

Свойства генетического кода
триплетность (43=64 кодона);
специфичность (один кодон кодирует одну аминокислоту);
вырожденность (одну аминокислоту могут кодировать несколько кодонов);
универсальность (характерен для всех живых организмов);
однонаправленность (текст читается только в направлении 5’ 3’);
непрерывность (отсутствуют знаки препинания);
неперекрываемость;
линейность
27
…ГГА ЦЦГ ГТА ААТ ТТГ ЦГА ГАЦ АТЦ ЦАТ ТАГ ГАТ ААГ…
…АТЦ ААТ ТЦГ ТАА АТТ ГАГ АЦА ТЦЦ АТТ АГГ АТА АГГ
…ААТ ТЦГ ТАА АТТ ТГЦ ГАГ АЦА ТЦЦ АТТ АГГ АТА АГГ…
фрагмент
ДНК
…УАУ ГЦУ УУА АГЦ АУУ УАЦ ЦУЦ УГУ АГГ УАУ УЦЦ УАА…
…-тир – ала – лей –сер –иле – тир – лей – цис – арг - тир – сер
фрагмент
мРНК
фрагмент
белка
транскрипция
трансляция
Слайд 5 РЕПЛИКАЦИЯ – процесс удвоения ДНК, суть которого состоит в образовании идентичных копий
РЕПЛИКАЦИЯ – процесс удвоения ДНК, суть которого состоит в образовании идентичных копий

Суммарное уравнение репликации:
n дАТФ ДНК-матрица дАМФn
n дГТФ ДНК дГМФn + (n+n+n+n) ФФ
n дЦТФ ДНК-полимеразы дЦМФn
n дТТФ дТМФn
Все процессы биосинтеза ДНК (полимеризация) катализируются ДНК-полимеразами,
в качестве матрицы (программы для чтения) они используют материнскую цепь ДНК;
в качестве субстратов (строительных блоков) они используют д-нуклеозидтрифосфаты (дАТФ, дГТФ, дЦТФ, дТТФ). Синтез каждой дочерней цепи ДНК идет комплементарно и антипараллельно матричной цепи и всегда в направлении
5‘ 3'. Каждый раз фермент отщепляет от дНТФ группу Ф~Ф и соединяет фосфатный конец дМНФ через 3’-ОН рибозы предыдущего нуклеотида. Быстрый гидролиз Ф~Ф завершает необратимость реакции.
Все ДНК-полимеразы нуждаются для своей работы в предварительно синтезированных олигонуклеотидах – РНК-затравках, 3’-ОН группа которых используется для удлинения цепи. Затравка называется РНК-праймером (до 10 нуклеотидов), синтезируются праймазой (ДНК-зависимой РНК-полимеразой).
Для репликации необходим ряд условий:
наличие дезоксирибонуклеотидтрифосфатов (дАТФ, дГТФ, дЦТФ. дТТФ) в качестве структурного материала при сборке новых цепей ДНК и в качестве источников энергии
расплетение двойной спирали ДНК и формирование репликативной вилки
образование “затравки” – РНК-праймера
наличие ферментов и специфических белков, участвующих в репликации (реплисомы)
наличие ионов магния, которые необходимы для действия всех полимераз
5
Слайд 6 1 - топоизомераза (гираза) - обратимая нуклеаза, сначала она разрывает цепь
1 - топоизомераза (гираза) - обратимая нуклеаза, сначала она разрывает цепь
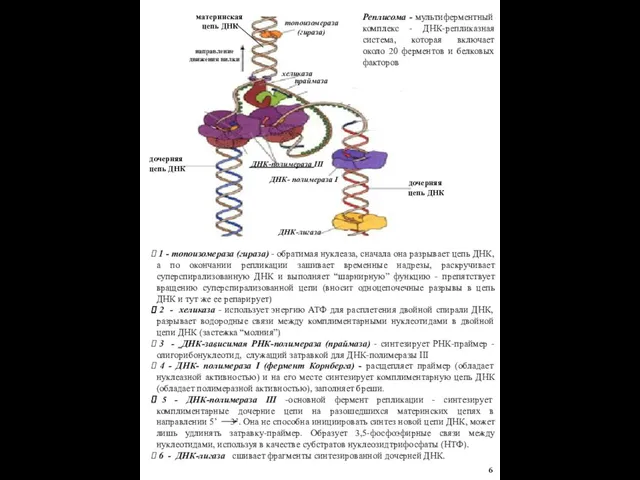
2 - хеликаза - использует энергию АТФ для расплетения двойной спирали ДНК, разрывает водородные связи между комплиментарными нуклеотидами в двойной цепи ДНК (застежка “молния”)
3 - ДНК-зависимая РНК-полимераза (праймаза) - синтезирует РНК-праймер - олигорибонуклеотид, служащий затравкой для ДНК-полимеразы III
4 - ДНК- полимераза I (фермент Корнберга) - расщепляет праймер (обладает нуклеазной активностью) и на его месте синтезирует комплиментарную цепь ДНК (обладает полимеразной активностью), заполняет бреши.
5 - ДНК-полимераза III -основной фермент репликации - синтезирует комплиментарные дочерние цепи на разошедшихся материнских цепях в направлении 5’ 3’. Она не способна инициировать синтез новой цепи ДНК, может лишь удлинять затравку-праймер. Образует 3,5-фосфоэфирные связи между нуклеотидами, используя в качестве субстратов нуклеозидтрифосфаты (НТФ).
6 - ДНК-лигаза сшивает фрагменты синтезированной дочерней ДНК.
6
Слайд 7 В настоящее время процесс репликации у прокариот достаточно изучен, в то время
В настоящее время процесс репликации у прокариот достаточно изучен, в то время

ЭТАПЫ РЕПЛИКАЦИИ
1. Инициация
Происходит в S-фазе клеточного цикла. Осуществляется путем локального разделения (плавления) полинуклеотидных цепей в области начала репликации ori (original–начало, англ.) со специфической последовательностью оснований, богатой А::::Т парами. К ней присоединяются особые белки, например хеликаза, которая расплетает двойную спираль, используя энергию АТФ. Образуется репликативный пузырь.
Другие белки - SSB-белки - связываются с одиночными цепями и препятствуют реставрации (обратному скручиванию) двойной спирали.
От точки начала репликации процесс расплетения продвигается вдоль ДНК в обе стороны. В каждой из них начальный участок, в котором ДНК разделяется на одиночные нити, называющиеся репликативной вилкой, где и располагается хеликаза, которая раскручивает двойную спираль со скоростью ~50 п.о. в секунду (у эукариот) или 50 тыс. – 100 тыс. п.о. в минуту (у прокариот).
Обе репликативные вилки, удаляясь друг от друга, проходят расстояние до таких же вилок, движущихся им навстречу от соседних точек ori. В молекуле ДНК эукариот более 1000 таких точек и все они «работают» одновременно, поэтому полная репликация генома человека осуществляется за 8-9 часов.
репликативная вилка
ori.
7
Слайд 8Движение хеликазы усиливает скрученность (супер-спирализацию) впереди нее. Убирают образующиеся супервитки ферменты топоизомеразы.
Движение хеликазы усиливает скрученность (супер-спирализацию) впереди нее. Убирают образующиеся супервитки ферменты топоизомеразы.

Как уже отмечалось, ДНК-полимеразы не могут соединять 2 первых нуклеотида, т.е. инициировать синтез, они могут только удлинять цепь. Поэтому в начале белок DnaG (праймаза) присоединяется к открытым цепям ДНК в области ori и катализирует синтез затравки – праймера (10-12 нуклеотидов РНК, присоединенные по принципу комплиментарности). Праймаза образует связи 3’ – 5’. Синтез происходит в направлении 5’ 3’.
После завершения синтеза праймера дальнейший рост осуществляет основной фермент репликации - ДНК-полимераза III.
2. Элонгация
Репликация на двух антипараллельных цепях происходит одновременно.
На одной цепи ДНК синтез дочерней идет непрерывно в направлении 5’ 3’ от участка ori по мере раскручивания и продвижения вилки (такая дочерняя цепь называется лидирующей цепью).
На второй цепи синтез дочерней идет в направлении, обратном движению вилки. Создание этой дочерней нити (отстающей, запаздывающей), начинается в виде отдельных отрезков (100-200 нуклеотидов) – фрагментов Оказаки (названы по имени японского ученого Р. Оказаки). Каждый из них начинается от своего праймера и продолжается (почти) до достижения праймера предыдущего фрагмента Оказаки.
Как лидирующая цепь, так и отстающая, (из фрагментов Оказаки) синтезируются ДНК-полимеразой III. Кроме полимеразной активности, все ДНК-полимеразы обладают и 3’,5’-экзонуклеазной активностью, т.е. могут гидролизировать связь и удалять нуклетиды с 3’-концов (в направлении «назад»), что позволяет этим ферментам проверять и устранять свои ошибки.
У полимераз I и III есть и 5’3’ экзонуклеазная активность, что позволяет им участвовать в репарации.
Та же активность позволяет ДНК-полимеразе I удалять праймер, постепенно отрезая от 5’-конца по одному рибонуклеотиду, а к 3’-концу фрагмента присоединяя дезоксирибонуклеотиды, используя свою полимеразную активность. Промежутки, которые возникают 3’-ОН и 5’-фосфатом, сшивают ДНК-лигазы, используя энергию АТФ.
8
Слайд 93. Терминация.
Заканчивается репликация тогда, когда вся матричная ДНК скопирована. В образованной
3. Терминация.
Заканчивается репликация тогда, когда вся матричная ДНК скопирована. В образованной

Редактирующая активность ДНК-полимеразы III
Если к растущей цепи добавился неправильный нуклеотид, он немедленно удаляется еще до завершения синтеза. При образовании неправильной пары резко ухудшается кинетика процесса, скорость движения фермента падает, в результате активируется другой центр ДНК-полимеразы III, который гидролизует (удаляет) последний ошибочный нуклеотид (фермент как бы «оглядывается» и исправляет свою ошибку!)
Ошибки возникают с частотой примерно одна на миллион
Редактирующая активность фермента понижает частоту ошибок в ~100 раз.
Принципы репликации:
комплементарность
антипараллельность
униполярность
потребность в затравке
прерывистость
полуконсервативность
9
Слайд 10«Молекулярные часы клетки» - теломеры
Особенность репликации линейных молекул эукариот связана со сложностью
«Молекулярные часы клетки» - теломеры
Особенность репликации линейных молекул эукариот связана со сложностью

Считается, что существуют «молекулярные часы», определяющие продолжительность жизни соматических клеток. Обнаружено, что концы линейных хромосом защищены специальными последовательностями TTGGGG, которые повторяются тысячи раз. Они называются теломерами. Без них хромосомы начинают сливаться с большой частотой, что вызывает генетические нарушения.
Наличие на концах хромосом специальной теломерной ДНК позволяет решить и проблему концевой недорепликации.
Соматические клетки теряют от 50 до 200 п.о. при каждом делении клетки, что является основой молекулярного механизма, определяющего продолжительность жизни клетки.
«Бессмертные клетки» (бесконечно пролиферирующие) содержат фермент теломеразу, которая достраивает свободные 3’ концы хромосом короткими повторяющимися последовательностями – теломерами. Теломераза содержит собственную РНК-матрицу, поэтому она относится к обратным транскриптазам. Используя эту матрицу, теломераза удлиняет молекулу ДНК, которая затем реплицируется с помощью ДНК- полимеразы.
В большинстве клеток теломераза заблокирована, она активна в стволовых и половых клетках.
В каждом цикле деления полимеры клетки укорачиваются из-за «недорепликации» - важнейшего фактора биологического строения. Теломера укорачивается медленно: по 3-6-нуклеотидов за клеточный цикл. Но эта эрозия может ускоряться в сотни раз рекомбинаций в их ДНК.
Предполагается, что ингибиторы обратных транскриптаз (азидотимидин, карбовир), могут подавлять работу теломеразы в клетке, вызывая процесс, похожий на старение клеток in vitro, что проявляется прекращением пролиферации и специфическом изменении морфологии клеток.
10
Слайд 11РЕПАРАЦИЯ ПОВРЕЖДЕНИЙ И ОШИБОК ДНК
Передача генетической информации в неискаженном виде - важнейшее
РЕПАРАЦИЯ ПОВРЕЖДЕНИЙ И ОШИБОК ДНК
Передача генетической информации в неискаженном виде - важнейшее

Cуществует специальная система мониторинга точности спаривания нуклеотидов, причем осуществляется двойная проверка:
- при включении ДРН в растущую цепь;
- после включения ДРН путем удаления ошибочных нуклеотидов (ошибки происходят не чаще, чем 1 раз на 10 пар оснований).
Причины индуцированных нарушений
алкилирование азотистых оснований (алкилирующие агенты применяются как ингибиторы новообразований)
образование сшивок - пиримидиновых димеров между соседними основаниями (тимином) под действием УФ-облучения
Репарация – удаление поврежденных участков ДНК или ошибочно встроенных нуклеотидов. Ключевой частью всех репаративных систем является распознавание дефекта в структуре ДНК, который или сразу восстанавливается, или маркируется специальными белками.
Этапы репарации:
1) узнавание места повреждения и раскручивание участка ДНК в области повреждения
2) однонитевой разрыв ДНК с 5 –конца на расстоянии около 20 п.о. от места повреждения УФ-специфической эндонуклеазой
3) достройка (“латка”) поврежденной цепи с помощью ДНК-полимеразы 1 4) отщепление поврежденного участка за счет экзонуклеазной активности ДНК-полимеразы I 5) сшивание 3-конца латки с 5-концом основной цепи ДНК-лигазой
11
Слайд 12
Генные мутации
Изменения генетической программы ДНК клеток называются мутациями. Различают хромосомные мутации (изменение
Генные мутации
Изменения генетической программы ДНК клеток называются мутациями. Различают хромосомные мутации (изменение

Генные мутации - это наследуемые изменения первичной структуры ДНК, которые ведут либо к прекращению синтеза белка, либо к синтезу измененного, дефектного белка.
Мутации в регуляторных участках оперона ведут к нарушению регуляции или прекращению синтеза ДНК.
Существуют следующие варианты генных мутаций:
Транзиция - замена пар оснований
Миссенс-мутация - приводит к изменению смысла кодона при замене нуклеотида, а, значит, к синтезу измененного белка. Например, серповидно-клеточная анемия: кодон, отвечающий за включение глу в цепь гемоглобина, превращается в кодон вал.
Замена одного нуклеотида не всегда ведет к изменению смысла кодона (т.к. код вырожденный) - такое изменение ДНК фенотипически не проявляется.
Нонсенс-мутация - в результате замены образуется один из терминирующих кодонов, при этом синтез белка прекращается и образуется незавершенный белок.
Делеция - выпадение одной пары или групп оснований
Вставка одной пары или групп оснований. Эти мутации могут быть как с изменением рамки считывания (выпадение или вставка одного или двух нуклеотидов), что ведет к синтезу бессмысленного белка, так и без изменения рамки считывания (три нуклеотида) - синтезируется белок, укороченный на 1 аминокислоту.
Изменение местоположения отдельных участков ДНК.
В клетке действует несколько систем репарации, позволяющих сохранить генетическую информацию. Нарушение работы таких систем приводит к заболеваниям, например, к пигментной ксеродермии – аутосомно-рецессивному наследственному заболеванию. Существует две основные клинические формы проявления этого заболевания: одна сопровождается дегенеративными изменениями в глазах и коже, а другая, кроме того, характеризуется неврологической дегенерацией. Тяжелым осложнением этого заболевания является рак кожи. Причины развития пигментной ксеродермии связывают с дефектами ферментов репарации тиминовых димеров (в частности, нарушение синтеза УФ-специфичной эндонуклеазы).
12
Слайд 13МОЛЕКУЛЯРНЫЕ ОСНОВЫ ТРАНСКРИПЦИИ
Транскрипция - это синтез всех видов РНК по матрице ДНК,
МОЛЕКУЛЯРНЫЕ ОСНОВЫ ТРАНСКРИПЦИИ
Транскрипция - это синтез всех видов РНК по матрице ДНК,

Молекула ДНК, хранящая генетическую информацию, непосредственного участия в синтезе белка не принимает. Возможно лишь снятие с нее копий, которые отправляются в цитоплазму, доставляя генетическую информацию к рибосомам – месту биосинтеза белка.
Каждая такая копия – послание (message, англ.) – представляет собой м-РНК. Таким образом, информация, записанная в последовательности нуклеотидов ДНК копируются (транскрибируются) в виде м-РНК с последующей трансляцией в полипептидную цепь белка. Транскрипция – это первый этап в экспрессии генов.
Суммарное уравнение транскрипции:
kАТФ ДНК-матрица АМФk
l ГТФ РНК ГМФl + (k+l+n+m) ФФ
n ЦТФ РНК-полимеразы ЦМФn
mУТФ УМФm
Осуществляется транскрипция с помощью ДНК-зависимых РНК-полимераз, для работы которых необходимы: матрица – двуцепочечная ДНК, субстраты - АТФ, ГТФ, УТФ, ЦТФ (они же используются как источники энергии), ионы магния.
Эукариотические клетки обычно содержат 3 типа РНК-полимераз:
РНК-полимераза I катализирует синтез рибосомальной (рРНК);
РНК-полимераза II катализирует синтез пре-мРНК - ингибируется токсином бледной поганки α-аманитином;
РНК-полимераза III катализирует синтез трпнспортной (тРНК).
У прокариот РНК-полимераза состоит из 4 субъединиц, образующих кор-фермент (“сердцевина”), к которому присоединяется дополнительный белковый σ-фактор, способствующий более прочному связыванию фермента со специфической промоторной последовательностью на матрице ДНК.
21
Слайд 14РНК синтезируется комплементарно и антипараллельно транскрибируемой цепи ДНК. Рост цепи РНК идет
РНК синтезируется комплементарно и антипараллельно транскрибируемой цепи ДНК. Рост цепи РНК идет

Принципы транскрипции:
комплементарность.
антипараллельность.
униполярность.
беззатравочность.
асимметричность.
Промотор - участок оперона, служащий для узнавания ферментом РНК-полимеразой. Последовательность оснований по ходу цепи ДНК ниже сайта промотора с направлением 3’ 5’ используется в качестве матрицы для синтеза РНК.
Промоторы прокариот –представляют собой последовательность, состоящую из ~40 нуклеотидов. Узнавание и прочное связывание с РНК-полимеразой происходит на разных участках ДНК. Эти участки отличаются и по первичной, и по вторичной структуре. Путем секвенирования выявили структуру многих промоторов. У большинства из них имеется общее свойство.
Структура оперона
21
Синтез РНК начинается в особых участках ДНК, называемых промоторами, а заканчиваются в терминаторах. Участок ДНК, ограниченный промотором и терминатором, называется транскриптон (эукариоты) или оперон (прокариоты). Он включает гены или структурные цистроны, которые несут информацию о структуре полипептидных цепей или нематричных РНК. Транскриптон может содержать один структурный ген или несколько.
Отличия ферментов транскрипции и репликации
РНК-полимераза не нуждается в праймере
РНК-полимераза сама расплетает материнскую цепь
РНК-полимераза не обладает нуклеазной активностью
РНК-полимераза перемещается по матрице значительно
медленнее, чем ДНК-полимераза
РНК-полимераз в клетке значительно больше, чем
ДНК-полимераз
Слайд 15РНК-полимераза узнает промотор, покрывая 40-60 пар нуклеотидов. В промоторе узнается взаимное расположение
РНК-полимераза узнает промотор, покрывая 40-60 пар нуклеотидов. В промоторе узнается взаимное расположение

Для связывания G-фактора РНК-полимеразы с ДНК (сайт инициации) служит « - 35 последовательность» из 6 нуклеотидов, а расплетение двух цепей ДНК происходит в «Pribnowbox», т.е. – «- 10 последовательности». В этих участках много пар А::::Т, между которыми только две водородные связи, поэтому цепи ДНК легко расходятся («плавятся»).
Промоторы эукариот содержат участки, которые не только указывают место начала транскрипции, но и базовую частоту этого процесса.
Большинство генов эукариот содержит в своем промоторном участке специфические
последовательности матричной ДНК, которые усиливают (энхансеры) или ослабляют
(сайленсеры) уровень экспрессии соответствующих структурных генов, влияя на
активность транскрипции, т.е. на количество синтезируемых молекул мРНК и на
скорость их образования.
22
Энхансеры могут повышать эффективность транскрипции генов, на которые они влияют, в десятки и сотни раз. Установлены нуклеотидные последовательности энхансеров для ряда ферментов (алкогольдегидрогеназы, химотрипсина), гормонов (инсулина), иммуноглобулинов.
Для транскрипции требуется не только РНК-полимераза, но и другие белки – основные факторы транскрипции. У эукариот таким фактором является ТАТА-связывающий белок, который взаимодействует с ТАТА-последовательностью (ТАТА-боксом). В этот комплекс встраивается РНК-полимераза и другие основные факторы транскрипции. Главная задача такого комплекса – «распаковать» нуклеосому, а кроме того создать условия сорбции специфических факторов транскрипции, которые могут активироваться после взаимодействия с определенными веществами, напрмер, гормонами.
Слайд 16Цистрон - последовательность нуклеотидов ДНК, кодирующая один полипептид (в большинстве случаев -
Цистрон - последовательность нуклеотидов ДНК, кодирующая один полипептид (в большинстве случаев -

В большинстве случаев цистроны объединяются в оперон по следующему принципу: закодированные в них белки принимают участие в одной биохимической цепи реакций.
Гены содержат интроны - неинформативные участки и экзоны - информативные участки.
Терминатор - последний участок транскриптона, служит сигналом об окончании транскрипции.
Первичный транскрипт - РНК, образующаяся при транскрипции - комплементарная копия транскриптона от промотора до терминатора.
23
Слайд 17 На всех этапах транскрипции необходимо участие специальных белковых факторов:
А,
На всех этапах транскрипции необходимо участие специальных белковых факторов:
А,

терминации.
Инициация
ДНК-зависимая РНК-полимераза связывается с ДНК и «ищет» промотор, перемещаясь от 3’-конца кодирующей цепи ДНК.
РНК-полимераза находит промотори связывается с ним с помощью σ-фактора. При этом цепь ДНК не раскручена.
Цепь ДНК раскручивается с помощью РНК-полимеразы от «-10» до «-1» участка, образуя открытый промоторный комплекс, который затем с помощью ионов магния еще более расширяется.
Первый нуклеозидтрифосфат, который «ставит» РНК-полимераза, всегда пуриновый: АТФ или ГТФ. Таким образрм, синтез РНК всегда начинается с пуринового нуклеозидтрифосфата (Пур-5-ФФФ).
ЭТАПЫ ТРАНСКРИПЦИИ
На этом этапе действуют ингибиторы - антибактериальные антибиотики
рифамицин и рифампицин, а также противоопухолевый антибиотик актиномицин D
2. Элонгация
РНК-полимераза движется по матрице антипраллельно в направлении 3’ 5’.
Следующий НТФ выбирается РНК-полимеразой комплиментарно нуклеотиду матричной цепи ДНК и соединяется 3’ – 5’ – связью с предыдущим, «выщепляя» Ф~Ф, который далее гидролизуется, что делает реакцию необратимой.
После синтеза первых 10 нуклеотидов G-фактор отщепляется и РНК-полимераза продолжает «ползти» по цепи ДНК, выбирать комплиментарный НТФ и присоединять их к растущей цепи РНК, одновременно раскручивая ДНК впереди себя и скручивая матрицу позади себя.
Слайд 18На этом этапе действует ингибитор элонгации - стрептолидигин
3. Терминация
У E.coli . большинство
На этом этапе действует ингибитор элонгации - стрептолидигин
3. Терминация
У E.coli . большинство

1) путем формирования структур типа «шпильки» в РНК, в результате чего ослабляется связь между РНК-полимеразой, матрицей (ДНК) и самой РНК. Эти структуры образуются благодаря копированию сигналов терминации, которые представляет собой определенную последовательность в рамках кодирующей цепи ДНК. Специфичными для терминирующих участков являются палиндромы (обратные повторы) и полиА-последовательности. Транскрипт с этого участка имеет форму шпильки с концевой УУУУ-последовательностью.
путем узнавания терминирующей последовательности специальным белком- p-фактором.
После терминации кор-фермент, отделившись от ДНК-матрицы и связавшись с новой молекулой сигма-фактора, приступает к синтезу новой молекулы РНК.
25
При взаимодействии ρ-фактора с РНК-полимеразой она теряет сродство к ДНК и комплекс распадается: фермент отделяется от ДНК, высвобождаются фактор и и первичный транскрипт, т.е. РНК
По мере продвижения кор-фермента происходит расплетание ДНК – как бы движется «пузырь транскрипции», содержащий около 18 п.о. в расплетенном виде. Как только одна п.о. становится раскрученной перед 3’-концом растущей цепи РНК, одна п.о. скручивается за «хвостом» РНК-полимеразы.
В результате элонгации образуется гибрид ДНК-РНК.
Слайд 19У прокариот м-РНК синтезируется сразу в зрелом виде.
У эукариот все первичные транскрипты
У прокариот м-РНК синтезируется сразу в зрелом виде.
У эукариот все первичные транскрипты

Процессинг - сложный процесс, включающий “кэпирование”, реакции расщепления и лигирования (сплайсинг), присоединение дополнительных концевых нуклеотидов и нуклеозидную модификацию
“Кэпирование” - присоединение к 5-концу мРНК метилгуанозинтрифосфата (связь 5-5), происходит еще в ядре, в процессе элонгации, когда длина цепи РНК достигает около 30 нуклеотидов. РНК-полимераза II сразу после инициации «метит» 5’-конец особой меткой, которая получила название «кэп» (сар – кепка, англ.). Она отщепляется от 5’-концевого НТФ последний фосфат, заменяя его остатком ГМФ, прикрепленной необычной 5’-5’ фосфо-эфирной связью. Далее метилируется гуанин в положении 7 пуринового кольца. Сар (7-метилгуанозинтрифосфат) защищает м-РНК от действия экзонуклеаз и отвечает за будущее связывание ее с рибосомой.
Полиаденилирование - присоединение к 3’- концу синтезированного транскрипта от 20 до 200 остатков АМФ с помощью фермента полиаденилатполимеразы. Синтезированный «поли-А-хвост» также защищает м-РНК от экзонуклеаз (с 3’-конца) и способствует выходу м-РНК из ядра.
Сплайсинг – точнее вырезание неинформативных участков (интронов) и сшивание несущих смысловую нагрузку экзонов. При этом экзоны соединяются в том порядке, в каком они присутствовали в первичном транскрипте. Альтернативный сплайссинг, при котором изменяется распределение экзонов одного транскрипта, позволяет увеличить генетическое разнообразие генома (увеличение количества различных белков) без увеличения количества генов.
Модификация РНК
Все три класса РНК транскрибируются с генов, которые содержат интроны.(до нескольких тысяч нуклеотидов).
Из 25 % длины ДНК, которые кодируют ~ 30 тысяч белков, только 1,1 % - энзоны, а ~24% -интроны. Считается, что присутствие интронов защищает функционально активную часть генома клетки от повреждающего действия химических или физических (лучевых) факторов.
5’-конец
«кэп»
3’-конец
поли-А-
последовательность
м-РНК
7-метил-
гуанозинтрифосфат
Слайд 20
Благодаря антикодону -триплету в средней части молекулы тРНК, комплементарному определенному кодону на
Благодаря антикодону -триплету в средней части молекулы тРНК, комплементарному определенному кодону на
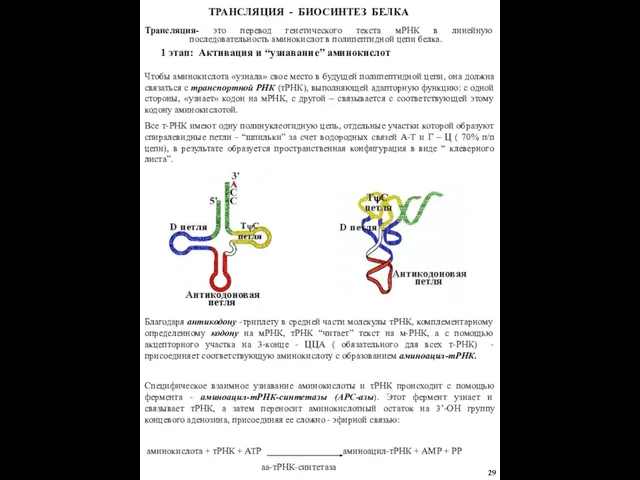
1 этап: Активация и “узнавание” аминокислот
ТРАНСЛЯЦИЯ - БИОСИНТЕЗ БЕЛКА
Трансляция- это перевод генетического текста мРНК в линейную последовательность аминокислот в полипептидной цепи белка.
Специфическое взаимное узнавание аминокислоты и тРНК происходит с помощью фермента - аминоацил-тРНК-синтетазы (АРС-азы). Этот фермент узнает и связывает тРНК, а затем переносит аминокислотный остаток на 3’-ОН группу концевого аденозина, присоединяя ее сложно - эфирной связью:
аминокислота + тРНК + ATP аминоацил-тРНК + АМР + РР
аа-тРНК-синтетаза
Чтобы аминокислота «узнала» свое место в будущей полипептидной цепи, она должна связаться с транспортной РНК (тРНК), выполняющей адапторную функцию: с одной стороны, «узнает» кодон на мРНК, с другой – связывается с соответствующей этому кодону аминокислотой.
Все т-РНК имеют одну полинуклеотидную цепь, отдельные участки которой образуют спиралевидные петли - “шпильки” за счет водородных связей А-Т и Г – Ц ( 70% п/п цепи), в результате образуется пространственная конфигурация в виде “ клеверного листа”.
29
Слайд 21Компоненты белоксинтезирующей системы:
м-РНК - генетическая матрица - содержит линейную последовательность кодонов,
Компоненты белоксинтезирующей системы:
м-РНК - генетическая матрица - содержит линейную последовательность кодонов,
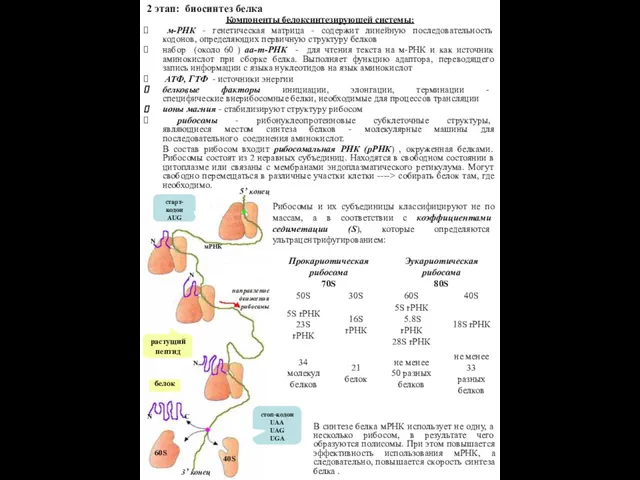
набор (около 60 ) аа-т-РНК - для чтения текста на м-РНК и как источник аминокислот при сборке белка. Выполняет функцию адаптора, переводящего запись информации с языка нуклеотидов на язык аминокислот
АТФ, ГТФ - источники энергии
белковые факторы инициации, элонгации, терминации - специфические внерибосомные белки, необходимые для процессов трансляции
ионы магния - стабилизируют структуру рибосом
рибосомы - рибонуклеопротеиновые субклеточные структуры, являющиеся местом синтеза белков - молекулярные машины для последовательного соединения аминокислот.
В состав рибосом входит рибосомальная РНК (рРНК) , окруженная белками. Рибосомы состоят из 2 неравных субъединиц. Находятся в свободном состоянии в цитоплазме или связаны с мембранами эндоплазматического ретикулума. Могут свободно перемещаться в различные участки клетки ----> собирать белок там, где необходимо.
2 этап: биосинтез белка
Рибосомы и их субъединицы классифицируют не по массам, а в соответствии с коэффициентами седиметации (S), которые определяются ультрацентрифугированием:
В синтезе белка мРНК использует не одну, а несколько рибосом, в результате чего образуются полисомы. При этом повышается эффективность использования мРНК, а следовательно, повышается скорость синтеза белка .
Слайд 221. ИНИЦИАЦИЯ ТРАНСЛЯЦИИ
На рибосоме имеются два участка: П-сайт или пептидильный сайт, служащий
1. ИНИЦИАЦИЯ ТРАНСЛЯЦИИ
На рибосоме имеются два участка: П-сайт или пептидильный сайт, служащий

31
Факторы инициации у прокариот:
IF1 ;
IF2 – обладает ГТФ-азной активностью;
IF3 – имеет максимальное сродство к малой субъединице.
У эукариот факторы инициации eIF1, eIF2…
( всего описано до десяти факторов). У эукариот ингибировать фактор инициации eIF -2 могут интерфероны – белки, которые синтезируются в лимфоидной и других тканях, обладают антивирусной и противоопухолевой активностью.
Наиболее ответственным моментом трансляции являются точное узнавание самого первого кодона, который соответствует N-концевой аминокислоте будущего белка. От этого зависит правильность установки рамки считывания. При этом оба конца мРНК имеют нетранслируемые участки.
Стартовая точка – инициирующий кодон АУГ, кодирующей метионин, т.е. каждый белок начинается с метионина. Чтобы отличить этот «начальный» метионин от других молекул метионина, которые встраиваются в белки, у клетки есть две разные по структуре тРНК с одинаковыми антикодонами (УАЦ) и только одну из них распознают IF2 (фактор инициации) и только в комплексе с ним эту met-мРНК может принять П-сайт рибосомы. (IF2 обладает ГТФ-азной активностью).
Шаги инициации
мРНК фиксируется на малой субъединице рибосомы вблизи кэпа
мет-тРНК вместе с IF2 связывается с малой субединицей рибосомы в П-сайте с участием КЭП-связывающих белков и других факторов инициации.
у прокариот малая рибосома сразу взаимодействует с участком мРНК, содержащего АУГ или ГУГ (инициирующим), которые соответствуют N- формил мет-т-РНК.
Малая субъединица, объединенная с мет-т-РНК продвигается по м-РНК к ее 3’-концу с помощью АТФ-зависимого механизма до встречи с кодоном АУГ. По принципу комплиментарности антикодон мет-тРНК (УАЦ) связывается с кодоном АУГ (при этом расщепляется ГТФ), что служит сигналом к объединению малой субъединицы с большой (одновременно в цитоплазму вытесняются белковые факторы). Образуется комплекс: м-РНК-рибосома-метионил-т-РНК, готовый к элонгации.
Слайд 232. ЭЛОНГАЦИЯ ТРАНСЛЯЦИИ
Элонгация - это рост полипептидной цепи от N-конца
2. ЭЛОНГАЦИЯ ТРАНСЛЯЦИИ
Элонгация - это рост полипептидной цепи от N-конца

а) - связывание аа-т-РНК. В момент первого шага второй кодон на мРНК свободен. С ним спаривается своим антикодоном поступающая в рибосомы аа-тРНК, ее аминоацильный конец связывается с А-сайтом рибосомы. Участвуют белковые факторы элонгации, в частности, EF-2, который инактивируется дифтерийным токсином путем АДФ-рибозилирования.
б) –транспептидация. Происходит переброс пептидила с левой тРНК (из П-сайта) на аминогруппу аа-тРНК, таким образом формируется пептидная связь с помощью пептидилтрансферазы. Пептидилтрансферазную активность связывают с рРНК, которую считают рибозимом, т.е. РНК, обладающей каталитической активностью. В А-сайте образуется пептидил-тРНК (n+1) , П -сайт - вакантный.
в) - транслокация . Образовавшийся пептидил-тРНК переносится из А-сайта в П-сайт, благодаря продвижению рибосомы относительно мРНК. Фермент - транслоказа. Используется энергия ГТФ, т.е. участвует фактор элонгации EFG, обладающий ГТФ-азной активностью.
Транслирующая рибосома перемещается вдоль мРНК в направлении 3-конца на 1 кодон (триплет), т.е. идет наращивание полипептидной цепи по 1 аминокислоте в соответствии с порядком кодонов мРНК. На рибосоме одновременно может разместиться около 30 остатков аминокислот, остальные «свисают» в цитоплазму.
Энергетические затраты на синтез 1 пептидной связи: 2АТФ и 2 ГТФ
Ингибиторы элонгации:
амицетин, эритромицин, пуромицин, тетрациклины.
образование
пептидной связи
образование
пептидной связи
ГТФ
ГДФ
м-РНК
5’
Слайд 24 Во время элонгации происходит важное событие - формирование пространственной структуры полипептидной цепи,
Во время элонгации происходит важное событие - формирование пространственной структуры полипептидной цепи,

Гидрофобные участки синтезируемого белка притягиваются друг к другу, гидрофильные - взаимодействуют с водой и ионами, вследствие этого происходит самоорганизация растущей цепи во вторичную и третичную структуры.
Иногда белок (продукт) нужно отправить через мембрану, для чего он должен быть раскручен. Для этого синтезируемая цепь взаимодействует со специфическими белками – шаперонами, которые препятствуют сворачиванию белка и поддерживают его в недосвернутом состоянии.
Шапероны- молекулы-наставницы, которые «уберегают» еще неготовый белок от «рискованных контактов» его фрагментов. Они образуют нековалентный комплекс с растущей полипептидной цепью, как бы «предостерегая» ее от ошибочных вариантов скручивания и упаковки, и обеспечивают правильное складывание полипептидной цепи (фолдинг), от чего зависит функциональная активность белка.
Считают, что шапероны защищают организм от спонтанного возникновения прионовых модификаций. Известно только то, что прионовые белки отличаются от своих нормальных эквивалентов только необычной пространственной организацией при той же первичной структуре
3. ТЕРМИНАЦИЯ ТРАНСЛЯЦИИ
В м-РНК присутствуют терминирующие кодоны (“стоп-сигналы”) УАА, УГА, УАГ и белковые факторы терминации. С терминирующими кодонами не может связаться ни одна т-РНК, т.к. нет соответствующих антикодонов, поэтому происходит связывание с белковыми факторами терминации.
При этом активируются рибосомные белки – пептидазы, которые гидролизуют сложноэфирную связь между синтезированным полипептидом и т-РНК. Синтезированный белок отделяется от рибосомы, освобождается т-РНК и м-РНК.
Посттрансляционная модификация белков
После трансляции белки подвергаются разнообразным превращениям – химическим модификациям: удалению концевого метионина, гидроксилированию, карбоксилированию, метилированию и др.
Слайд 2533
Регуляция синтеза белка
Концентрация многих белков в клетке непостоянна и изменяется в
33
Регуляция синтеза белка
Концентрация многих белков в клетке непостоянна и изменяется в
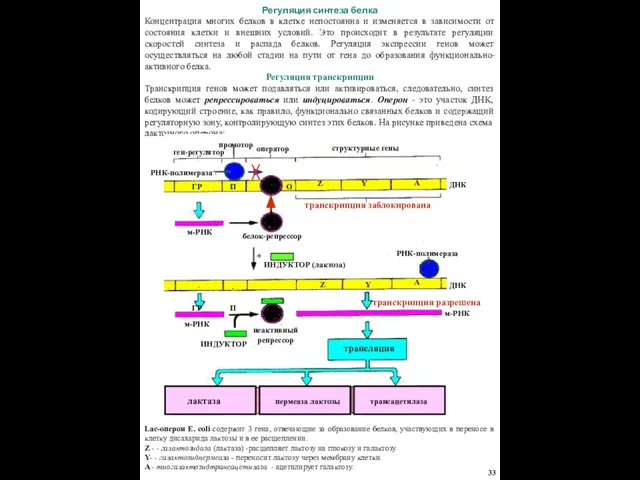
Регуляция транскрипции
Транскрипция генов может подавляться или активироваться, следовательно, синтез белков может репрессироваться или индуцироваться. Оперон - это участок ДНК, кодирующий строение, как правило, функционально связанных белков и содержащий регуляторную зону, контролирующую синтез этих белков. На рисунке приведена схема лактозного оперона:
Lac-оперон E. coli содержит 3 гена, отвечающие за образование белков, участвующих в переносе в клетку дисахарида лактозы и в ее расщеплении.
Z - - галактозидаза (лактаза) -расщепляет лактозу на глюкозу и галактозу.
Y- - галактозидпермеаза - переносит лактозу через мембрану клетки.
А - тиогалактозидтрансацетилаза - ацетилирует галактозу.
 Пиломатериалы, получение и применение
Пиломатериалы, получение и применение Совместное использование пакета Microsoft Office Excel 2007 и служб интеллектуального анализа данных SQL Server Analysis Services
Совместное использование пакета Microsoft Office Excel 2007 и служб интеллектуального анализа данных SQL Server Analysis Services Управление качеством
Управление качеством Стиль модерн и сопряжение
Стиль модерн и сопряжение «Удивительный мир многогранников»
«Удивительный мир многогранников» Промышленная Группа СОЮЗ. Многопрофильный холдинг, производитель полного спектра мебельных комплектующих для сборки мебели
Промышленная Группа СОЮЗ. Многопрофильный холдинг, производитель полного спектра мебельных комплектующих для сборки мебели Автономные энергетические системы на базе нетрадиционных источников энергии для горных поселений КР
Автономные энергетические системы на базе нетрадиционных источников энергии для горных поселений КР Модели и технологии обучения персонала розницы в период изменений
Модели и технологии обучения персонала розницы в период изменений Чрезвычайные ситуации техногенного характера
Чрезвычайные ситуации техногенного характера Тема проповеди: Виденье церковное – мое виденье
Тема проповеди: Виденье церковное – мое виденье Из конфликта в эффективную коммуникацию
Из конфликта в эффективную коммуникацию Политические режимы. Урок 3
Политические режимы. Урок 3 Зрительное восприятие цвета
Зрительное восприятие цвета Стратегия развития современных технологий мобильной связи на Дальнем Востоке и в Восточной Сибири
Стратегия развития современных технологий мобильной связи на Дальнем Востоке и в Восточной Сибири Сачки и дезертиры
Сачки и дезертиры Художественные образы СПБ: российский город на перекрёстке мировых культур
Художественные образы СПБ: российский город на перекрёстке мировых культур Фактори забезпечення конкурентоспроможності підприємства
Фактори забезпечення конкурентоспроможності підприємства Три клада у Природы есть:вода,Земля и воздух – три ее основы.Какая бы ни грянула беда,Целы они – все возродится снова.
Три клада у Природы есть:вода,Земля и воздух – три ее основы.Какая бы ни грянула беда,Целы они – все возродится снова. Конвейер проектов. Критерии и роли. Специфика выполнения
Конвейер проектов. Критерии и роли. Специфика выполнения Проектно-изыскательские работы. Градостроительная документация. Лекция 1
Проектно-изыскательские работы. Градостроительная документация. Лекция 1 Добыча нефти
Добыча нефти Презентация на тему Правописание падежных окончаний имен существительных единственного числа (4 класс)
Презентация на тему Правописание падежных окончаний имен существительных единственного числа (4 класс) THE PRESENT PERFECT TENSE НАСТОЯЩЕЕ СОВЕРШЕННОЕ ВРЕМЯ
THE PRESENT PERFECT TENSE НАСТОЯЩЕЕ СОВЕРШЕННОЕ ВРЕМЯ Кобелев Н.Б.ВЗФЭИ, Москва
Кобелев Н.Б.ВЗФЭИ, Москва Театрально-игровая деятельность - как средство развития творческих способностей детей дошкольного возраста
Театрально-игровая деятельность - как средство развития творческих способностей детей дошкольного возраста Презентация на тему Частица как служебная часть речи.
Презентация на тему Частица как служебная часть речи.  Спасенный сад
Спасенный сад Караоке-баттл 99 баллов. Описание игры
Караоке-баттл 99 баллов. Описание игры