Научно-практическая конференция«Шеренга великих химиков»АвторТкаченко Лариса Тадеушевнаучитель химии МОУ «Гатчинский Лицей
- Главная
- Разное
- Научно-практическая конференция«Шеренга великих химиков»АвторТкаченко Лариса Тадеушевнаучитель химии МОУ «Гатчинский Лицей

Содержание
- 2. План конференции Вступительное слово учителя Доклады учащихся Перерыв 10 мин Выполнение творческих заданий Круглый стол Подведение
- 3. Вступительное слово учителя Цели и задачи конференции Данная конференция ставит своей целью формирование у учащихся опыта
- 4. Доклады учащихся Йенс Якоб Берцелиус (1779-1848)–Алексеева О., Двоеконко Д Анри Луи ле Шателье (1850-1936) –Григорьев А.,
- 5. Творческие задания учащихся Каждая группа докладчиков подготовила заранее задание для всех остальных групп. Поэтому каждая пара
- 6. Круглый стол Обмен мнениями по докладам, творческим заданиям. Учащиеся объявляют результаты по своему заданию и анализируют
- 7. Подведение итогов Итоги подводит учительское жюри. Жюри в течение конференции и по ее окончании заполняет карту
- 8. Карта оценки учащихся на конференции
- 9. Реферат по химии на тему: «Жизнь и деятельность Роберта Бойля» Выполнили: ученики 8-1 класса МОУ «Лицей
- 10. Годы жизни – 1627-1691 Биография Бойля Роберт Бойль родился 25 января 1627 года. Он был тринадцатым
- 11. Научная деятельность Бойля В Столбридже часто устраивались приемы, где бывали известные по тем временам ученые, литераторы
- 12. Бойль-химик Поначалу Бойль занялся получением настоев из цветов, целебных трав, лишайников, древесной коры и корней растений
- 13. И как часто случается в науке, одно открытие влекло за собой другое. При исследовании настоя чернильного
- 14. Наблюдательный ученый не мог пройти мимо еще одного свойства растворов: когда к раствору серебра в азотной
- 15. Аналитическая химия Бойля Молодой ученый продолжал сомневаться в универсальной аналитической способности огня и искал иные средства
- 16. Работа Бойля с Гомбергом по систематизации веществ В 1654 году ученый переселился в Оксфорд, где продолжил
- 17. Работа Бойля с Гуком по развитию корпускулярной теории После Гомберга его ассистентом стал молодой физик Роберт
- 18. Книги Бойля Бойль удалился в свое поместье: там можно было спокойно трудиться. Он решил изложить результаты
- 19. Продолжение исследований; открытия в области физики После восшествия на престол Карла II политическая жизнь страны несколько
- 20. Организация Королевского общества Став ведущим английским физиком и химиком, Бойль выступил с инициативой организации Общества наук,
- 21. Выходят в свет новые его книги: «Гидростатические парадоксы», «Возникновение форм и качеств согласно корпускулярной теории», «О
- 22. Работа Бойля в области философии Теперь его занимали в основном философские проблемы. Бойль был известен и
- 23. Список используемой литературы Н. Л. Глинка «Общая химия» Р. К. Баладин, В. А. Маркин «100 великих
- 24. Реферат по химии на тему: «Иоганн-Рудольф Глаубер» Выполнили: ученики МОУ г.Гатчины «Лицей № 3» Сумбаев Игорь,
- 25. Глаубер: история, биография. Годы жизни – 1604-1668 Иоганн Глаубер родился в 1604 году в Карлштадте. Глаубер
- 26. В лаборатории стояла кирпичная печь с установленной на ней большой стеклянной ретортой, которая представляла собой шарообразный
- 27. Глаубер мог получать серную кислоту перегонкой "зеленого витриола"(зеленого камня), квасцов, или "белого витриола"(сульфата цинка). В реторте
- 28. Глауберу был известен секрет получения еще одной кислоты, которую он называл "спиритус салис" (соляная кислота). Бесцветный
- 29. Нагревая мочу, смешанную с известью, ученый получил газ, который назвал "аммиак". Этот газ вступал во взаимодействие
- 30. Глаубер впервые применил стекло для изготовления химической посуды. Ему пришлось освоить стеклодувное дело. Позже он основал
- 31. Открытия и достижения Иоганн-Рудольф Глаубер получил: "Ацидум олеум витриоли" - концентрированную серную кислоту "синий витриол" (синий
- 32. "аммиак". впервые применил стекло для изготовления химической посуды обнаружил, что небольшие добавки в стекло других веществ
- 33. Получение глауберовой соли
- 34. Творческое задание Найдите ответы на вопросы 1-8 в квадрате и из оставшихся букв у вас должно
- 35. Ответы на задание Цирюльник. Вена. Соляная. Айснер. Стекло. Парацельс. Сумбаев. Шестаков. Остаётся уксусная.
- 36. Реферат по химии на тему: «Клод-Луи Бертолле» Выполнили: ученики 8-1 класса МОУ «Лицей №3» Иванов Александр,
- 37. Основные исследования относятся к неорганической химии, химии растворов и сплавов. Французский химик Клод-Луи Бертолле был коллегой
- 38. Восемнадцатый век был богат химическими открытиями Ученые освобождались от мистических поисков философского камня, отбрасывали одну за
- 39. После 1786 года сблизился с Лавуазье; вместе с ним и еще двумя видными учеными - Гитоном
- 40. Поставив большое количество опытов, Бертолле показал, что реакции не идут до конца в направлении, указываемом известными
- 41. Реферат по химии на тему: «Йенс Якоб Берцелиус» Выполнили ученицы 8-1 класса МОУ г.Гатчины «Лицей №3»
- 42. Иенс Якоб Берцелиус. Биография Шведский химик Йене Якоб Берцелиус (20 августа 1779. селение Веверсунда близ Линчепинга.
- 43. После окончания университета Берцелиус некоторое время занимался частной врачебной практикой, затем стал адъюнктом медицины и фармации
- 44. Для работы в Стокгольмской лаборатории Берцелиус отобрал нескольких талантливых химиков. Наиболее известными из них стали X.
- 45. Труды Берцелиуса Берцелиус почти все научные исследования целиком посвятил химии, значительно продвинув вперёд развитие этой науки.
- 46. Берцелиус определил атомные веса всех известных в его время химических элементов. Ему удалось идентифицировать атомные массы
- 47. Результатом работ было усовершенствование старых и создание новых методов анализа, изобретение новых приборов, развитие техники лабораторных
- 48. Доказал, что соли возникают путем соединения кислот со щелочами (пример HCI + КОН ? KCI +
- 49. Открытие тория Торий - один из немногих радиоактивных элементов, открытых задолго до появления самого понятия "радиоактивность".
- 50. "Похоронив" торий. Берцелиус же его "воскресил". Через три года из Норвегии ему прислали еще один редкий
- 51. История открытия селена Селен (англ. Selenium, франц. Selenium, нем. Selren) открыт Берцелиусом в 1817 г., который
- 52. Любопытство, вызванное надеждой обнаружить в этом коричневом осадке новый редкий металл, заставило меня исследовать осадок Приняв
- 53. Открытие кремния Несмотря на распространенность в природе, этот элемент открыли сравнительно поздно. В 1825 г Йенс
- 54. История открытия Титана Много лет считалось, что металлический титан впервые был получен Берцелиусом в 1825 г.
- 55. Открытие Циркония Через 35 лет после опытов Клапрота Йенсу Якобу Берцелиусу удалось получить металлический цирконий. Берцелиус
- 56. Для того чтобы можно было получить какой-либо металл электролизом из раствора его соли, этот металл должен
- 57. Заключение Начиная с 1811 Берцелиус занимался систематическим определением элементного состава органических соединений и показал, что их
- 58. Берцелиус сконструировал и изготовил многочисленные приборы из стекла. Он сам был великолепным стеклодувом. Он настолько усовершенствовал
- 59. Созданный Берцелиусом "химический язык" позволил простым и наглядным способом сопоставить особенности химических явлений с составом взаимодействующих
- 60. Список литературы К Хайгинг "Биографии великих химиков" Мир 1981г. Я. Голованов "Этюды об ученых" Москва 1970
- 61. Реферат по химии на тему: «Анри Луи ле Шателье» Выполнили: ученики 8-1 класса МОУ г.Гатчины «Лицей
- 62. Биография Анри Луи Ле Шателье родился 8 октября 1850 года в Париже. Его отец , горный
- 63. Научные исследования Научные исследования учёного относятся к физической химии. Совместно с Пьером Эжен Марселей Бертло (1827-1907)
- 64. Химическое равновесие Наиболее важный вклад французского учёного в науку был связан с изучением химического равновесия, исследованием
- 65. Сейчас закон Ле-Шателье формулируется в общем виде следующим образом: внешнее воздействие (изменение температуры, давления, концентрации реагирующих
- 66. Рассмотрим, как применим принцип Ле Шателье для смещения равновесия реакции синтеза аммиака. - изменение концентраций: чтобы
- 67. Синтез аммиака идёт в гигантских колоннах синтеза, куда с помощью компрессора подаётся смесь водорода и азота.
- 68. Всю жизнь Ле Шателье посвятил исследованиям, важным для развития промышленности, и изучал химические процессы в металлургии,
- 69. Умер Ле Шателье в Мирибель-Лез-Эшель 17 сентября 1936. К сожалению, Ле Шателье не был удостоен Нобелевской
- 70. Список использованной литературы . А. Крицман, В. В. Станцо. Энциклопедический словарь юного химика. - М.: Педагогика,
- 71. Реферат по химии на тему: «Джозеф Пристли» Выполнили ученицы 8-1 класса МОУ г.Гатчины «Лицей №3» Евстифеев
- 72. БИОГРАФИЯ ДЖОЗЕФА ПРИСТЛИ Джозеф Пристли ( 1733-1804) - английский священник, химик, философ, общественный деятель, родился в
- 73. Начало научной деятельности и религиозные искания Джозефа Пристли Разочарование в кальвинизме стало причиной его поступления в
- 74. В 1762 г. Джозеф Пристли был посвящен в духовный сан, и в тот же год он
- 75. Научные достижения и открытия Джозефа Пристли Следует отметить, что глубокая вера в Бога и убеждённость в
- 76. Открытие углекислого газа По соседству с домом Джозефа Пристли находилась пивоварня, куда он иногда захаживал. Здесь
- 77. Изобретение газированной воды и ластика Открытие способа газирования воды было сделано очень просто. В одной из
- 78. С именем Пристли связано ешё одно чудесное изобретение, без которого нельзя в настоящее время представить жизнь
- 79. Открытие закиси азота Анестезиологам всего мира имя Джозефа Пристли в первую очередь памятно и дорого, конечно
- 80. На воздухе этот бесцветный газ бурел, I превращаясь в диоксид азота (N02). Однако, I оставляя «селитряный
- 81. Открытие аммиака и хлористого водорода Следующим его открытием был «щелочной воздух» - аммиак. Джозеф Пристли смог
- 82. По другой легенде это открытие произошло следующим образом. Однажды Пристли оставил рядом две склянки с неплотно
- 83. Великое открытие кислорода и совсем немного о приоритете на право его открытия Крупнейшим вкладом Пристли в
- 84. Вы можете теперь представить, как трудно было изучать химию во времена, когда химические формулы ещё не
- 85. Но в своих работах Джозеф Пристли был пионером и подлинным образцом объективного экспериментатора. Его работы по
- 87. Скачать презентацию
Слайд 2План конференции
Вступительное слово учителя
Доклады учащихся
Перерыв 10 мин
Выполнение творческих
План конференции
Вступительное слово учителя
Доклады учащихся
Перерыв 10 мин
Выполнение творческих

Круглый стол
Подведение итогов
Слайд 3Вступительное слово учителя
Цели и задачи конференции
Данная конференция ставит своей целью формирование
Вступительное слово учителя
Цели и задачи конференции Данная конференция ставит своей целью формирование

Слайд 4Доклады учащихся
Йенс Якоб Берцелиус (1779-1848)–Алексеева О.,
Двоеконко Д
Анри Луи ле Шателье
Доклады учащихся
Йенс Якоб Берцелиус (1779-1848)–Алексеева О.,
Двоеконко Д
Анри Луи ле Шателье

Роберт Бойль (1627-1691) –Мареичев М., Ткаченко Н.
Антуан Лоран Лавуазье (1743-1794) –Мерзлозубов М., Шестера В.
Парацельс (1493-1541) – Конева Е., Тютюнникова Н.
Джозеф Пристли (1733-1804) – Евстифеев В.,
Шагимарданов В.
Генри Кавендиш (1731-1810) – Васильева Е., Пирогова Е.
Иоганн Рудольф Глаубер (1604-1668) –Сумбаев И.,
Шестаков А.
Дмитрий Иванович Менделеев(1834-1907) –Федулова К.
Амедео Авогадро (1776-1856) –Лаппо С., Богатова А.
Клод-Луи Бертолле (1748-1822) – Иванов А., Ильясов К.
Карл Вильгельм Шееле (1742-1786) –Якорев В.
есть
есть
нет
нет
есть
нет
нет
нет
есть
есть
есть
нет
Слайд 5Творческие задания учащихся
Каждая группа докладчиков подготовила заранее задание для всех остальных групп.
Творческие задания учащихся
Каждая группа докладчиков подготовила заранее задание для всех остальных групп.

Слайд 6Круглый стол
Обмен мнениями по докладам, творческим заданиям.
Учащиеся объявляют результаты по своему
Круглый стол
Обмен мнениями по докладам, творческим заданиям.
Учащиеся объявляют результаты по своему

Выбирают наиболее понравившееся задание и поясняют свой выбор.
Анализируют услышанные доклады, выбирают более интересный, запоминающийся.
Слайд 7Подведение итогов
Итоги подводит учительское жюри.
Жюри в течение конференции и по ее
Подведение итогов
Итоги подводит учительское жюри.
Жюри в течение конференции и по ее

Слайд 8Карта оценки учащихся на конференции
Карта оценки учащихся на конференции

Слайд 9Реферат по химии на тему:
«Жизнь и деятельность Роберта Бойля»
Выполнили: ученики 8-1 класса
Реферат по химии на тему: «Жизнь и деятельность Роберта Бойля» Выполнили: ученики 8-1 класса

Содержание
Биография Бойля
Научная деятельность Бойля
Бойль-химик
Аналитическая химия Бойля
Работа Бойля с Гомбергом по систематизации веществ
Работа Бойля с Гуком по развитию корпускулярной теории
Книги Бойля
Продолжение исследований; открытия в области физики
Организация Королевского общества
Работа Бойля в области философии
Список используемой литературы
Слайд 10Годы жизни – 1627-1691
Биография Бойля
Роберт Бойль родился 25 января 1627 года.
Годы жизни – 1627-1691
Биография Бойля
Роберт Бойль родился 25 января 1627 года.

Он родился в Лисмор Касле, одном из ирландских поместий отца. Там Роберт провел детство. Он получил превосходное домашнее образование и в возрасте восьми лет стал студентом Итонского университета. Там он проучился четыре года, после чего уехал в новое поместье отца – Столбридж.
Как было принято в то время, в возрасте двенадцати лет Роберт вместе с братом отправили в путешествие по Европе. Он решил продолжить образование в Швейцарии и Италии и пробыл там долгие шесть лет. В Англию Бойль вернулся только в 1644 году, уже после смерти отца, который оставил ему значительное состояние
Слайд 11Научная деятельность Бойля
В Столбридже часто устраивались приемы, где бывали известные по тем
Научная деятельность Бойля
В Столбридже часто устраивались приемы, где бывали известные по тем

Бойль мечтал о собственной лаборатории, однако просить сестру о материальной поддержки не осмеливался. Ему пришло в голову, что многочисленные постройки имения можно переоборудовать под лаборатории; к тому же оттуда рукой подать до Оксфорда, да и Лондон недалеко: можно будет по-прежнему встречаться с друзьями…
Ученый-энциклопедист, Бойль, занимался проблемами биологии, медицины, физики и химии, проявлял не меньший интерес к философии, теологии и языкознанию. Бойль придавал первостепенное значение лабораторным исследованиям. Наиболее интересны и разнообразны его опыты по химии. Бойль считал, что химия, отпочковавшись от алхимии и медицины, вполне может стать самостоятельной наукой.
Слайд 12Бойль-химик
Поначалу Бойль занялся получением настоев из цветов, целебных трав, лишайников, древесной
Бойль-химик
Поначалу Бойль занялся получением настоев из цветов, целебных трав, лишайников, древесной

Слайд 13И как часто случается в науке, одно открытие влекло за собой другое.
И как часто случается в науке, одно открытие влекло за собой другое.
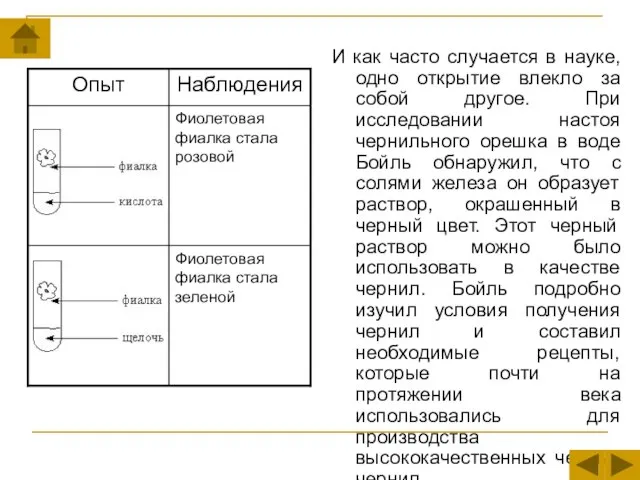
Слайд 14Наблюдательный ученый не мог пройти мимо еще одного свойства растворов: когда к
Наблюдательный ученый не мог пройти мимо еще одного свойства растворов: когда к

Ag + 2HNO3 ? AgNO3 + NO2 + H2O
добавляли немного соляной кислоты
AgNO3 + HCl ? AgCl + HNO3
образовывался белый осадок, который Бойль назвал «луна корнеа» (хлорид серебра AgCl). Если осадок оставляли в открытом сосуде, он чернел
2AgCl?2Ag+Cl2.
Совершалась аналитическая реакция, достоверно показывающая, что в исследуемом веществе содержится «луна» (серебро).
Слайд 15Аналитическая химия Бойля
Молодой ученый продолжал сомневаться в универсальной аналитической способности огня
Аналитическая химия Бойля
Молодой ученый продолжал сомневаться в универсальной аналитической способности огня

Однако научную работу в Столбридже пришлось приостановить. Из Ирландии пришла недобрая весть: восставшие крестьяне разорили замок в Корке, доходы имения резко сократились. В начале 1652 года Бойль вынужден был выехать в родовое поместье. Много времени ушло на улаживание финансовых проблем, был назначен более опытный управляющий, порой Бойль сам контролировал его работу.
Слайд 16Работа Бойля с Гомбергом по систематизации веществ
В 1654 году ученый переселился
Работа Бойля с Гомбергом по систематизации веществ
В 1654 году ученый переселился

Бойль и Гомберг получили и исследовали много солей. Их классификация с каждым экспериментом становилась все обширнее и полнее. Не все в толковании ученых было достоверно, не все соответствовало существовавшим в те времена представителям, и, однако, это был смелый шаг к последовавшей теории, шаг, который превращал химию из ремесла в науку. Это была попытка ввести теоретические основы в химию, без которой немыслима наука, без которых она не может двигаться вперед.
Слайд 17Работа Бойля с Гуком по развитию корпускулярной теории
После Гомберга его ассистентом
Работа Бойля с Гуком по развитию корпускулярной теории
После Гомберга его ассистентом

Узнав из научных публикаций о работах немецкого физика Отто Герике, Бойль решил повторить его эксперименты и для этой цели изобрел оригинальную конструкцию воздушного насоса. Первый образец этой машины был построен с помощью Гука. Насосом исследователям удалось почти полностью удалить воздух. Однако все попытки доказать присутствие эфира после удаления воздуха из сосуда в пустом сосуде оставались тщетными.
– Никакого эфира не существует, – сделал вывод Бойль. Пустое пространство он решил назвать вакуумом, что по латыни означает «пустой».
Кризис, охвативший в конце пятидесятых годов всю Англию, прервал его научную работу. Возмущенные жестокой диктатурой Кромвеля сторонники монархии вновь поднялись на борьбу. Аресты и убийства, кровавая междоусобица стали обычным явлением в стране.
Слайд 18Книги Бойля
Бойль удалился в свое поместье: там можно было спокойно трудиться. Он
Книги Бойля
Бойль удалился в свое поместье: там можно было спокойно трудиться. Он

Слайд 19Продолжение исследований; открытия в области физики
После восшествия на престол Карла II политическая
Продолжение исследований; открытия в области физики
После восшествия на престол Карла II политическая

Вместе с ним Бойль открыл один из фундаментальных физических законов, установив, что изменение объема газа обратно пропорционально изменению давления:
PV=const, где P – давление, V – объем, const – постоянная величина.
Это означало, что, зная изменение объема сосуда можно было точно вычислить изменение давления газа. Величайшее открытие XVII века. Бойль впервые описал его в 1662 году («В защиту учения относительно эластичности и веса воздуха») и скромно назвал гипотезой. Пятнадцатью годам позже во Франции Мариотт подтвердил открытие Бойля, установив ту же закономерность. По сути дела это был первый закон рождающейся физико-химической науки. PV=const – закон Бойля–Мариоттa.
Кроме того, Бойль доказал, что при изменении давления могут испаряться даже те вещества, с которыми этого не происходит в нормальных условиях, например лед. Бойль первым описал расширение тел при нагревании и охлаждении.
Слайд 20Организация Королевского общества
Став ведущим английским физиком и химиком, Бойль выступил с
Организация Королевского общества
Став ведущим английским физиком и химиком, Бойль выступил с

Бойль находился в расцвете творческих сил: одна за другой появлялись из-под его пера научные работы по философии, физике, химии. В 1664 году он публикует «Опыты и размышления о цветах».
Бойль к тому времени был в зените своей славы. Нередко его приглашают теперь во дворец, потому что и сильные мира сего считали честью побеседовать хоть несколько минут со «светилом английской науки». Ему повсеместно оказывали почести и даже предложили стать членом компании «Королевские шахты». В следующем году его назначают директором Ост-Индской компании. Однако все это не могло отвлечь ученого от основной работы. Бойль употреблял все полученные от этой должности доходы на развитие науки. Именно в Оксфорде Бойль создал одну из первых в Европе научных лабораторий, в которой вместе с ним работали многие известные ученые.
Слайд 21Выходят в свет новые его книги: «Гидростатические парадоксы», «Возникновение форм и качеств
Выходят в свет новые его книги: «Гидростатические парадоксы», «Возникновение форм и качеств

В течение нескольких лет Бойль изучал вещество, названное светящимся камнем, или фосфором. В 1680 году он получил белый фосфор (Р4), который впоследствии еще долго называли фосфором Бойля.
Шло время. Здоровье Бойля сильно ухудшилось. Он не мог уже следить за работой в лабораториях, не мог принимать деятельного участия в исследованиях. Однако ему необходимо было изложить те знания, которые он приобрел в процессе своих исследований на протяжении почти тридцати пяти лет. С этой целью Бойль отправляется в родовое поместье. Иногда он наезжал в Кембридж – побеседовать с Ньютоном, в Оксфорд - повидаться со старыми друзьями или в Лондон – встретиться с софистами. Но лучше всего он чувствовал себя дома, в своем кабинете среди книг.
Слайд 22Работа Бойля в области философии
Теперь его занимали в основном философские проблемы.
Работа Бойля в области философии
Теперь его занимали в основном философские проблемы.

Чтобы читать библейские тексты в подлинниках, Бойль даже изучил греческий и древнееврейский языки. Еще при жизни он учредил ежегодные чтения по богословию и истории религии.
Третья сторона деятельности Бойля была связана с литературой. Он обладал хорошим слогом и написал несколько стихотворений и трактат на темы морали.
Роберт Бойль умер 30 декабря 1691 года и погребен в Вестминстерском аббатстве – месте захоронения выдающихся людей Англии.
Умирая, Бойль завещал, чтобы весь его капитал был использован на развитие науки в Англии и на продолжение деятельности Королевского общества. Кроме того, он предусмотрел особые средства для проведения ежегодных научных чтений по физике и богословию.
Слайд 23Список используемой литературы
Н. Л. Глинка «Общая химия»
Р. К. Баладин, В. А. Маркин
Список используемой литературы
Н. Л. Глинка «Общая химия»
Р. К. Баладин, В. А. Маркин

Н. Е. Кузьменко, В. В. Еремин, В. А. Попков «Начала химии»
Слайд 24Реферат по химии на тему:
«Иоганн-Рудольф Глаубер»
Выполнили: ученики МОУ г.Гатчины «Лицей №
Реферат по химии на тему: «Иоганн-Рудольф Глаубер» Выполнили: ученики МОУ г.Гатчины «Лицей №

Содержание:
Биография И.Р.Глаубера
Открытия и достижения
Получение глауберовой соли
Задание
Ответы к заданию
Слайд 25
Глаубер: история, биография.
Годы жизни – 1604-1668
Иоганн Глаубер родился в 1604 году в
Глаубер: история, биография.
Годы жизни – 1604-1668
Иоганн Глаубер родился в 1604 году в

Глаубер решил сам изучить воду целебного Нойштадского источника. Выделенная соль оказалась абсолютно непохожей на селитру, поэтому он назвал ее "саль мирабиле".
Спустя год Глаубер поступил на работу в одну из Венских аптек и за три года получил звание аптекаря (по тем временам это говорило о его высоком профессионализме).
Глаубер владел еще одним важным секретом - способом получения "спиритус салис" - соляной кислоты HCl из поваренной соли при действии серной кислоты.
Слайд 26В лаборатории стояла кирпичная печь с установленной на ней большой стеклянной ретортой,
В лаборатории стояла кирпичная печь с установленной на ней большой стеклянной ретортой,

Слайд 27Глаубер мог получать серную кислоту перегонкой "зеленого витриола"(зеленого камня), квасцов, или "белого
Глаубер мог получать серную кислоту перегонкой "зеленого витриола"(зеленого камня), квасцов, или "белого

Как-то он решил получить "спиритус нитри" (азотную кислоту) не из квасцов и селитры, а другим путем. Он насыпал в реторту селитру и залил ее "ацидум олеум витриоли" (серная кислота)и стал нагревать реторту. Реторта заполнилась красновато-коричневыми парами. Густая каша вспенилась, а в стеклянную бутыль начала капать желтовато-красная жидкость. Это была концентрированная азотная кислота, которую они назвали "спиритус нитри". Эта жидкость обладала сильным разъедающим действием. Она растворяла многие металлы, даже серебро ("луну"), железо ("марс") и медь ("венеру").
Глаубер научился очищать соли кристаллизацией. Для этого Глаубер растворял их по нескольку раз в воде, а потом оставлял кристаллизоваться. Как только чистота образовавшихся кристаллов удовлетворяла его полностью, он отделял их от раствора и помещал в банки.
Слайд 28Глауберу был известен секрет получения еще одной кислоты, которую он называл "спиритус
Глауберу был известен секрет получения еще одной кислоты, которую он называл "спиритус

С помощью соляной кислоты Глаубер получил кристаллы солей многих известных тогда металлов.
Нагревая смесь поваренной соли и песка со "спиритус нитри", Глаубер получил желтовато-коричневую жидкость, которую алхимики называли "аква региа" (царская водка). Однако она была концентрированней и действовала сильнее, чем жидкость получаемая общеизвестным в то время способом - нагреванием азотной кислоты и хлористого аммония. Упаривая раствор золота Глаубер получил темно-коричневые кристаллы (треххлористое золото).
Слайд 29Нагревая мочу, смешанную с известью, ученый получил газ, который назвал "аммиак". Этот
Нагревая мочу, смешанную с известью, ученый получил газ, который назвал "аммиак". Этот

В саду Глаубер выращивал и лекарственные растения. Из листьев, веток, плодов и корней он извлекал ядовитые вещества. Он знал, что в очень малых количествах эти яды могут действовать и как лекарства. Он заливал измельченные растения "спиритусом нитри" (азотной кислотой), через несколько дней процеживал раствор и прибавлял "ликвор нитри фикси" (углекислый калий). На дне сосуда образовывался тонкий осадок. Эти вещества мы теперь называем алкалоидами. В наши дни стрихнин, бруцин, морфин и другие подобные вещества извлекают почти также, как это делал в свое время Глаубер.
Глаубер получал и продавал большое количество селитры. Его описание рецепта подтверждает, что Глаубер имел некоторые представления о реакциях, идущих до конца, о состоянии равновесия и о нейтральных средах. Об окончании реакции он судил по "звуковому индикатору": должны перестать лопаться пузырьки выделяющегося углекислого газа.
Слайд 30Глаубер впервые применил стекло для изготовления химической посуды. Ему пришлось освоить стеклодувное
Глаубер впервые применил стекло для изготовления химической посуды. Ему пришлось освоить стеклодувное

Занимаясь изготовлением химической стеклянной посуды для опытов, он случайно обнаружил, что небольшие добавки в стекло других веществ сильно меняют его цвет (точнее, его ученик-стеклодув использовал не очень чистое сырье и получил чуть окрашенное стекло, а Глауберг стал искать причину этого). Экспериментируя, он получил цветные стекла, имитирующие драгоценные камни (например, красное как рубин - добавив в стекло соли золота).
К сожалению, его здоровье сильно ухудшилось и в начале 1660 года даже неступил частичный паралич ног. Глаубер похудел, кожа на лице стала изжелто-серой...
Все помощники покинули ученого, остался лишь один, и то из-за того, что хотел узнать секреты учителя.
В следующем году Глауберу удалось отпечатать семь томов своего труда "Оперы омниа", где он описал все составы и наблюдения, сделанные им за многолетнее служение науки.
С каждым днем Глауберу становилось все хуже. Разочаровавшись молодой Гейнс тоже покинул учителя. Умер ученый в полном одиночестве. Его похоронили 10 марта 1668 года на кладбище Вестер-Керка, неподалеку от Амстердама.
Слайд 31Открытия и достижения
Иоганн-Рудольф Глаубер получил:
"Ацидум олеум витриоли" - концентрированную серную кислоту
"синий витриол"
Открытия и достижения
Иоганн-Рудольф Глаубер получил:
"Ацидум олеум витриоли" - концентрированную серную кислоту
"синий витриол"

"белый витриол", растворяя "цинковую золу" (окись цинка в серной кислоте).
мог получать серную кислоту перегонкой "зеленого витриола"(зеленого камня), квасцов, или "белого витриола"(сульфата цинка).
"спиритус нитри" (азотную кислоту) не из квасцов и селитры, а другим путем.
научился очищать соли кристаллизацией
"спиритус салис" (соляная кислота)
кристаллы солей многих известных тогда металлов
желтовато-коричневую жидкость, которую алхимики называли "аква региа" (царская водка)
темно-коричневые кристаллы (треххлористое золото).
Слайд 32"аммиак".
впервые применил стекло для изготовления химической посуды
обнаружил, что небольшие добавки в стекло
"аммиак".
впервые применил стекло для изготовления химической посуды
обнаружил, что небольшие добавки в стекло

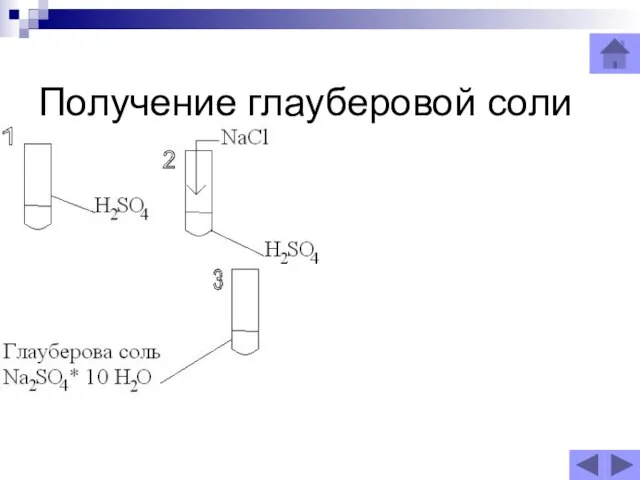
)Глауберову соль- сульфат натрия Nа2SO4 * 10H2O, взаимодействием Н2SO4 и NaCl
селитру
концентрированную уксусную кислоту СН3СООН из винного (этилового) спирта С2Н5ОН
выделил и использовал в медицинских целях фенол С6Н5ОН (карболовую кислоту) и ряд растительных алкалоидов.
Слайд 33Получение глауберовой соли
Получение глауберовой соли
Слайд 34Творческое задание
Найдите ответы на вопросы 1-8 в квадрате и из оставшихся букв
Творческое задание
Найдите ответы на вопросы 1-8 в квадрате и из оставшихся букв

Кем был отец Иоганна Глаубера?
Куда в 1625 году отправился Глаубер?
Секрет получения какой кислоты был известен Иоганну Глауберу?
Как звали аптекаря, который помог Глауберу, приняв его на работу?
Из какого материала Глаубер впервые начал делать химическую посуду?
Как звали швейцарца, который изучал воду целебного Нойштадского источника?
Фамилия одного автора этого кроссворда.
Фамилия другого автора этого кроссворда.
Слайд 35Ответы на задание
Цирюльник.
Вена.
Соляная.
Айснер.
Стекло.
Парацельс.
Сумбаев.
Ответы на задание
Цирюльник.
Вена.
Соляная.
Айснер.
Стекло.
Парацельс.
Сумбаев.
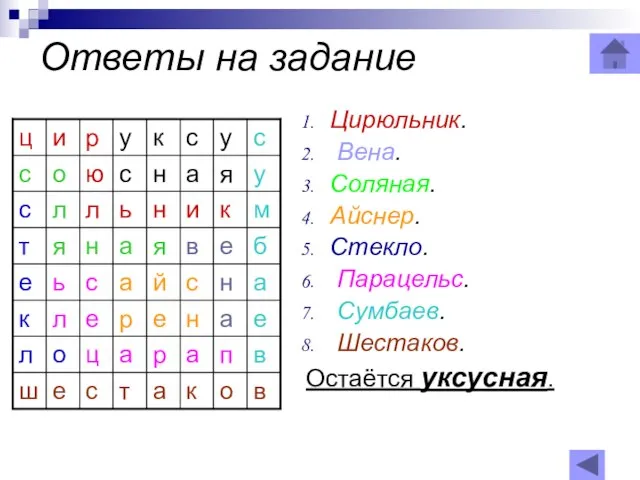
Шестаков.
Остаётся уксусная.
Слайд 36Реферат по химии на тему:
«Клод-Луи Бертолле»
Выполнили: ученики 8-1 класса МОУ «Лицей №3»
Реферат по химии на тему: «Клод-Луи Бертолле» Выполнили: ученики 8-1 класса МОУ «Лицей №3»

Французский химик и доктор медицины, член Парижской Академии Наук.
Слайд 37Основные исследования относятся к неорганической химии, химии растворов и сплавов.
Французский химик Клод-Луи
Основные исследования относятся к неорганической химии, химии растворов и сплавов.
Французский химик Клод-Луи

Бертолле, родина которого - Таллуар в Савойе, изучал медицину в Турине, где в 1770 году получил степень доктора. Работая в аптеках, увлекся химией и в 1772 переехал в Париж для совершенствования образования. Посещал лекции в Парижском университете, получил место помощника в университетской лаборатории. С 1794 Бертолле - профессор химии н Нормальной школе и Политехи и ческой школе. В 1796 - представитель наполеоновской миссии в Италии, а к 1798-1799 - участник Египетской экспедиции Бонапарта. В Египте на него был возложен контроль за подготовкой вывозимого из Египта сырья для химической промышленности. Из экспериментальных работ Бертолле наиболее значительны те, что связаны с изучением хлора.
Слайд 38Восемнадцатый век был богат химическими открытиями Ученые освобождались от мистических поисков философского
Восемнадцатый век был богат химическими открытиями Ученые освобождались от мистических поисков философского

Ученый применил на практике открытое К.Шееле белящее действие хлора для отбеливания тканей, воска, бумаги (1785). Метод Бертолле вскоре вытеснил все Другие способы обесцвечивания тканей.
В 1786 установил состав синильной кислоты HCN, а затем другой бескислородной кислоты - сероводорода H;S.
Слайд 39После 1786 года сблизился с Лавуазье; вместе с ним и еще двумя
После 1786 года сблизился с Лавуазье; вместе с ним и еще двумя

В 1788 г. Бертолле открыл нитрид серебра ("гремучее серебро"). Описал Титрование - это добавление в исследуемую пробу раствора реагента,
Совместно с Лавуазье и другими учеными в 1789 Бертолле основал журнал "Annales de Chimie".
На основании наблюдений за процессами выпадения осадков из растворов пришел к выводу о зависимости направления реакций и состава образующихся соединений от массы реагентов и условий реакций (1801)
Наблюдая за условиями образования соды в соляных озерах но время египетской экспедиции, он пришел к выводу, что направление химических реакций зависит от массы веществ и 1аких физических свойств, как летучесть, растворимость, упругость, а также от условий, в которых эти реакции протекают, "Ухо привело его к идее химического сродства, которое Бертолле считал пропорциональным массам реагирующих веществ. Свои представления о химическом сродстве ученый изложил в труде «Опыт химической статики» (Essai de statique chimique, 1803).
Слайд 40Поставив большое количество опытов, Бертолле показал, что реакции не идут до конца
Поставив большое количество опытов, Бертолле показал, что реакции не идут до конца

В 1800-1808 гг. вел длительную полемику С Ж.-Л. Прустом по вопросу о возможном непостоянстве состава соединений и вариации сил химического взаимодействия атомов в частице соединения. Эта полемика закончилась поражением Бертолле. Но идеи о вариации сил химической связи получили подтверждение уже в середине XIX в. в работах А. М. Бутлерова, а соединения переменного состава ("бертоллиды") были открыты в XX в. Н. С. Курнаковым. В настоящее время химия конденсированного состояния, по словам Курнакова, во многом "базируется на законах, предвиденных Бертолле".
Бертолле был основателем Аркейского общества, труды которого выходили в свет с 1807 по 1817 г. Он умер в 1822 г. в Аркейе, где располагалась созданная им лаборатория.
Умер Бертолле в Аркейе 6 ноября 1822.
Слайд 41Реферат по химии на тему:
«Йенс Якоб Берцелиус»
Выполнили ученицы 8-1 класса МОУ г.Гатчины
Реферат по химии на тему: «Йенс Якоб Берцелиус» Выполнили ученицы 8-1 класса МОУ г.Гатчины

Содержание
Иенс Якоб Берцелиус. Биография
Труды Берцелиуса
Открытие элементов
Заключение
Список литературы
Слайд 42Иенс Якоб Берцелиус. Биография
Шведский химик Йене Якоб Берцелиус (20 августа 1779. селение
Иенс Якоб Берцелиус. Биография
Шведский химик Йене Якоб Берцелиус (20 августа 1779. селение

Слайд 43После окончания университета Берцелиус некоторое время занимался частной врачебной практикой, затем стал
После окончания университета Берцелиус некоторое время занимался частной врачебной практикой, затем стал

1806г. - Берцелиус стал штатным преподавателем химии в высшей школе.
1807г. - он был утвержден ординарным профессором химии и фармации медицинского факультета Королевского Медико-хирургического института в Стокгольме.
1810г. - Берцелиус избран Президентом шведской Академии наук
С 1818г - назначен ее непременным секретарем.
1818г. - Берцелиусу пожаловано дворянское звание.
1835г. -титул барона.
Слайд 44Для работы в Стокгольмской лаборатории Берцелиус отобрал нескольких талантливых химиков. Наиболее известными
Для работы в Стокгольмской лаборатории Берцелиус отобрал нескольких талантливых химиков. Наиболее известными

Берцелиус поддерживал тесные научные и личные связи с химиками многих стран. В 1820 он был избран иностранным почетным членом Петербургской Академии наук. Берцелиус был знаком со многими известными людьми своего времени. Во время пребывания на курорте в Карлсбаде (1821) он вместе с И. В. Гете совершал геологические экскурсии на гору Каммербюль, где познакомил Гете с основами анализа минералов при помощи паяльной трубки.
Берцелиус женился только в 55 лет на двадцатичетырехлетней Иоганне Элизабет, дочери своего старинного друга Поппиусз, государственного канцлера Швеции. Брак их был счастливым: но детей не было. В 1845 году состояние здоровья Берцелиуса ухудшилось После одного особенно сильного приступа подагры у него оказались парализованы обе ноги В августе 1848 года на семидесятом году жизни Берцелиус умер. Он похоронен на маленьком кладбище вблизи Стокгольма. В 1838 году в письме немецкому химику Юстусу Либиху Берцелиус писал: "При обсуждении вопросов науки не должно быть ни врагов, ни друзей. Если Вы боретесь против того, что считаете ошибочным, не обращайте внимания на личность ошибающегося"
Слайд 45Труды Берцелиуса
Берцелиус почти все научные исследования целиком посвятил химии, значительно продвинув вперёд
Труды Берцелиуса
Берцелиус почти все научные исследования целиком посвятил химии, значительно продвинув вперёд

Достаточно сказать, что именно Берцелиус предложил буквенные символы для обозначения отдельных химических элементов и первый стал применять химические формулы для представления реакций(натрий - Na,алюминий - А1;соляная кислота - НС!; вода – Н2О). Предложенный Берцелиусом способ быстро распространился и вскоре стал международным языком химиков всего мира.
Для обозначения химических элементов Берцелиус предложил использовать начальные буквы их латинских названий (например: цирконий-Zr) (1814г). Он ввел первые формулы химических соединений (1817-30) По его мнению, для обозначений химических соединений следовало использовать буквы и цифры, чтобы их легко можно было писать и печатать. Они должны были наглядно отражать соотношения элементов в соединениях, указывать относительные количества составных частей, образующих вещество, и, наконец, выражать численный результат анализа так же просто и понятно, как алгебраические формулы.
Слайд 46Берцелиус определил атомные веса всех известных в его время химических элементов.
Ему
Берцелиус определил атомные веса всех известных в его время химических элементов.
Ему

Ему удалось идентифицировать атомные массы 45 химических элементов, которые в 1818г. были опубликованы в виде таблицы. Он не пользовался понятием , а рассматривал молекулы как атомы различной степени сложности
Берцелиус дал более точные определения атомных масс. Уже до него Дальтон пользовался атомной теорией для новой химической символики. Дальтон отбросил использующиеся в то время химические знаки, которые не отражали количественного состава соединений, и предложил для каждого элемента символ, обозначающий его атом. Однако, формулы, предложенные Дальтоном, не всегда давали представление об истинном числе атомов, образующих соединение; количественный элементарный анализ позволял ученому лишь судить об относительных массах элементов, входящих в состав соединения, ио времени публикации своих первых работ Берцелиус поддерживал тесные личные связи с химиками во многих странах, что помогало ему создать четкое представление о мировом уровне разработки научных проблем Берцепиусом были подвергнуты анализу 2000 соединений, образованных 43 элементами.
Слайд 47Результатом работ было усовершенствование старых и создание новых методов анализа, изобретение новых
Результатом работ было усовершенствование старых и создание новых методов анализа, изобретение новых

В результате этих исследований Берцелиус значительно уточнил величины атомных масс, определенные Дальтоном. Тем самым были созданы предпосылки систематизации элементов на основе их атомных масс. Эти тщательно выполненные исследования позволили Берцелиусу сделать атомистическую модель основной химии.
Слайд 48Доказал, что соли возникают путем соединения кислот со щелочами (пример HCI +
Доказал, что соли возникают путем соединения кислот со щелочами (пример HCI +

Ввел в химию понятия изомерии (от isos -равный и греч. meros - доля, часть) химических соединений - явление, заключающееся в существовании веществ, одинаковых по составу и молекулярной массе, но различающихся по строению или расположению атомов в пространстве и вследствие этого по физическим и химическим свойствам. Такие вещества называются изомерами. Ввел понятие катализа. Катализ(от греч katalysis -разрушение), изменение скорости химических реакций в присутствии веществ (катализаторов).вступающих в промежуточное химическое взаимодействие с реагирующими веществами, но восстанавливающих после каждого цикла промежуточных взаимодействий свой химический состав. Ввел понятие аллотропии. Аллотропия (от греч. allos - другой и tropos – поворот, свойство) – существование одного и того же химического элемента в виде двух или нескольких простых веществ, различных по строению и свойствам, так называемых аллотропических модификаций. Усовершенствовал методы химического анализа, применив спиртовую горелку и фильтровальную бумагу.
Слайд 49Открытие тория
Торий - один из немногих радиоактивных элементов, открытых задолго до появления
Открытие тория
Торий - один из немногих радиоактивных элементов, открытых задолго до появления

Выдающегося шведского ученого Йенса Якоба Берцелиуса справедливо называли некоронованным королем химиков первой половины XIX столетия Человек энциклопедических знаний и превосходный аналитик, Берцелиус работал очень плодотворно и почта никогда не ошибался. Авторитет его был так высок, что большинство
химиков его времени, прежде чем обнародовать результат какой-либо важной работы, посылали сообщение о ней в Стокгольм, к Берцелиусу
Но при открытии тория непогрешимый Берцепиус совершил две ошибки В 1815 году, анализируя редкий минерал, найденный в округе Фалюн (Швеция), Берцепиус обнаружил в нем окись нового элемента. Этот элемент был назван торием, в честь всемогущего древнескандинавского божества Тора. (По преданию Тор был коллегой Марса и Юпитера - одновременно богом, войны, грома и молнии.) Прошло десять лет, прежде том Берцелиус обнаружил свою ошибку: вещество, которое он считал окисью тория: на самом деле оказалось фосфатом уже известного иттрия.
Слайд 50"Похоронив" торий. Берцелиус же его "воскресил". Через три года из Норвегии ему
"Похоронив" торий. Берцелиус же его "воскресил". Через три года из Норвегии ему

Чистый препарат тория был получен лишь в 1882 году другим известным шведским химиком - первооткрывателем скандия Ларсом Фредериком Нипьсоном.
Слайд 51История открытия селена
Селен (англ. Selenium, франц. Selenium, нем. Selren) открыт Берцелиусом в
История открытия селена
Селен (англ. Selenium, франц. Selenium, нем. Selren) открыт Берцелиусом в

Слайд 52Любопытство, вызванное надеждой обнаружить в этом коричневом осадке новый редкий металл, заставило
Любопытство, вызванное надеждой обнаружить в этом коричневом осадке новый редкий металл, заставило

нашел что масса (те осадок) содержит до сих пор неизвестный металл, очень похожий по своим свойствам на теллур. В соответствии с этой аналогией Берцелиус назвал новое тело селеном (Selenium) от греч. -луна, так как теллур назван по имени Tellus (Теллус)- нашей планеты".
Таким образом, название селен как бы подчеркивает, что этот элемент - спутник Теллура, подобно тому, как Луна спутник Земли. Добавим к этому, что Берцелиусу пришлось провести большое сравнительное исследование реакций селена и теллура В русской литературе первых десятилетий XIX в селен называли селением (Соловьев и Двигубский. 1824, Гесс, 1831), Страхов употребляет название сепин (1825). После 1835 г было принято название селен.
Слайд 53Открытие кремния
Несмотря на распространенность в природе, этот элемент открыли сравнительно поздно. В
Открытие кремния
Несмотря на распространенность в природе, этот элемент открыли сравнительно поздно. В

SiF6 + 4K = 6KF + Si.
Новый элемент был назван силицием (от латинского silex -кремень). Русское название этого элемента появилось спустя девять лет в 1834 г. и благополучно дожило, в отличие, скажем, от <буротвора>, до наших дней.
Слайд 54История открытия Титана
Много лет считалось, что металлический титан впервые был получен Берцелиусом
История открытия Титана
Много лет считалось, что металлический титан впервые был получен Берцелиусом

Слайд 55Открытие Циркония
Через 35 лет после опытов Клапрота Йенсу Якобу Берцелиусу удалось получить
Открытие Циркония
Через 35 лет после опытов Клапрота Йенсу Якобу Берцелиусу удалось получить

K2[ZrF6] + 4Na = Zr + 2KF + 2NaF
Берцелиус получил серебристо-серый металл. Цирконий, образовавшийся в результате этой реакции, был хрупким из-за значительного содержания примесей. Металл не поддавался обработке и не смог найти практического применения. Но можно было предположить, что очищенный цирконий, подобно многим другим металлам, окажется достаточно пластичным
В XIX и начале XX в. многие ученые пытались получить чистый цирконий, но все попытки долгое время заканчивались неудачей Не помог испытанный алюмотермический метод, не привели к цели опыты, авторы которых стремились получить металлический цирконий из растворов его солей. Последнее объясняется в первую очередь высоким химическим сродством циркония к кислороду.
Слайд 56Для того чтобы можно было получить какой-либо металл электролизом из раствора его
Для того чтобы можно было получить какой-либо металл электролизом из раствора его

В водном растворе гидролизуется и хлористый цирконий: ZrCI4 + Н2О = ZrOCI3 + 2HCI
Некоторые исследователи считали, что им удалось-таки получить цирконий электролизом растворов, но они были введены в заблуждение задом продуктов, осевших на электродах. В одних случаях это были действительно металлы, но не цирконий, а никель или медь, примеси которых содержались в циркониевом сырье, в других - внешне похожая на металл гидроокись циркония.
Лишь в 20-х годах нашего столетия (через 100 лет после того как Берцелиус получил первые образцы циркония!) был разработан первый промышленный способ получения этого металла.
Это метод . разработанный голландскими учеными ван Аркелем и де Буром Суть его заключается в том, что летучее соединение (в данном случае тетрайодид циркония Zrl4) подвергается термическому распаду в вакууме и на раскаленной нити вольфрама откладывается чистый цирконий.
Этим способом был получен металлический цирконий, поддающийся обработке - ковке, вальцовке, прокатке - примерно так же легко, как медь.
Слайд 57Заключение
Начиная с 1811 Берцелиус занимался систематическим определением элементного состава органических соединений и
Заключение
Начиная с 1811 Берцелиус занимался систематическим определением элементного состава органических соединений и

Берцелиус обобщил (1835) все известные результаты каталитических исследований, предложил термин для обозначения (катализаторов) в химических реакциях. Он ввел понятие , аналогичное современному понятию . Выдвинул (1841) представления об аллотропии.
Слайд 58Берцелиус сконструировал и изготовил многочисленные приборы из стекла. Он сам был великолепным
Берцелиус сконструировал и изготовил многочисленные приборы из стекла. Он сам был великолепным

Берцелиус опубликовал около 250 научных работ. Начиная с 1821, он регулярно издавал ежегодные обзоры успехов химии и физики (всего 27 томов), на страницах которых происходили научные дискуссии В течение многих лет эти играли роль важнейшего международного журнала. Написанный Берцелиусом многотомный первый том был изложением материала. При жизни автора этот учебник выдержал пять изданий (каждый раз в переработанном и расширенном виде) и был переведен на многие языки - французский, итальянский, английский, голландский, немецкий
Существенное значение для превращения химии в точную науку имело усовершенствование Берцелиусом химической номенклатуры и создание им символики, близкой к современным обозначениям элементов и их соединений. Она заменила символику Дальтона, в которой чувствовалось влияние алхимических знаков.
Слайд 59Созданный Берцелиусом "химический язык" позволил простым и наглядным способом сопоставить особенности химических
Созданный Берцелиусом "химический язык" позволил простым и наглядным способом сопоставить особенности химических

В результате своих работ Берцелиус открыл несколько новых элементов. Будучи одним из лучших знатоков химии своего времени. Берцелиус объяснил с единой точки зрения многие факты и понятия, ранее казавшиеся не связанными друг с другом. Так, даже горные породы и минералы подаренной ему коллекции Берцелиус расположил не в соответствии с общепринятой тогда кристаллографической систематизацией Р Ж. Акои, а по их химическому составу
Создание новых основных понятий, таких как, изомерия и полимерия, значительное совершенствование химической символики и номенклатуры оказала существенное влияние на развитие современной химии.
Слайд 60Список литературы
К Хайгинг "Биографии великих химиков" Мир 1981г.
Я. Голованов "Этюды об ученых"
Список литературы
К Хайгинг "Биографии великих химиков" Мир 1981г.
Я. Голованов "Этюды об ученых"
М-Джуа " История химии" Мир 1975
К. Манопов "Великие химики'1 Мир 1976
В Рич " Охота за элементами" Химия 1982
В Криуман "Создатели атомно-молекулярного учения" Просвещение 1976
А Азимов " Краткая история химии" Мир 1983
Слайд 61Реферат по химии на тему:
«Анри Луи ле Шателье»
Выполнили: ученики 8-1 класса МОУ
Реферат по химии на тему: «Анри Луи ле Шателье» Выполнили: ученики 8-1 класса МОУ

1850 – 1936
Слайд 62Биография
Анри Луи Ле Шателье родился 8 октября 1850 года в Париже. Его
Биография
Анри Луи Ле Шателье родился 8 октября 1850 года в Париже. Его

После окончания Политехнической школы в 1869 году он поступил в Высшую Национальную горную школу. Затем был горным инженером в Алжире и Безансоне.
Будущий открыватель знаменитого принципа был широко образованным и эрудированным человеком. Его интересовали и техника, и естественные науки, и общественная жизнь. Много времени он посвятил изучению религии и древних языков. В возрасте 27 лет Ле-Шателье стал уже профессором Высшей горной школы, а тридцать лет спустя - Парижского университета. Тогда же он был избран в действительные члены Парижской Академии
Слайд 63Научные исследования
Научные исследования учёного относятся к физической химии. Совместно с Пьером
Научные исследования
Научные исследования учёного относятся к физической химии. Совместно с Пьером

Слайд 64Химическое равновесие
Наиболее важный вклад французского учёного в науку был связан с изучением
Химическое равновесие
Наиболее важный вклад французского учёного в науку был связан с изучением

Студенты Сорбонны, слушавшие лекции Ле-Шателье в 1907-1908 годах, так записывали в своих конспектах: "Изменение любого фактора, могущего влиять на состояние химического равновесия системы веществ, вызывает в ней реакцию, стремящуюся противодействовать производимому изменению. Повышение температуры вызывает реакцию, стремящуюся понизить температуру, то есть идущую с поглощением тепла. Увеличение давления вызывает реакцию, стремящуюся вызвать уменьшение давления, то есть сопровождающуюся уменьшением объема...".
Слайд 65Сейчас закон Ле-Шателье формулируется в общем виде следующим образом: внешнее воздействие (изменение
Сейчас закон Ле-Шателье формулируется в общем виде следующим образом: внешнее воздействие (изменение

Рассмотрим для примера реакцию синтеза аммиака:
N2 + 3H2 = 2NH3+Q.
Прямая реакция является реакцией соединения, так как из двух простых веществ - азота и водорода - образуется одно сложное вещество - аммиак. Обратная реакция относится к реакциям разложения. Обе реакции протекают в присутствие катализатора (платина или железный катализатор с добавками оксидов калия и алюминия). Прямая реакция протекает с образованием теплоты, поэтому относится к экзотермическим реакциям, а обратная реакция протекает с поглощением теплоты и является эндотермической.
Слайд 66Рассмотрим, как применим принцип Ле Шателье для смещения равновесия реакции синтеза аммиака.
-
Рассмотрим, как применим принцип Ле Шателье для смещения равновесия реакции синтеза аммиака.
-

изменение давления: синтез аммиака сопровождается уменьшением объёма (из четырёх молей исходных веществ образуется только два моля аммиака), в закрытом аппарате продукты этой реакции создают меньшее давление, чем создавали исходные вещества. Следовательно, прямая реакция сопровождается понижением давления. И наоборот, обратная реакция ведёт к увеличению числа газообразных молекул и к увеличению давления. При сжатии реакционной смеси равновесие смещается в сторону образования аммиака, так как этот процесс приводит к уменьшению давления, то есть противодействует внешнему воздействию. Наоборот, уменьшение давления смещает равновесие влево (разложение аммиака).
изменение температуры: при повышении температуры равновесие этой реакции сместиться влево, в направлении реакции разложения аммиака, которая проходит с поглощением теплоты и поэтому ослабляется внешним воздействием - повышением температуры. При охлаждении реакционной смеси равновесие смешается вправо, в направлении реакции синтеза аммиака, так какэта реакция идёт с выделением теплоты и противодействует охлаждению.
Слайд 67Синтез аммиака идёт в гигантских колоннах синтеза, куда с помощью компрессора подаётся
Синтез аммиака идёт в гигантских колоннах синтеза, куда с помощью компрессора подаётся

Закон Ле Шателье нашел широкое применение при проведении разнообразных лабораторных и особенно промышленных процессов, где от направленного получения полезного продукта зависит экономическая эффективность технологического процесса. Изменяя условия протекания процесса, можно добиться резкого увеличения выхода необходимого продукта.
Слайд 68Всю жизнь Ле Шателье посвятил исследованиям, важным для развития промышленности, и изучал
Всю жизнь Ле Шателье посвятил исследованиям, важным для развития промышленности, и изучал

В 1897 году учёный создал металлографический микроскоп, который даёт возможность судить о структуре металлов и сплавов, и усовершенствовал методику их исследований, изучал свойства и способы приготовления цементов. В 1887 году Ле Шателье изобрёл платино-радиевую термопару, состоящую из 90% чистой платины и 10 % сплава платины с радием, и доказал, что термопара даёт возможность измерять температуры до 1200° с точностью до 10°С.
Ле Шателье - Президент Французского химического общества (1931г.), член многих академий наук и научных обществ, иностранный член-корреспондент Петербургской Академии Наук с 1913 года и почетный член Академии Наук СССР с 1926 г.
Слайд 69Умер Ле Шателье в Мирибель-Лез-Эшель 17 сентября 1936.
К сожалению, Ле Шателье не
Умер Ле Шателье в Мирибель-Лез-Эшель 17 сентября 1936.
К сожалению, Ле Шателье не

Слайд 70Список использованной литературы
. А. Крицман, В. В. Станцо. Энциклопедический словарь юного
химика.
Список использованной литературы
. А. Крицман, В. В. Станцо. Энциклопедический словарь юного химика.

В. А. Воинов, Е. В. Вонский, Г.И. Кузнецова. Химики. Биографический справочник.- Киев. Наукова Думка. 1984.
3 К. Манолов. Великие химики. - Москва, 1985
Слайд 71Реферат по химии на тему:
«Джозеф Пристли» Выполнили ученицы 8-1 класса МОУ г.Гатчины
Реферат по химии на тему: «Джозеф Пристли» Выполнили ученицы 8-1 класса МОУ г.Гатчины
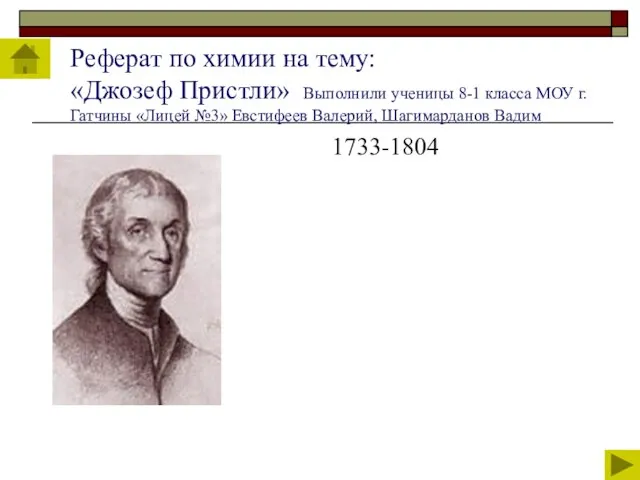
1733-1804
Слайд 72БИОГРАФИЯ ДЖОЗЕФА ПРИСТЛИ
Джозеф Пристли ( 1733-1804) - английский священник, химик,
философ, общественный
БИОГРАФИЯ ДЖОЗЕФА ПРИСТЛИ
Джозеф Пристли ( 1733-1804) - английский священник, химик, философ, общественный

Джозеф Пристли учился в школе Бэтли , где углублённо изучал латинский и греческий языки. После небольшого перерыва в обучении, связанного с болезнью, Пристли решил посвятить свою жизнь служению церкви. К этому времени он уже достаточно преуспел в изучении других языков и знал французский, немецкий. итальянский, арабский и даже халдейский
Слайд 73Начало научной деятельности и религиозные искания Джозефа Пристли
Разочарование в кальвинизме стало
Начало научной деятельности и религиозные искания Джозефа Пристли
Разочарование в кальвинизме стало

Спустя три года он стал священником в Наптвитчс, с последующим переходом в 1761 г. в Уорриштонскую академию в качестве преподавателя иностранных языков и литературы. В академии Джозеф Пристли увлёкся изучением химии, в чём ему помогал Мэтью Тернер, специально приглашенный для чтения лекций покровителем академии Джоном Шеддоном. Работая в Уоррингтоне, Джозеф Пристли написал курс Основы английской грамматики ,который был опубликован и использовался как учебник в течение почти 50 лет.
Слайд 74В 1762 г. Джозеф Пристли был посвящен в духовный сан, и в
В 1762 г. Джозеф Пристли был посвящен в духовный сан, и в

Слайд 75Научные достижения и открытия Джозефа Пристли
Следует отметить, что глубокая вера в Бога
Научные достижения и открытия Джозефа Пристли
Следует отметить, что глубокая вера в Бога

Слайд 76Открытие углекислого газа
По соседству с домом Джозефа Пристли находилась пивоварня, куда
Открытие углекислого газа
По соседству с домом Джозефа Пристли находилась пивоварня, куда

Хотя углекислый газ уже был открыт в 1754 г. Джозефом Блэком , более подробно изучил его и выделил в чистом виде именно Пристли. Ему же принадлежит открытие в 1771 г. роли углекислого газа в дыхании растений. Пристли заметал, что зеленые растения на свету продолжают жить в атмосфере этого газа и даже делают его пригодным для дыхания. Классический опыт Пристли с живыми мышами под колпаком, где воздух «освежается» зелеными ветками, вошел во все элементарные учебники естествознания и лежит у истоков учения о фотосинтезе.
Слайд 77Изобретение газированной воды и ластика
Открытие способа газирования воды было сделано очень
Изобретение газированной воды и ластика
Открытие способа газирования воды было сделано очень

книга Изготовление карбонированной воды , с которой собственно и началось распространение газированной воды по всему свету. За эту работу Пристли был удостоен медали Лондонского Королевского общества.
Слайд 78С именем Пристли связано ешё одно чудесное изобретение, без которого нельзя в
С именем Пристли связано ешё одно чудесное изобретение, без которого нельзя в

Слайд 79Открытие закиси азота
Анестезиологам всего мира имя Джозефа Пристли в первую очередь
Открытие закиси азота
Анестезиологам всего мира имя Джозефа Пристли в первую очередь

Действуя разбавленной азотной кислотой на медь, он впервые получил «селитряный воздух» - окись азота (NO). Химическая реакция открытия этого газа выглядела следующим образом:
3Cu + 8НNO3 = 3Cu(NO3)2 + 2NO + 4Н2О
Слайд 80На воздухе этот бесцветный газ бурел, I превращаясь в диоксид азота (N02).
На воздухе этот бесцветный газ бурел, I превращаясь в диоксид азота (N02).

2N0 + О2 = 2NO2.
Следовательно, речь шла уже о новом газе. И действительно, в указанном Пристли опыте получается закись азота, образующаяся по реакции:
6NO + 2Fe + 3H2O = 3N2O + 2Fe(OH)3
вследствие процесса восстановления NO под действием увлажненного железа. Состав этой реакции был установлен знаменитым химиком Гемфри Дэви (1778-1829) только в 1800 г, Потребовалось еще 75 лет с момента открытия Пристли, чтобы это соединение вошло в практику в качестве наркозного средства. По-иному сложилась история также открытой Пристли окиси азота (N0), которая привлекла всеобщее внимание лишь в XX веке, причем огромный интерес к ней проявляют и специалисты МКС.
Слайд 81Открытие аммиака и хлористого водорода
Следующим его открытием был «щелочной воздух» -
Открытие аммиака и хлористого водорода
Следующим его открытием был «щелочной воздух» -

(гашеная известь), и внезапно ощутил резкий запах нового вещества. Этот запах усиливался при нагревании смеси. Когда Пристли попытался собрать летучий продукт реакции:
2МН4С1 + Са(ОНЬ = CaCb + 2NH3 + 2Н2О
вытесняя им воду из перевернутого сосуда, то выяснилось, что новый газ тотчас растворяется в ней. Это и был аммиак.
С тех пор реакцию, открытую Пристли, используют во всех лабораториях мира для получения аммиака. Позднее ученый стал собирать аммиак над жидкой ртутью, в которой этот газ практически нерастворим.
Слайд 82По другой легенде это открытие произошло следующим образом. Однажды Пристли оставил рядом
По другой легенде это открытие произошло следующим образом. Однажды Пристли оставил рядом

Позднее состав аммиака установил французский химик Клод Бертолле в 1784 г.
В 1772-1774 II. Джозеф Пристли детально исследовал полученный им при взаимодействии поваренной соли и серной кислоты «солянокислый воздух» - хлористый водород, который он собрал над ртутью. Кроме того, с именем Пристли связаны открытия фтористого кремния и сернистого газа. Однако наибольшую известность ему принесло великое открытие кислорода
Слайд 83Великое открытие кислорода и
совсем немного о приоритете на право его открытия
Крупнейшим вкладом Пристли в
Великое открытие кислорода и
совсем немного о приоритете на право его открытия
Крупнейшим вкладом Пристли в

1 августа 1774 г. Джозеф Пристли наблюдал выделение «нового воздуха» при нагревании с помощью двояковыпуклой линзы без доступа воздуха ртутной окалины, находящейся под стеклянным
колпаком. Это твердое вещество было известно ещё алхимикам под названием «меркуриус кальцинатус пер се», или жжёная ртуть. На современном химическом языке это вещество называется оксидом ртути, а уравнение его разложения при нагревании выглядит следующим образом:
2 HgO = 2 Hg + О,
оксид
нагревание ртуть кислород
Получаемый при нагревании оксида ртути неизвестный ему газ он выводил через трубку в сосуд, заполненный не водой, а ртутью, так как Пристли уже ранее убедился в том, что вода слишком хорошо растворяет газы. В собранный газ Пристли из любопытства внес тлеющую свечу, и она вспыхнула необыкновенно ярко.
Слайд 84Вы можете теперь представить, как трудно было изучать химию
во времена, когда химические
Вы можете теперь представить, как трудно было изучать химию во времена, когда химические

До сих пор идут жаркие споры - кого надо считать первооткрывателем кислорода: Джозефа Пристли? Карла Вильгельма Шееле? Антуана Лавуазье?... Прекрасный ученый-экспериментатор, Пристли сам недооценивал и даже не вполне понимал некоторые сделанные им величайшие открытия. И в тды своей высшей славы Пристли считал, что открытый им кислород есть «дефлогистированнып воздух», тогда как азот «флогистированный воздух». Он держался этой концепции и на
склоне жизни, горячо отстаивая ее в немногих печатных памфлетах времён своего изгнания в Америку
Слайд 85Но в своих работах Джозеф Пристли был пионером и подлинным образцом объективного
Но в своих работах Джозеф Пристли был пионером и подлинным образцом объективного

Однако научные достижения Джозеф Пристли были замечены и оценены. В 1767 г. он был избран членом Лондонского королевского общества; в 1772 г. членом Парижской Академии наук; II сентября 1780 г. почетным членом Санкт-Петербургской Академии наук
 Максим Горький. «Старуха Изергиль» 1895год
Максим Горький. «Старуха Изергиль» 1895год Заповеди
Заповеди Презентация на тему Рождество в Германии
Презентация на тему Рождество в Германии Изобразительное искусство реализма
Изобразительное искусство реализма Социализация личности (формирование первоначальных представлений)
Социализация личности (формирование первоначальных представлений) Кто вьёт самые красивые гнёзда?
Кто вьёт самые красивые гнёзда? Сталинградская битва(17 июля 1942 – 2 февраля 1943)
Сталинградская битва(17 июля 1942 – 2 февраля 1943) Презентация на тему Как ориентироваться в лесу
Презентация на тему Как ориентироваться в лесу Доклад на тему Белл-ланкастерская система обучения
Доклад на тему Белл-ланкастерская система обучения Правовая система Австрии
Правовая система Австрии 2012 год планирование
2012 год планирование Разработка домашнего задания на тему: матрешка
Разработка домашнего задания на тему: матрешка История создания и интересные факты из жизни киностудии Союзмультфильм
История создания и интересные факты из жизни киностудии Союзмультфильм Храм. Алтарь
Храм. Алтарь Задание ПЗ Этап1
Задание ПЗ Этап1 Способы усиления железобетонных и каменных конструкций
Способы усиления железобетонных и каменных конструкций Презентация проекта «Топонимы малой родины»
Презентация проекта «Топонимы малой родины» Привычная и удивительная поваренная соль
Привычная и удивительная поваренная соль Циркулярные диски BOSCH
Циркулярные диски BOSCH «Математик- Бизнесмен »
«Математик- Бизнесмен » Бей в набат
Бей в набат Доклад: Расчет убытков правообладателей товарных знаков от неправомерных действий третьих лиц Автор : Костин Александр Валерьеви
Доклад: Расчет убытков правообладателей товарных знаков от неправомерных действий третьих лиц Автор : Костин Александр Валерьеви Диверсионный анализ
Диверсионный анализ Всероссийский телевизионный интернет-марафон "Финансовое просвещение из региона в регион" NON STOP
Всероссийский телевизионный интернет-марафон "Финансовое просвещение из региона в регион" NON STOP Столица символов (Олонец)
Столица символов (Олонец) Субкультури. Політичні субкультури
Субкультури. Політичні субкультури Ответственность несовершеннолетних за административные правонарушения и преступления по законодательству РФ
Ответственность несовершеннолетних за административные правонарушения и преступления по законодательству РФ Понятие общественность, общественное в контексте
Понятие общественность, общественное в контексте