Научно-исследовательский проект по химии Тема: Металлы и коррозия металлов Выполнил: ученик 10 класса Муллагалиев Ил
Содержание
- 2. Рецензия на научную исследовательскую работу «Металлы и коррозия металлов». Интерес данной работы заключается в том, что
- 3. Содержание Общая характеристика металлов. Физические свойства металлов. Химические свойства металлов. Коррозия металлов. Экспериментальная работа. Заключение. Использованная
- 4. Цели и задачи: Изучить о металлах (физические и химические свойства металлов). Практически ознакомится о свойствах железа,
- 5. Из 110 химических элементов-88 металлы.
- 6. Нахождение металлов в природе. Многие металлы находятся в составе руд и минералов: Бурый Магнитный Красный железняк
- 7. Боксит Малахит Халькопирит
- 8. Физические свойства металлов. Все металлы имеют металлические кристаллические решетки. Она обусловила важнейшие физические свойства металлов: пластичность,
- 9. Химические свойства металлов. Химические свойства металлов определяются слабой связью валентных электронов с ядром атома. Атомы сравнительно
- 10. Горение железа в кислороде: 3Fe+2O2=Fe3O4 (FeO Fe2O3 ) Горение железа в хлоре 2Fe+3Cl2 =2FeCl3
- 11. Взаимодействие металлов с водными растворами солей менее активных металлов можно иллюстрировать примером: Fe+CuS04=FeS04+Cu Руководствуясь рядом стандартных
- 12. При взаимодействии металлов с кислотами окислителем является ион водорода Н, который принимает электрон от металла. Металлы,
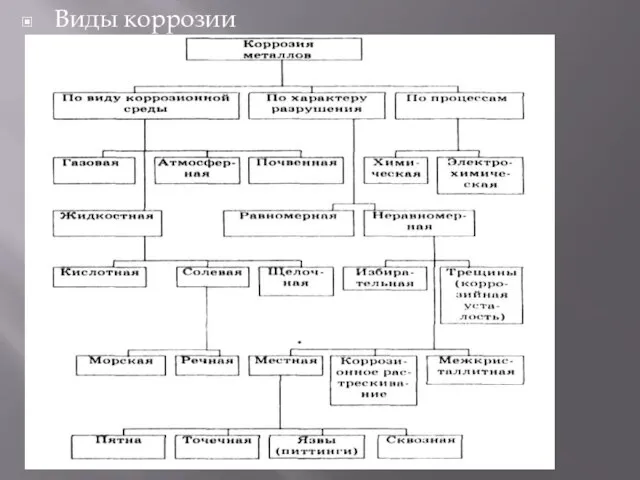
- 13. Коррозия металлов. Наиболее распространенная проблема металлов это коррозия. Термин коррозия происходит от латинского «corrosio», что означает
- 14. Виды коррозии
- 15. Способы защиты металла от коррозия. Применение ингибиторов – один из самых эффективных способов борьбы с коррозией
- 16. Ингибиторы. Эффективность действия ингибиторов зависит в основном от условий среды, поэтому универсальных ингибиторов нет. Для их
- 17. Экспериментальная работа. Чтобы изучить процесс коррозии мы провели экспериментальную работу. экспериментальная работа по исследованию процесса коррозии
- 18. Участок №1 – школьный химический кабинет. Температура постоянная, влажность небольшая, в воздухе возможны примеси летучих соединений.
- 19. Участок №3-берег реки Мензеля. Температура непостоянная, влажность повышенная, примеси в воздухе естественные. Участок №4-обочина трассы «поселок
- 20. Участок №5 - искусственное лесонасаждение. Температура непостоянная, влажность средняя, примеси в воздухе естественные для деревьев.
- 21. Результаты Первые проявления – слабые полоски ржавчины появились через 1 неделю на участке №5 у образцов
- 22. Только к концу третьей недели у образцов участка №4 появились признаки разрушающего сталь процесса. Коррозии подверглись
- 23. Выводы. Таким образом, проведя анализ полученных результатов, нами были сформулированы следующие выводы. 1. Газовая коррозия значительно
- 25. Скачать презентацию





















 Денежные переводы физических лиц: состояние и тенденции развития (на примере ПАО Сбербанк)
Денежные переводы физических лиц: состояние и тенденции развития (на примере ПАО Сбербанк) Особенности истории информатики
Особенности истории информатики Мотивирование топ-менеджеров в банковской сфере: подходы и инструменты
Мотивирование топ-менеджеров в банковской сфере: подходы и инструменты = 1
= 1 Изустная среда мордовского села
Изустная среда мордовского села Показатели рыночной активности
Показатели рыночной активности Выхухоль. Красная книга
Выхухоль. Красная книга Обработка текстовой и графической информации. Создаём комбинированный документ
Обработка текстовой и графической информации. Создаём комбинированный документ Телевидение: я выбираю или меня выбирают. Автор и руководитель проекта: Симонова Ольга Владимировна 2004 год
Телевидение: я выбираю или меня выбирают. Автор и руководитель проекта: Симонова Ольга Владимировна 2004 год Что я сделаю, чтобы доверенный мне магазин стал лучшим на рынке
Что я сделаю, чтобы доверенный мне магазин стал лучшим на рынке Туалетная вода для мужчин Faberlic Intense
Туалетная вода для мужчин Faberlic Intense Межпроцедурные анализы и оптимизации
Межпроцедурные анализы и оптимизации Внешняя политика СССР в 1930-е гг. и накануне Великой Отечественной войны
Внешняя политика СССР в 1930-е гг. и накануне Великой Отечественной войны Урок 3 Человек и Бог в православии-повторение
Урок 3 Человек и Бог в православии-повторение 17 век
17 век ПЕРЕГОВОРЫ
ПЕРЕГОВОРЫ Изготовление вечернего платья
Изготовление вечернего платья Теорiя iгор
Теорiя iгор  Презентация на тему Роль гормонов в обмене веществ, росте и развитии организма биология 8 класс
Презентация на тему Роль гормонов в обмене веществ, росте и развитии организма биология 8 класс аня хочет санчо панчо
аня хочет санчо панчо Создание таблиц в Microsoft Word
Создание таблиц в Microsoft Word Teenagers’ society problems
Teenagers’ society problems Воля познавать
Воля познавать Любимое блюдо моей семьи
Любимое блюдо моей семьи Ладья. Урок №8
Ладья. Урок №8 Описательные характеристики распределения тестовых результатов
Описательные характеристики распределения тестовых результатов Презентация на тему Одиночество
Презентация на тему Одиночество Ich gehe mit meine Laterne
Ich gehe mit meine Laterne