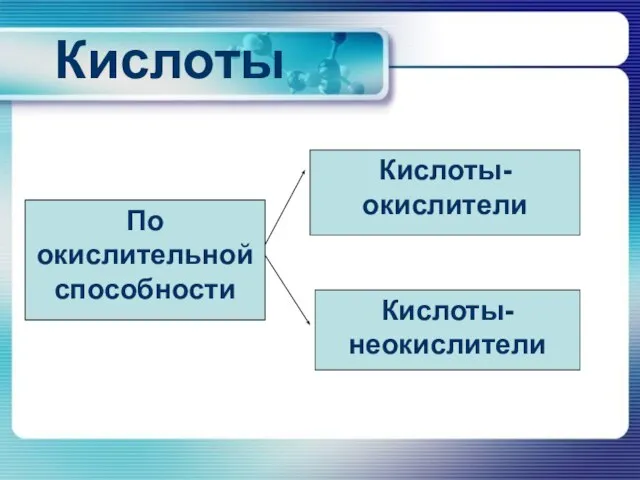
Слайд 2Кислоты
Высшим оксидам неметаллов соответствуют следующие кислоты

Слайд 3Высшим оксидам неметаллов соответствуют следующие кислоты
Слайд 4Кислоты
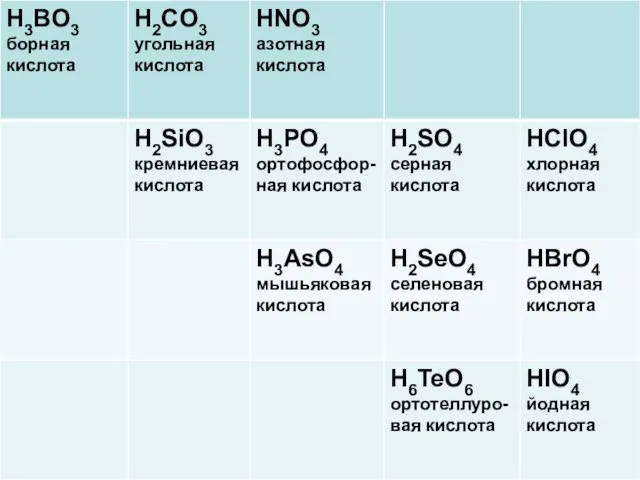
Кислородосодержащие кислоты являются гидроксидами кислотных оксидов.
По основности
одноосновные
двухосновные
трехосновные
четырехосновные
Слайд 5Кислоты
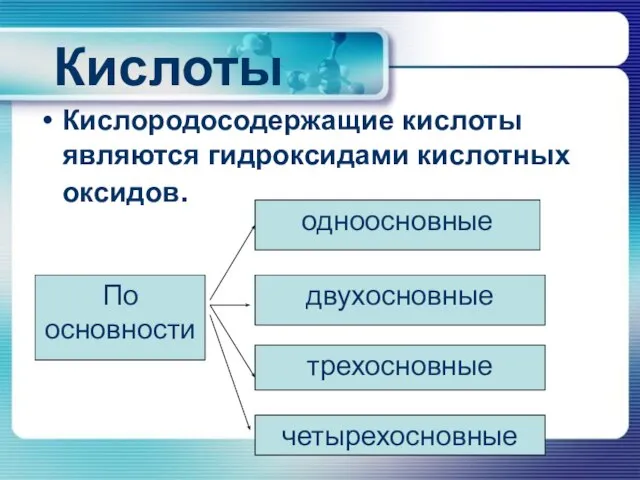
По силе
сильные
средней силы
слабые
Слайд 6Кислоты
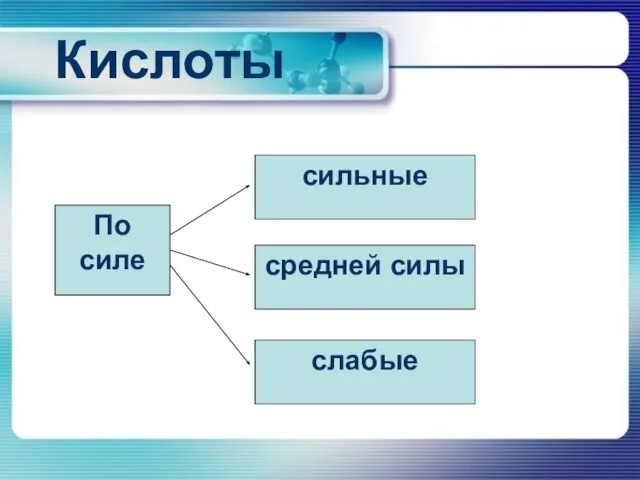
По окислительной способности
Кислоты-окислители
Кислоты-неокислители
Слайд 7Кислоты
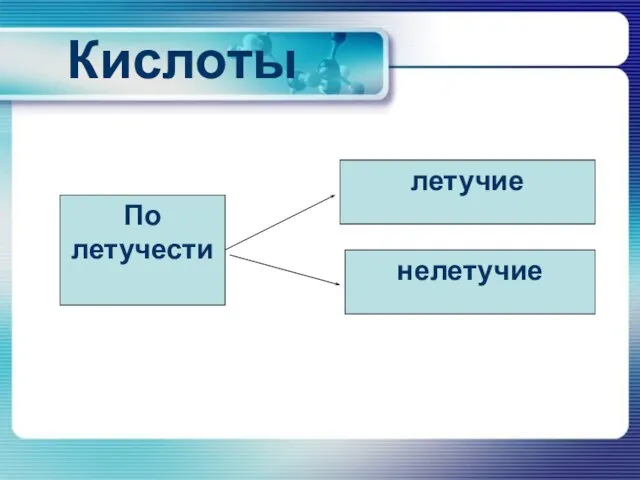
По летучести
летучие
нелетучие
Слайд 8Кислоты
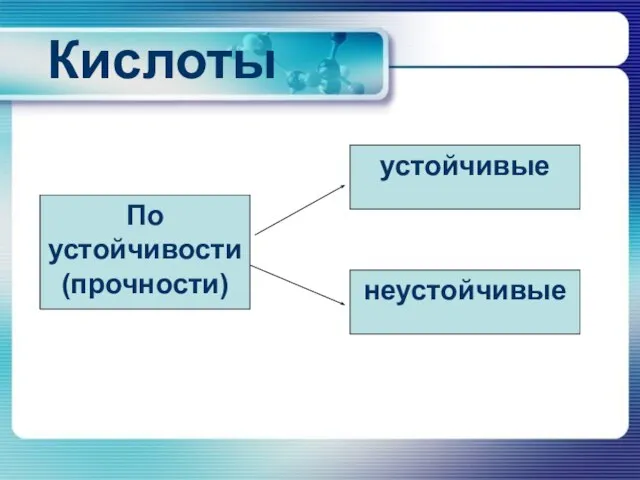
По устойчивости (прочности)
устойчивые
неустойчивые
Слайд 9Кислоты
Физические свойства
По агрегатному состоянию:
большинство кислот жидкости
некоторые растворы газов в воде (H2CO3,

H2SO3)
некоторые твердые вещества (H3PO4, H3BO3, HIO4)
Слайд 10Кислоты
Почти все кислоты хорошо растворимы в воде кроме H2SiO3
При растворении в воде

метакислоты переходят в ортокислоты
HPO3 + H2O =
Слайд 11Кислоты
Общие химические свойства кислот:
Попробуйте вспомнить и перечислите все химические свойства. Приведите пример

на каждое свойство (молекулярные и ионные уравнения).
Слайд 12Кислоты
Кислоты-неокислители взаимодействуют с металлами стоящими в ряду напряжений до водорода и образуется

водород и соль металла с низшей С.О.
Слайд 13Кислоты
Кислоты-окислители (H2SO4, HNO3) в водном растворе вступают в реакции практически со всеми

металлами (кр.Au, Pt ). В качестве окислителя выступает анион кислотного остатка. В результате этих реакций образуются соль металла в высшей С.О., вода и продукт восстановления кислоты.
Слайд 14Кислоты
Почти все кислоты разлагаются при нагревании.
Если при разложении не происходит ОВР, то

продуктами разложения являются вода и кислотный оксид(или кислота с меньшим содержанием H2O)
Слайд 15Кислоты
Если разложение ОВР, то продукты разнообразны:
4HNO3 = 4NO2 + O2 + 2H2O
3HNO2

= HNO3 + 2NO + H2O
3HClO = 2HCl + HClO3
4H3PO3 = 3H3PO4 + PH3
Слайд 16Кислоты
С неметаллами реагируют только кислоты обладающими сильными окислительными свойствами.
При их взаимодействии

неметалл окисляется до соответствующей кислоты(или ее ангидрида), а кислота восстанавливается до газообразного оксида.
H2SO4 (конц)- SO2 HNO3(конц)- NO2
HNO3(разб)- NO
Слайд 17Кислоты
S + HNO3 (разб) =
S + HNO3 (конц) =
C + HNO3 (конц)

=
S + H2SO4 (конц) =
P + HNO3 (конц) =
P + HNO3 (разб) =
Слайд 18Кислоты
Кислоты-окислители могут реагировать с безкислородными кислотами, обладающими восстановительными свойствами
H2SO4 (конц) + 2HBr

= Br2 + SO2 + 2H2O
H2SO4 (конц) + 8HI = 4I2 + H2S + 4H2O
H2SO4 (конц) + H2S = S + SO2 + 2H2O
8HNO3 (конц) + H2S = H2SO4 + 8NO2 + H2O

















 Inspirace
Inspirace Виды конфликтов в менеджменте
Виды конфликтов в менеджменте Критическое мышление это точка опоры для мышления человека.
Критическое мышление это точка опоры для мышления человека. Развитие побега из почки
Развитие побега из почки Happy New Year (Новый год)
Happy New Year (Новый год) Собственник и наемный менеджер в управлении компанией
Собственник и наемный менеджер в управлении компанией MARKETING MIX- PRICING
MARKETING MIX- PRICING Муниципальное образовательное учреждение «Общеобразовательная Сурская средняя школа №2»
Муниципальное образовательное учреждение «Общеобразовательная Сурская средняя школа №2» Основные правила обработки информации
Основные правила обработки информации Раннее профилирование
Раннее профилирование Психологические особенности детей дошкольного возраста
Психологические особенности детей дошкольного возраста Информатизация школы на пути к модели 1 : 1
Информатизация школы на пути к модели 1 : 1 1С:Электронный паспорт металлургического изделия
1С:Электронный паспорт металлургического изделия Скопируйте мега-тэг 1.Не закрывайте страницу с скопированным мега-тегом. 2. Зайдите в консоль блога в раздел «Внешний вид» и нажмите
Скопируйте мега-тэг 1.Не закрывайте страницу с скопированным мега-тегом. 2. Зайдите в консоль блога в раздел «Внешний вид» и нажмите  الله العظيم2-1
الله العظيم2-1 Информация. Кодирование информации
Информация. Кодирование информации 149147957c6a48784c54f2eb184d0e7b
149147957c6a48784c54f2eb184d0e7b Фурнитура. Ремонт одежды
Фурнитура. Ремонт одежды Скандинавская весна
Скандинавская весна Я и я-рлыки
Я и я-рлыки Геометрические фигуры. Узнавание и называние
Геометрические фигуры. Узнавание и называние Роль личности директора в успешной работе магазина
Роль личности директора в успешной работе магазина Приложение (1)
Приложение (1) Традиция семьи Щербань
Традиция семьи Щербань Мы живем в России!
Мы живем в России! Рождение новой России
Рождение новой России Фотоаппарат
Фотоаппарат Смысл рассказа АП Чехова «Злоумышленник»
Смысл рассказа АП Чехова «Злоумышленник»