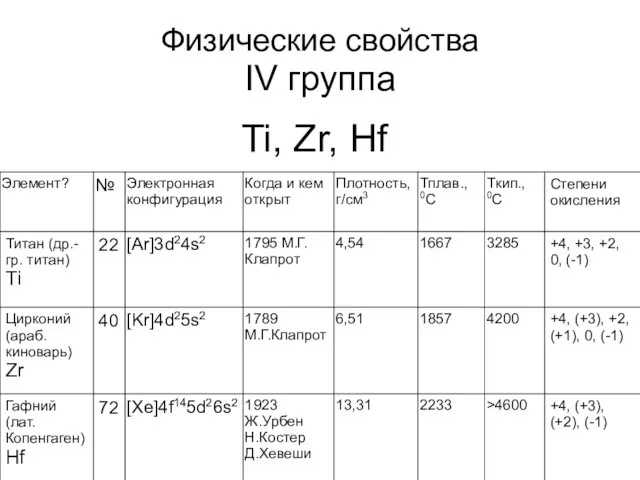
Слайд 2Физические свойства
IV группа
Ti, Zr, Hf
Слайд 3Нахождение в природе
Ti — в коре 0,63% по массе, основные минералы: рутил

TiO2, ильменит FeTiO3, перовскит CaTiO3 и еще более ста других.
Zr — в коре 0,016% по массе, основные минералы: циркон ZrSiO4, бадделеит ZrO2, всего более 30 минералов.
Hf — 3*10-4% по массе, собственных минералов не имеет, но часто сопутствует циркону в виде гафнона HfSiO4.
Слайд 4Получение в промышленности
Все элементы IV группы обычно получают восстановлением хлоридов или фторидов

МХ4 с помощью активных металлов (Mg, Ca, Na).
MCl4+2Mg → M+2MgCl2 (9000С)
MCl4+4Na → M+4NaCl (8000С)
Для более полной очистки используют, например, иодидное рафинирование (процесс Ван-Аркеля де Бура):
Ti+2I2 → TiI4↑ (2000С)
TiI4 → Ti +2I2 (14000С)
Слайд 5Химические свойства
Металлы инертны из-за пассивации, однако хорошо растворимы в плавиковой, щавелевой и

т.п. кислотах ввиду комплексообразования:
M+6HF → H2[MF6]+2H2↑
Металлы и оксиды при нагревании медленно растворяются в щелочах:
M+2NaOH+H2O → Na2MO3+2H2↑
Галогениды МХ4 — б/цв твердые в-ва, но TiCl4 — жидкость!
Также возможно получение оксосоединений типа TiOSO4 со сложным строением.
Слайд 6Химические свойства
Низшие степени окисления характерны только для титана, так при нагревании он

реагирует с разбавленными кислотами:
2Ti+6HCl → 2TiCl3+3H2↑
Аналогично с плавиковой кислотой,но в таких условиях происодит диспропорционирование:
2Ti+6HF → [TiF6]2-+Ti2++3H2O
Ti+6HF → H2[TiF6]+2H2O
Кроме того, для титана получены субоксиды состава Ti1-xO, Ti3O,Ti6O, имеющие кластерное строение.
Слайд 7Полисоединения элементов
IV группы
При гидролизе некоторых соединений(МХ4) возможно получить соединения состава MO2*xH2O,
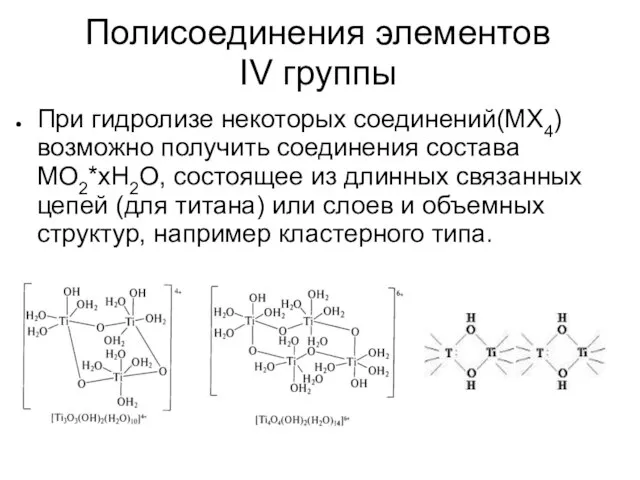
состоящее из длинных связанных цепей (для титана) или слоев и объемных структур, например кластерного типа.
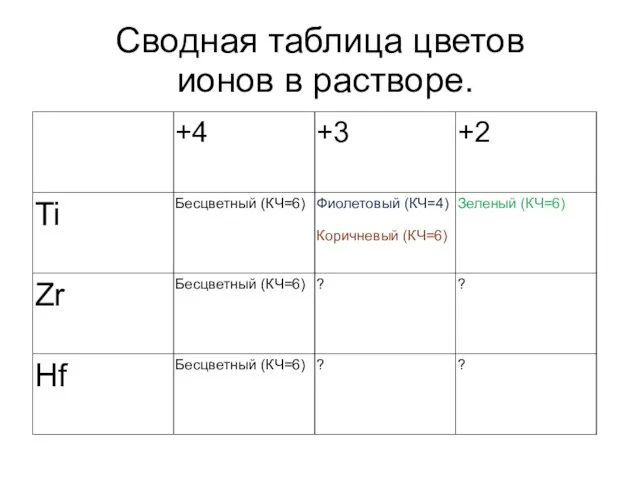
Слайд 8Сводная таблица цветов
ионов в растворе.
Слайд 9Применение
Ti — активно используется в металлургии (сверхлегкие и сверхпрочные сплавы, сплавы с

эффектом памяти), самоочищающиеся поверхности (TiO2).
Zr — добавка в некоторые сплавы, отражатель нейтронов.
Hf — поглотитель нейтронов в ядерных реакциях
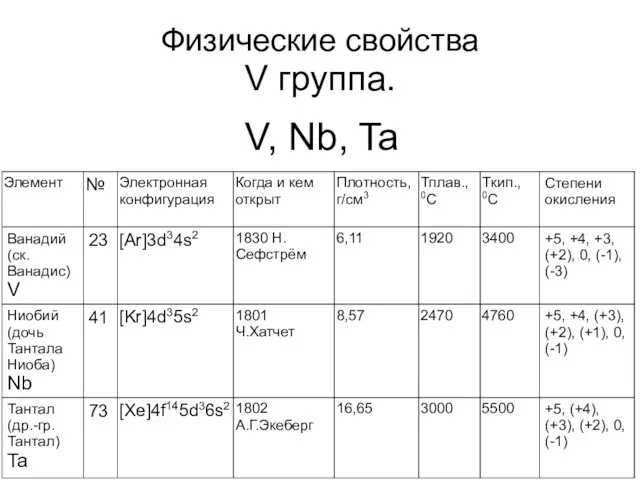
Слайд 10Физические свойства
V группа.
V, Nb, Ta
Слайд 11Нахождение в природе
V — в коре 0,014% по массе, основные минералы: патронит

VS4, ванадинит Pb5(VO4)3Cl и еще около 90 других.
Nb — в коре 0,002% по массе, основные минералы: ферроколумбит FeNb2O6 и пр.
Ta — 0,0017% по массе, основные минералы: ферротанталит FeTa2O6 и пр.
Тем не менее, данные элементы намного чаще встречаются в виде примесей в иных минералах.
Слайд 12Получение в промышленности
Ванадий чаще всего получают из шлака после обработки железных руд

в виде FeV2O4:
4FeV2O4+8NaCl+7O2 → 8NaVO3+2Fe2O3+4Cl2 (t)
2FeV2O4+9Cl2 → 4VOCl3+2FeCl3+2O2 (t)
Ниобий и тантал также получают из шлака, однако разделяют их фтороводородом:
4FeNb2O6+64HF+O2 →
→ 4H3[FeF6]+8H2[NbOF5]+18H2O
4FeTa2O6+80HF+O2 →
→ 4H3[FeF6]+8H2[TaF7]+26H2O
Слайд 13Химические свойства
Металлы также очень инертны, особенно Nb, Ta.
Ванадий растворяется только в конц.

кислотах, прочие же металлы — только в HF и его смесях:
V+6HNO3 → VO2NO3+5NO2↑+3H2O
2M+12HF → 2H[MF6]+5H2↑
Также они растворимы при сплавлении с конц. щелочами в присутствии окислителей :
4M+5O2+12KOH → 4K3MO4+6H2O
Слайд 14Формы ванадия в растворе
В зависимости от рН ванадий может принимать различные формы:

V+5 → VO2+ → HVO3 → VO3-
V+4 → VO2+ → H2VO3 → VO32-
сверх-кислая→кислая→нейтральная→щелочная
Кроме того, известен аналогичный оксокатион для V+3 → VO+.
Подобные оксокатионы проявляются и у Nb с Ta, но в чуть меньшей степени.
Слайд 15Полисоединения элементов
5-й группы
Анионы ванадиевых кислот при изменении рН образуют гигантские полисоединения
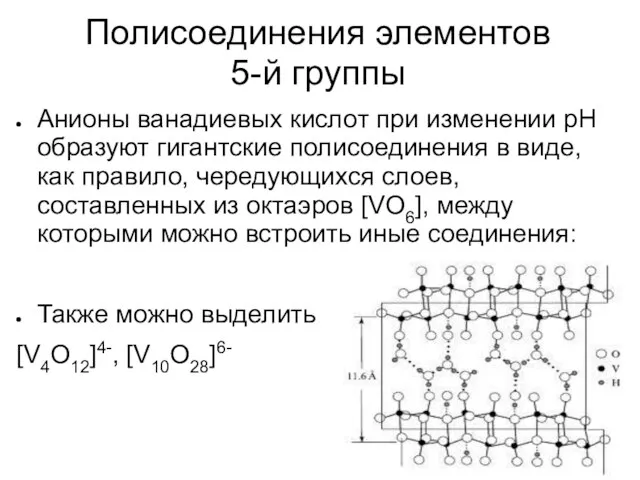
в виде, как правило, чередующихся слоев, составленных из октаэров [VO6], между которыми можно встроить иные соединения:
Также можно выделить
[V4O12]4-, [V10O28]6-
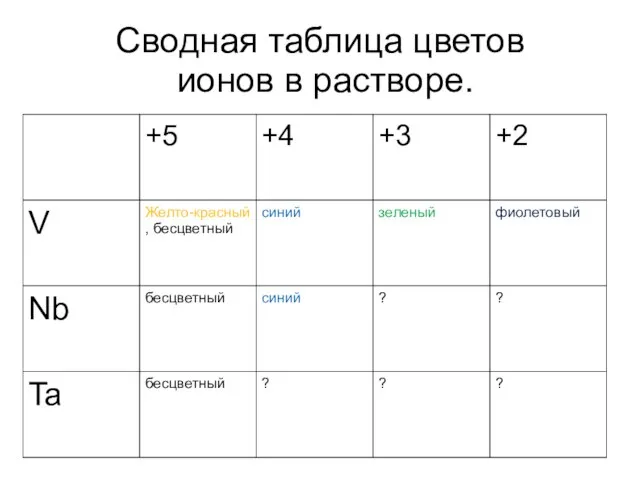
Слайд 16Сводная таблица цветов
ионов в растворе.
Слайд 17Применение
V, Nb и Ta часто используются как легирующие добавки к стали, а

также иногда в виде отдельных сплавов (феррованадий) и бронз.
Производные ванадия также активно используются в катализе, источниках тока и т. п.
Соединения ниобия (карбид) изпользуются как антикоррозийные покрытия для турбин самолетов и т. д.
Сверхпроводники
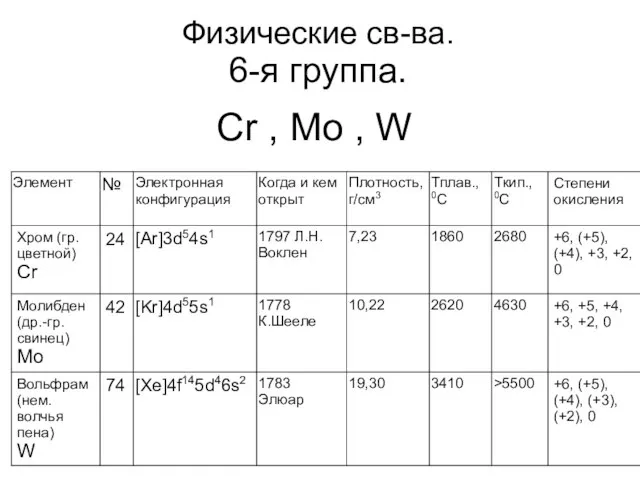
Слайд 18Физические св-ва.
6-я группа.
Cr , Mo , W
Слайд 19Нахождение в природе
Cr — в коре 0,035% по массе, основные минералы: хромит

FeCr2O4, крокоит PbCrO4 и пр.
Mo — в коре 3*10-4% по массе, основные минералы: молибденит MoS2, повеллит CaMoO4 и пр.
W — 0,0017% по массе, основные минералы: вольфрамит (Fe,Mn)WO4, шеелит CaWO4 и пр.
Слайд 20Получение в промышленности
Технический хром удобно получать из хромита:
4FeCr2O4+8Na2CO3+7O2 → → 8Na2CrO4+2Fe2O3+8CO2

(t)
K2Cr2O7+2C → Cr2O3+K2CO3+CO (t)
Вольфрам обогащают обычно флотацией, а после этого очищают т. н. щелочным методом:
2CaWO4+2Na2CO3+SiO2 → → 2Na2WO4+Ca2SiO4+2CO (t)
Слайд 21Химические свойства
Металлы пассивируются в конц. кислотах.
Хром хорошо растворяется в разб. кислотах:
Cr+2HCl

→ CrCl2+H2 (в отсутствии окислителей)
Не происходит растворения в щелочах.
Mo, W инертны по отношению к кислотам
Все металлы окисляются в щелочных расплавах:
M+3KNO3+2KOH → K2MO4+3KNO2+H2O
Слайд 22Полисоединения элементов
6-й группы
Все элементы 6-й группы образуют изополисоединения. М+6 чаще всего
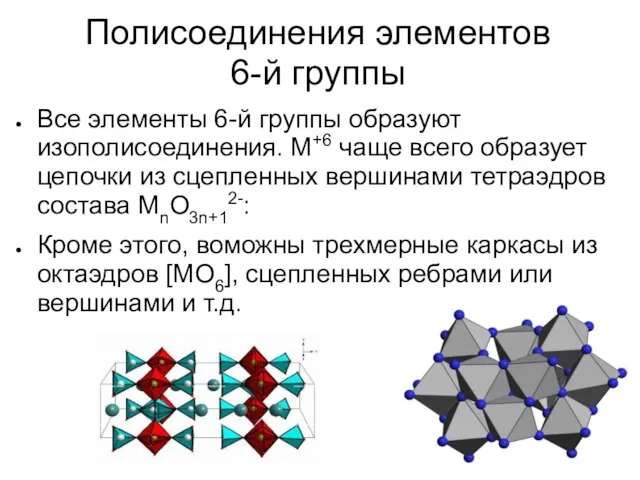
образует цепочки из сцепленных вершинами тетраэдров состава МnO3n+12-:
Кроме этого, воможны трехмерные каркасы из октаэдров [МO6], сцепленных ребрами или вершинами и т.д.
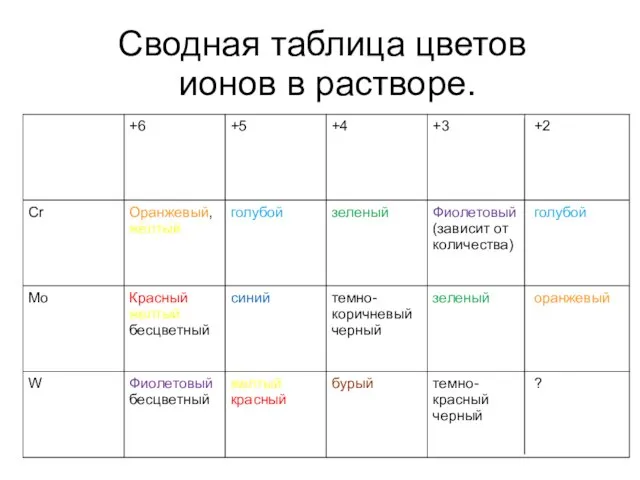
Слайд 23Сводная таблица цветов
ионов в растворе.
Слайд 24Применение
Cr — в металлургии: нержавеющие стали, декоративные покрытия; также зеркала, абразивы; в

хим.промышленности: пигменты, катализаторы и т.п.
Mo, W — часто используются как добавка к сталям для придания жаропрочностии твердости сплавам, соединения известны как катализаторы. Кроме этого используются в электронике и т.п.
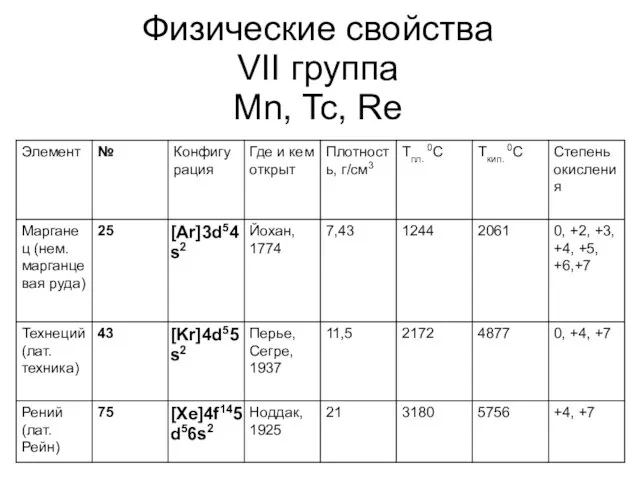
Слайд 25Физические свойства
VII группа
Mn, Tc, Re
Слайд 26Нахождение в природе
Mn – в коре 0,1% по массе, основные минералы: пиролюзит

MnO2
Tc – синтетический элемент
Re – в коре 7∙10-8% по массе, рассеянный элемент (примесь молибденита), основной минерал: CuReS4 – джезказганит.
Слайд 27Получение в промышленности
Mn – восстановление пиролюзита при нагревании: 4MnO2=2Mn2O3 + O2; Mn2O3

+ 2Al = 2Mn + Al2O3
Tc – получают из радиоактивных отходов промышленности
Re – обжиг минералов с последующим восстановлением: 4ReS2+15O2=2Re2O7+8SO2; Re2O7+7H2=2Re+7H2O
Слайд 28Химические свойства
В высших степенях окисления – сильные окислительные свойства, в низших –

практически не проявляют восстановительных
Марганец растворим в кислотах достаточно быстро, рений – гораздо медленнее
С щелочами марганец реагирует только в присутствии окислителей
Слайд 29Сводная таблица цветов ионов в растворе
Тут с таблицей будет неудобно, так как

рений и технеций в растворах являются бесцветными, а марганец проявляет самую различную окраску: +2 – бесцветный раствор (в твёрдом – очень слабо-розовый), +4 – бурый, +5 – синий (в сильнощелочных средах), +6 – зелёный, +7 – от розового до фиолетового (в зависимости от концентрации ионов)




























 Денежные переводы физических лиц: состояние и тенденции развития (на примере ПАО Сбербанк)
Денежные переводы физических лиц: состояние и тенденции развития (на примере ПАО Сбербанк) Особенности истории информатики
Особенности истории информатики Мотивирование топ-менеджеров в банковской сфере: подходы и инструменты
Мотивирование топ-менеджеров в банковской сфере: подходы и инструменты = 1
= 1 Изустная среда мордовского села
Изустная среда мордовского села Показатели рыночной активности
Показатели рыночной активности Выхухоль. Красная книга
Выхухоль. Красная книга Обработка текстовой и графической информации. Создаём комбинированный документ
Обработка текстовой и графической информации. Создаём комбинированный документ Телевидение: я выбираю или меня выбирают. Автор и руководитель проекта: Симонова Ольга Владимировна 2004 год
Телевидение: я выбираю или меня выбирают. Автор и руководитель проекта: Симонова Ольга Владимировна 2004 год Что я сделаю, чтобы доверенный мне магазин стал лучшим на рынке
Что я сделаю, чтобы доверенный мне магазин стал лучшим на рынке Туалетная вода для мужчин Faberlic Intense
Туалетная вода для мужчин Faberlic Intense Межпроцедурные анализы и оптимизации
Межпроцедурные анализы и оптимизации Внешняя политика СССР в 1930-е гг. и накануне Великой Отечественной войны
Внешняя политика СССР в 1930-е гг. и накануне Великой Отечественной войны Урок 3 Человек и Бог в православии-повторение
Урок 3 Человек и Бог в православии-повторение 17 век
17 век ПЕРЕГОВОРЫ
ПЕРЕГОВОРЫ Изготовление вечернего платья
Изготовление вечернего платья Теорiя iгор
Теорiя iгор  Презентация на тему Роль гормонов в обмене веществ, росте и развитии организма биология 8 класс
Презентация на тему Роль гормонов в обмене веществ, росте и развитии организма биология 8 класс аня хочет санчо панчо
аня хочет санчо панчо Создание таблиц в Microsoft Word
Создание таблиц в Microsoft Word Teenagers’ society problems
Teenagers’ society problems Воля познавать
Воля познавать Любимое блюдо моей семьи
Любимое блюдо моей семьи Ладья. Урок №8
Ладья. Урок №8 Описательные характеристики распределения тестовых результатов
Описательные характеристики распределения тестовых результатов Презентация на тему Одиночество
Презентация на тему Одиночество Ich gehe mit meine Laterne
Ich gehe mit meine Laterne