Содержание
- 2. «Ни одна наука не нуждается в эксперименте в такой степени, как химия. Её основные законы, теории
- 3. «Свои способности, человек может узнать только попытавшись приложить их.» Сенека Младший
- 4. Аристотель считал воду одним из «элементов» мироздания. Российский геохимик, академик Александр Евгеньевич Ферсман назвал воду самым
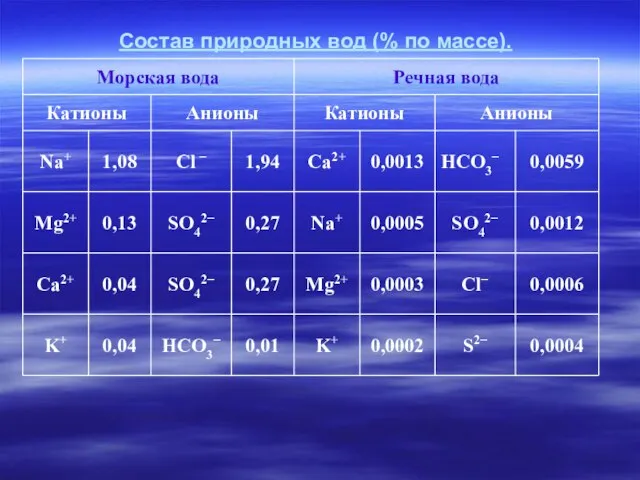
- 5. Состав природных вод (% по массе).
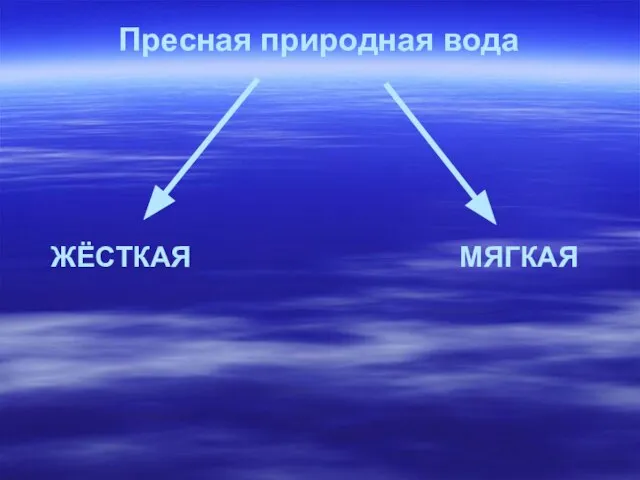
- 6. Пресная природная вода ЖЁСТКАЯ МЯГКАЯ
- 7. Жёсткая вода непригодна: Для питания паровых котлов Для применения в химической технологии В производстве керамике, бетонных
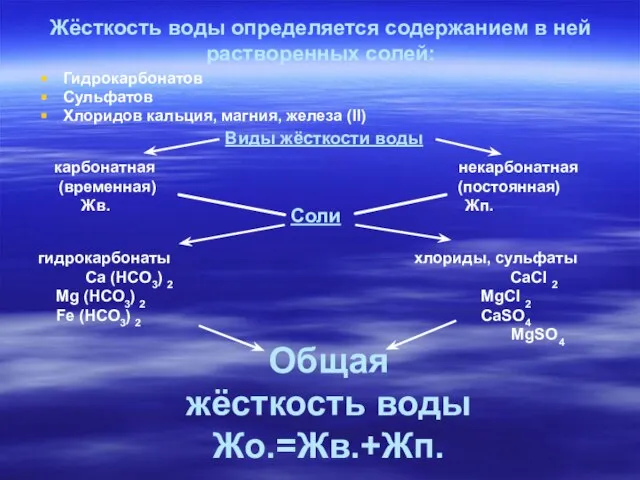
- 8. Жёсткость воды определяется содержанием в ней растворенных солей: Гидрокарбонатов Сульфатов Хлоридов кальция, магния, железа (II) Виды
- 9. Методы определения жёсткости воды Карбонатная жёсткость (временная) [Жв.] – метод кислотно-основного титрования Общая жёсткость [Жо.] –
- 10. Ваши опыты были успешны и не причинили вред вашему здоровью – ПОМНИТЕ: Совет 1: Работай строго
- 11. Следственный эксперимент Экспертные группы Химический анализ I гр. Водопроводная вода II гр. Родниковая вода III гр.
- 12. Инструкция по проведению следственного эксперимента №1 Определение жесткости водопроводной воды №2 Определение жесткости родниковой воды №3
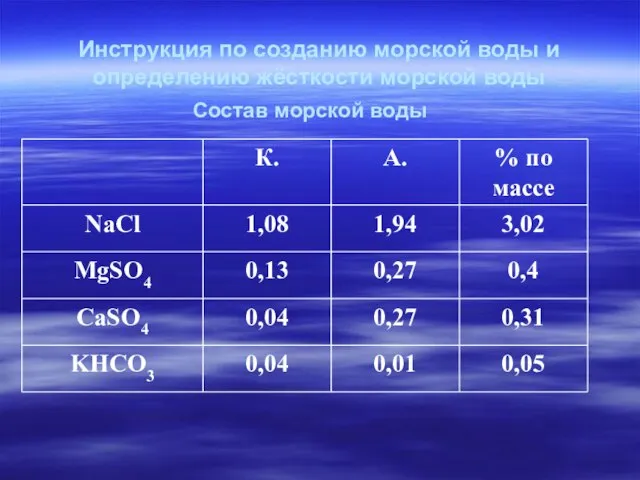
- 13. Инструкция по созданию морской воды и определению жёсткости морской воды Состав морской воды
- 14. Определение жёсткости морской воды Рассчитать весовые части солей морской воды 3,02: 0,4: 0,31: 0,05 60,4: 8
- 15. Определение жёсткости воды Примечание: Количество (ммоль) израсходованное на титрование соляной кислоты равно количеству (ммоль) солей, обуславливающих
- 16. Вычисления: Карбонатная жёсткость: Жк. =C(HCl)*V(HCl)*1000 V (H2O) V (H2O) – объём воды, взятый на титрование 1000
- 17. Инструкция по проведению химического анализа Влияние жёсткости воды на МС Цель: выяснить действия различной воды на
- 18. Информация к размышлению: Жёсткость воды влияет на пенообразование МС (мыла, стирального порошка). Оценить это качество воды
- 19. Ход работы Оборудование: Штатив с одинаковыми пробирками, стеклянные палочки, ложки, линейка, резинки аптечные, часы песочные 1мин.
- 20. Порядок действий Пронумерованные пробирки заполните на 1/5 их объёма исследуемой водой. Добавьте в каждую пробирку: а)
- 21. Жесткость воды и моющие средства
- 22. Примечание: чтобы мыло было удобно резать на равные части, его следует размягчить: кусочек мыла следует обернуть
- 23. Химическая экспертиза (в хим. лабораториях) Установлено: Iгр. Водопроводная вода Жводы = IIгр. Родниковая вода Жводы =
- 24. Общая жёсткость воды Определяется Жо. воды – методом комплексонометрии - титриметрический метод, основан на реакциях взаимодействия
- 25. Порядок действий Исследуемую воду объём 10 мл поместить в колбу. Анализируемую воду подщелочить до pH=10, прибавляя
- 26. Общая жёсткость воды (Метод комплексонометрии) – титриметрический метод, основан на реакциях взаимодействия определяемых ионов с некоторыми
- 27. Ход работы Цель: определить Жо. воды водопроводной Оборудование: бюретка, колба, химический стакан Реактивы: вода водопроводная, аммонийная
- 28. Отчёт
- 29. Жо=Cn (Na [H2Tr])*V (Na2[H2Tr])*1000/V(H2O) Где Cn (Na [H2Tr]) – нормальность трилона Б V (H2O) – объём
- 31. Скачать презентацию




![Методы определения жёсткости воды Карбонатная жёсткость (временная) [Жв.] – метод кислотно-основного титрования](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/399579/slide-8.jpg)


















![Жо=Cn (Na [H2Tr])*V (Na2[H2Tr])*1000/V(H2O) Где Cn (Na [H2Tr]) – нормальность трилона Б](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/399579/slide-28.jpg)
 Психологические типы и стилевые характеристики творчества
Психологические типы и стилевые характеристики творчества Зиние забавы
Зиние забавы Использование нетрадиционных техник в рисовании
Использование нетрадиционных техник в рисовании «Быстрая оценка собеседника» Ольга Д. Баранова
«Быстрая оценка собеседника» Ольга Д. Баранова Packers and Movers Pune | Get Free Quotes | Compare and Save
Packers and Movers Pune | Get Free Quotes | Compare and Save Мир кристаллов медного купороса
Мир кристаллов медного купороса Ацетилен и его гомологи
Ацетилен и его гомологи Писатели - юмористы
Писатели - юмористы Предложения по формированию корпоративной культуры Департамента культуры и архивного дела Ульяновской области
Предложения по формированию корпоративной культуры Департамента культуры и архивного дела Ульяновской области Глоссарий конформизм
Глоссарий конформизм Державин
Державин Презентация по английскому Moscow
Презентация по английскому Moscow  Визитка команды Башкирского государственного университета. Город Уфа
Визитка команды Башкирского государственного университета. Город Уфа Коллекции географических данных в Интернет
Коллекции географических данных в Интернет Значение дыхания. Строение и функции воздухоносных путей
Значение дыхания. Строение и функции воздухоносных путей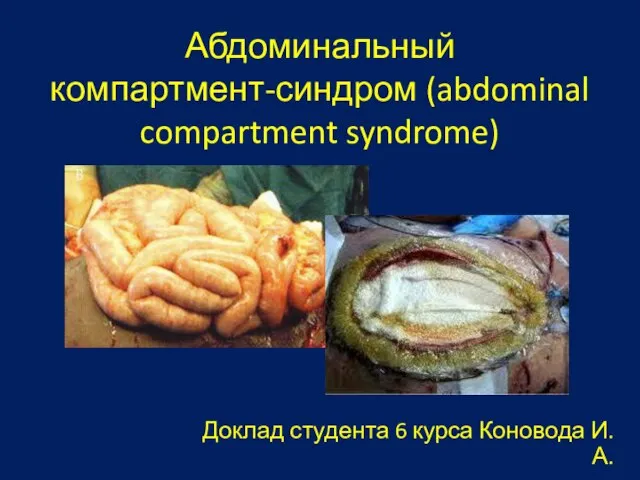 Абдоминальный компартмент синдром
Абдоминальный компартмент синдром Магистерская программа«Международный менеджмент»
Магистерская программа«Международный менеджмент» Открытое занятие-учение по ГО и ЧС проводит кафедра: Политики и управления в здравоохраненииответс. по ГО и ЧС:д.м.н. доц. Кошимбеко
Открытое занятие-учение по ГО и ЧС проводит кафедра: Политики и управления в здравоохраненииответс. по ГО и ЧС:д.м.н. доц. Кошимбеко Иванова Нина Борисовна учитель биологии МБОУ «Себежская средняя общеобразователь- ная школа» г.Себеж
Иванова Нина Борисовна учитель биологии МБОУ «Себежская средняя общеобразователь- ная школа» г.Себеж ЕДИНЫЙ ГОСУДАРСТВЕННЫЙ ЭКЗАМЕНЛИТЕРАТУРА
ЕДИНЫЙ ГОСУДАРСТВЕННЫЙ ЭКЗАМЕНЛИТЕРАТУРА Торговый знак apteka.ru
Торговый знак apteka.ru Побег и почки. Внешнее строение листа 6 класс
Побег и почки. Внешнее строение листа 6 класс Хлебобулочные изделия Тамбовской области
Хлебобулочные изделия Тамбовской области Презентация на тему Орхидея из холодного фарфора
Презентация на тему Орхидея из холодного фарфора Италия: время реформ и колониальных захватов
Италия: время реформ и колониальных захватов  Муниципальное казённое общеобразовательное учреждение «Сомовская средняя общеобразовательная школа» имени Героя Советского С
Муниципальное казённое общеобразовательное учреждение «Сомовская средняя общеобразовательная школа» имени Героя Советского С Интеллектуальная транспортная система города Минска
Интеллектуальная транспортная система города Минска Сетевой телефон
Сетевой телефон