Содержание
- 2. Жоспар: Кіріспе Негізгі бөлім Периодтық жүйесінің ашылу тарихы Периодтық жүйесінің құрылымы Химиялық элементтердің периодтық жүйесі маңызы
- 3. Кіріспе Химиялық элементтердің периодтық жүйесі — элементтердің әртүрлі қасиеттерінің атом ядросы зарядына тәуелділігін белгілейтін химиялық элементтердің
- 5. Жүйе атақты орыс химигі Д. И. Менделеевтің 1869 жылы ашқан периодтық заңының графикалық түрде бейнеленуі болып
- 6. Негізгі бөлім Алғашқы кестеде Менделеев әлі ашылмаған бірнеше элементтер бар екенін болжап, оларға кестеде тиісті орын
- 7. Сонымен қатар Менделеев марганецке (қазіргі технеций Тс және рений Re), теллурге (полоний Ро), йодқа (астат At),
- 8. Радиоактивтік ыдыраудың (1806), рентген сәулелерінің (1895) ашылуы, неміс физигі М.Планктің сәуле шығарудың кванттық теориясын (1900), ағылшын
- 9. Ағылшын физигі Г.Мозли еңбектерінің нәтижесінде Менделеев ұсынған әр элементтің рет нөмерінің оның ядро зарядымен тең болуы,
- 10. Қазіргі Э. п. ж.126 хим. элементті қамтиды, олардан трансуран элементтері (Z – 93 – 110) және
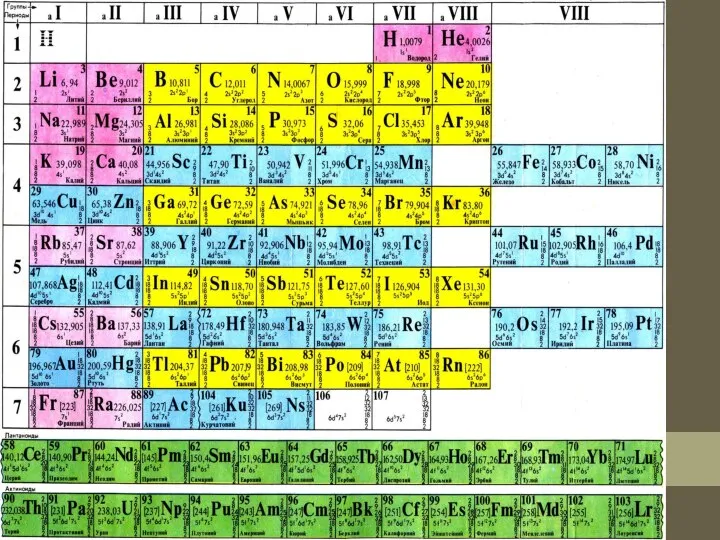
- 11. Периодтық жүйесінің құрылымы Қазіргі кездегі периодтық жүйеде барлық элементтер рет бойынша нөмірленген. Элементтердің нөмерін реттік немесе
- 12. Периодтар Период деп сілтілік металдан басталып инертті газбен аяқталатын элементтер тобын айтады.
- 13. Периодтар горизонталь қатардан тұрады. Периодтық жүйеде 7 период бар, олар рим сандарымен белгілеген, I, II және
- 14. Қатарлар Периодтарда араб сандарымен белгіленген 10 қатар кіреді. Үлкен периодтардың жұп қатарларында (төртінші, алтыншы, сегізінші және
- 15. Топтар Тігінен орналасқан элементтердің қатарын топтар деп атайды. Периодтық жүйеде сегіз топ бар, олардың нөмері рим
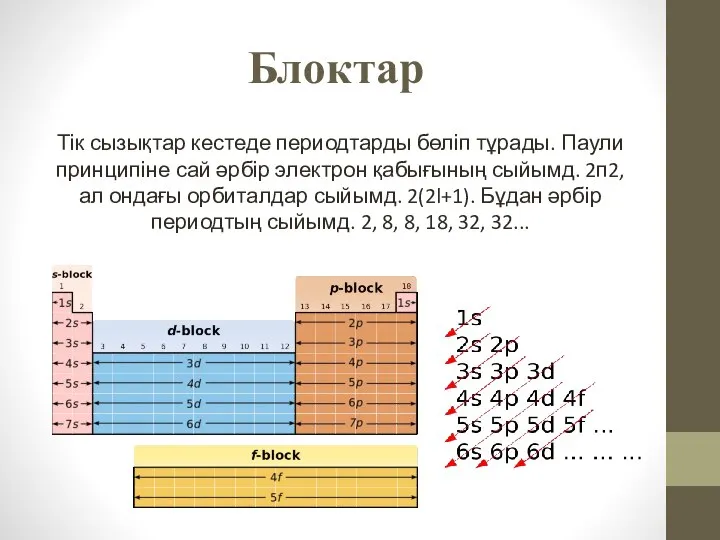
- 16. Блоктар Тік сызықтар кестеде периодтарды бөліп тұрады. Паули принципіне сай әрбір электрон қабығының сыйымд. 2п2, ал
- 17. Әр периодтың басы жаңа мәніне сай келетін s – элементтен басталады ( Қа-, ІҚа-топшалар), соңы р
- 18. Химиялық элементтердің периодтық жүйесі маңызы Химиялық элементтердің периодтық жүйесі – периодтық заңның графиктік бейнесі, олар өзара
- 19. Химиялық элементтердің периодтық жүйесі ашылған кезде көптеген элементтер белгісіз еді. Д. И. Менделеев аса үлкен болжампаздықпен
- 20. Галлий Ga 1875 ж., скандий Sc 1879 ж., германий (Ge) 1885 ж. ашылды. Д. И. Менделеев
- 21. Қорытынды Химиялық элементтердің периодтық жүйесі – периодтық заңның графиктік бейнесі, олар өзара тығыз байланысты, бірін-бірі толықтыра
- 23. Скачать презентацию


















 Александра Лежнина
Александра Лежнина PEMPAL TCOP Группа лидеров – Видеоконференция 23 апреля 2009 г.Презентация результатов ОСФО Республика Таджикистан
PEMPAL TCOP Группа лидеров – Видеоконференция 23 апреля 2009 г.Презентация результатов ОСФО Республика Таджикистан Гражданское общество
Гражданское общество От индустриального общества к информационному
От индустриального общества к информационному Современные педагогические технологии в специальном образовании детей с особенностями психофизического развития
Современные педагогические технологии в специальном образовании детей с особенностями психофизического развития Пирамида Хеопса 146 метров
Пирамида Хеопса 146 метров Animal's world
Animal's world Внешняя политика Советского государства 1920-х
Внешняя политика Советского государства 1920-х Религиозная культура, этика, культурнопросветительская и добровольческая деятельность в школе
Религиозная культура, этика, культурнопросветительская и добровольческая деятельность в школе עמודי חיפוש ותוצאות
עמודי חיפוש ותוצאות ДИСЛАЛИЯ
ДИСЛАЛИЯ 2_Л_Техники_и_этапы_в_академическом_рисунке
2_Л_Техники_и_этапы_в_академическом_рисунке Футбольные фанаты
Футбольные фанаты ТАЙНЫ ВОДЫ
ТАЙНЫ ВОДЫ Презентация на тему Жизнь и творчество Владимира Высоцкого
Презентация на тему Жизнь и творчество Владимира Высоцкого Современные проблемы профильного обучения в сельской школе.
Современные проблемы профильного обучения в сельской школе. Презентация на тему Первая помощь при остановке сердца
Презентация на тему Первая помощь при остановке сердца Презентация_готова
Презентация_готова Риск-менеджмент в лизинговой компании Система управления кредитным риском
Риск-менеджмент в лизинговой компании Система управления кредитным риском Инженерная и компьютерная графика. Комбинированная поверхность
Инженерная и компьютерная графика. Комбинированная поверхность Индивидуальный выбор видов спорта и систем физических упражнений
Индивидуальный выбор видов спорта и систем физических упражнений 10 кл Урок 8
10 кл Урок 8 Час общения «Времена года»
Час общения «Времена года» История счёта
История счёта Бал в честь женитьбы Карла IV (Безумного) и Изабеллы Баварской
Бал в честь женитьбы Карла IV (Безумного) и Изабеллы Баварской Фармацевтические кластеры – мост через «долину смерти» для инновационных разработок
Фармацевтические кластеры – мост через «долину смерти» для инновационных разработок Отражение и преломление света
Отражение и преломление света СЕМИНАР О ПРЕДОСТАВЛЕНИИ СОЦИАЛЬНО-ЗНАЧИМЫХ ГОСУДАРСТВЕННЫХ УСЛУГ С 1 МАРТА 2012 ГОДА
СЕМИНАР О ПРЕДОСТАВЛЕНИИ СОЦИАЛЬНО-ЗНАЧИМЫХ ГОСУДАРСТВЕННЫХ УСЛУГ С 1 МАРТА 2012 ГОДА