Содержание
- 2. Это совокупность методов химического количественного анализа, основанных на измерении объемов для установления концентрации (содержания) определяемого вещества.
- 3. Это метод количественного анализа, основанный на измерении объема раствора с точно известной концентрацией реактива Данный метод
- 4. ОСНОВНЫЕ ТЕРМИНЫ Титрант Стандартный раствор Рабочий раствор Титрование Прямое титрование Обратное титрование Титрование по замещению Точка
- 5. МЕТОДЫ ТИТРИМЕТРИЧЕСКОГО АНАЛИЗА Методы нейтрализации ( ацидометрия, алкалиметрия,галометрия) Методы осаждения ( аргентометрия , меркурометрия) Методы комплексообразования
- 6. Задачи: 1.Использовать раствор точно известной концентрации (фиксанал) 2. Правильно определить точку эквивалентности
- 7. Способы фиксации точки эквивалентности По собственной окраске ионов определяемого вещества По веществу – осадителю С помощью
- 8. ИНДИКАТОРЫ кислотно-основные, окислительно-восстановительные комплексонометрические адсорбционные хемилюминисцентные
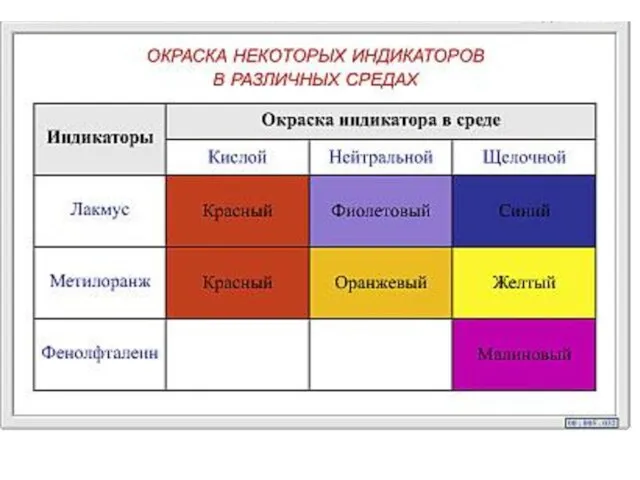
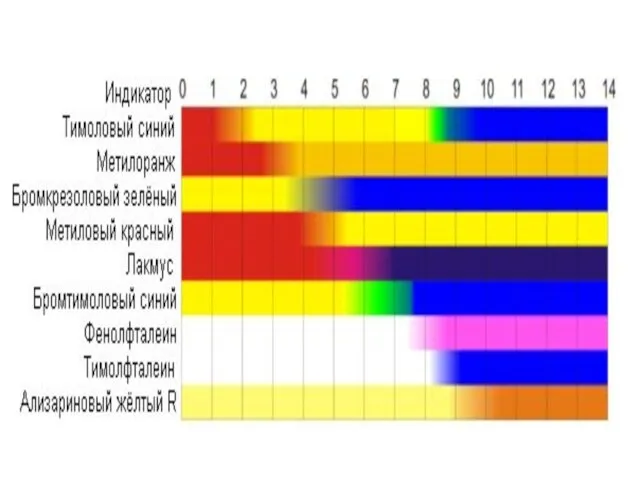
- 9. Область значений рН, в которой индикатор изменяет окраску называется интервалом перехода индикатора
- 12. Правила выбора индикатора Интервал перехода индикатора болжен совпадать со скачком титрования или хотя бы частично касаться
- 13. Кислотно-основные индикаторы Это вещества, изменяющие свою окраску при изменении водородного показателя среды. Метиловый-оранжевый Метиловый-красный Фенолфталеин Ф-ф
- 14. Окислительно-восстановительные индикаторы Это вещества, способные окисляться или восстанавливаться в определенных интервалах значений окислительного потенциала и изменять
- 15. Комплексонометрические индикаторы Вещества, образующие с определяемыми ионами окрашенные комплексные соединения: Эриохром черныйТ Ксиленоловый оранжевый
- 16. Адсорбционные индикаторы Вещества, в присутствии которых в точке эквивалентности изменяется цвет осадка: Эозин Флуоресцин
- 17. Хемилюминесцентные индикаторы Вещества, способные в точке эквивалентности светиться видимым светом: Люминол Силоксен
- 18. Посуда и оборудование в титриметрическом анализе
- 19. Основные уравнения титриметрического метода анализа N1 * V1 = Nx * Vx Где: N1 – нормальность
- 20. N = n V Где:n – число молей эквивалента вещества V – объем раствора в литрах
- 22. Скачать презентацию

















 Тема: «Спортивные игры зимой»
Тема: «Спортивные игры зимой» Список детей на получение кроватей и полотенец
Список детей на получение кроватей и полотенец Тепловые двигатели. Паровая турбина.
Тепловые двигатели. Паровая турбина. Система образования в Англии
Система образования в Англии Геометрические паркеты
Геометрические паркеты Подходы к системному целеполаганию. Лекция 2
Подходы к системному целеполаганию. Лекция 2 Конституция РФ
Конституция РФ Проект "Задачи на смеси и сплавы"
Проект "Задачи на смеси и сплавы" Раздел #. Дизайн интерьера
Раздел #. Дизайн интерьера Основы научных исследований
Основы научных исследований 000834aa-f5be4922
000834aa-f5be4922 Погружение
Погружение Невербальное общение
Невербальное общение Однородность керамзита
Однородность керамзита Презентация на тему Длина и меры ее измерения
Презентация на тему Длина и меры ее измерения Презентация на тему Экономика как наука
Презентация на тему Экономика как наука Кофемашина Yamaguchi CoffeeMann
Кофемашина Yamaguchi CoffeeMann Танковая викторина
Танковая викторина Петр Петрович Семёнов-Тян-Шанский
Петр Петрович Семёнов-Тян-Шанский Александр
Александр Налог на прибыль
Налог на прибыль SPORTS in Our Life
SPORTS in Our Life  Аудирование —цель и средство обучения
Аудирование —цель и средство обучения Отношения мужчины и женщины. Женская психология
Отношения мужчины и женщины. Женская психология Схема организации Главного управления МЧС России по Ярославской области
Схема организации Главного управления МЧС России по Ярославской области Презентация на тему Афанасий Афанасьевич Фет (4 класс)
Презентация на тему Афанасий Афанасьевич Фет (4 класс) муниципальное образовательное учреждениеОбходская основная общеобразовательная школаУренского муниципального районаНижегор
муниципальное образовательное учреждениеОбходская основная общеобразовательная школаУренского муниципального районаНижегор куликовская битва
куликовская битва