Содержание
- 2. Строение атома
- 3. КИСЛОРОД Кислород O2 (К.В. Шееле 1772 г., Дж. Пристли 1774 г.) Самый распространенный элемент на Земле;
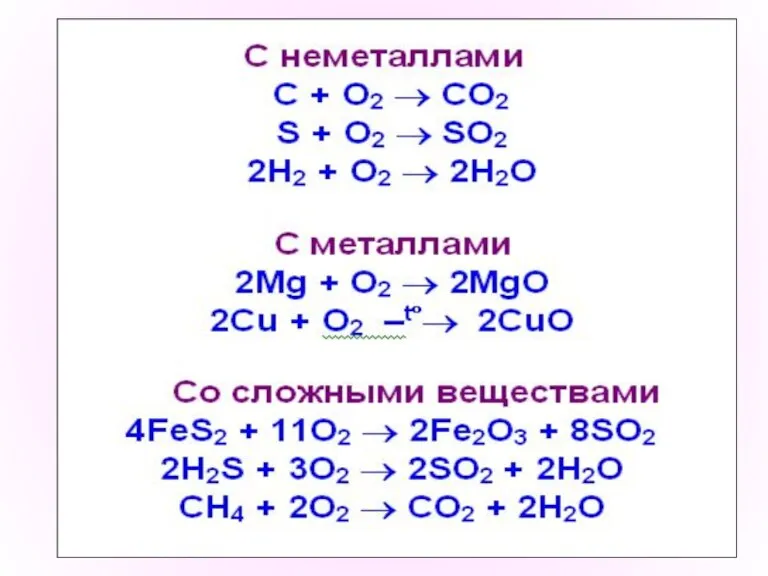
- 4. Химические свойства О2 Взаимодействие веществ с кислородом называется окислением. С кислородом реагируют все элементы, кроме Au,
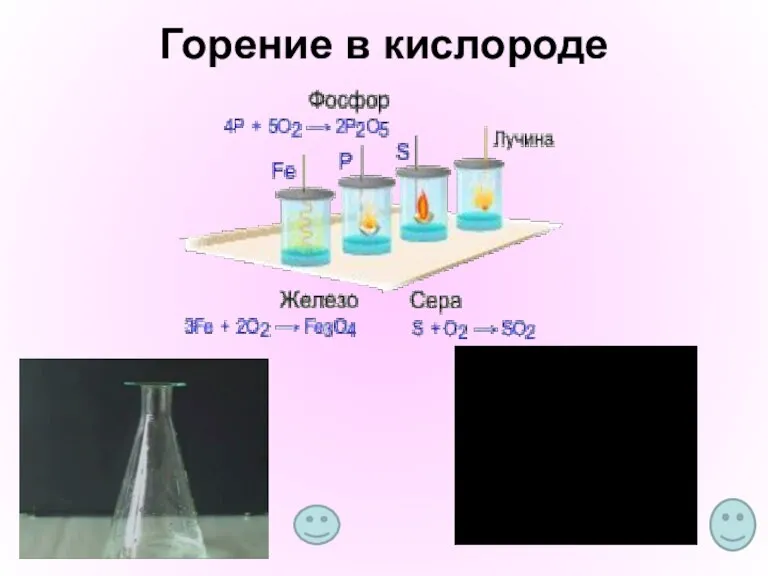
- 6. Горение в кислороде
- 7. СЕРА S Физические свойства - Твердое кристаллическое вещество желтого цвета, нерастворима в воде, водой не смачивается
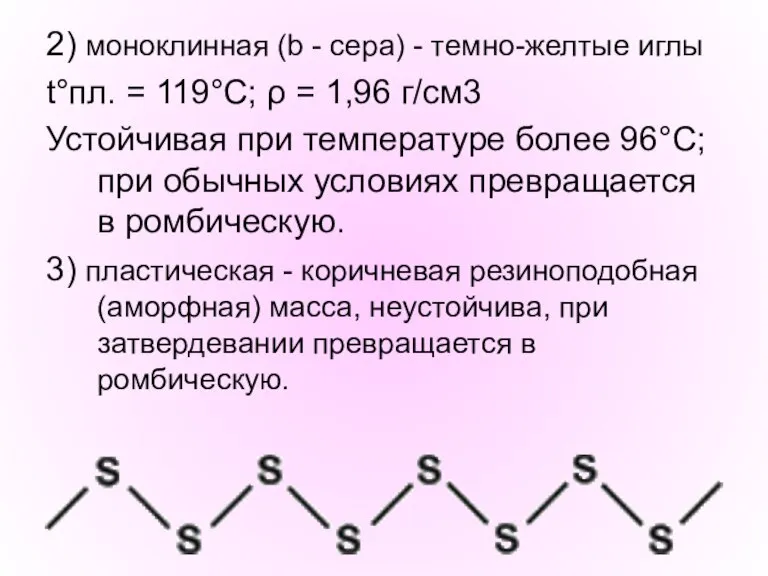
- 8. 2) моноклинная (b - сера) - темно-желтые иглы t°пл. = 119°C; ρ = 1,96 г/см3 Устойчивая
- 9. Химические свойства
- 11. Соединения серы Сероводород и сульфиды H2S Оксид серы (IV) SO2 Сернистая кислота H2SO3 Сульфиты и гидросульфиты
- 12. Серная кислота и ее соли H2SO4
- 14. Техника безопасности при работе с серной кислотой Правила ТБ при работе с кислотами Правила разбавления серной
- 15. Свойства разбавленной серной кислоты Серная кислота – сильный электролит, поэтому хорошо диссоциирует в воде на ионы
- 16. Свойства разбавленной серной кислоты С Металлами до Н С основными оксидами С растворимыми основаниями С нерастворимыми
- 18. Скачать презентацию












 Тема: Персидская держава – держава «царя царей»
Тема: Персидская держава – держава «царя царей» Тормоза подвижного состава
Тормоза подвижного состава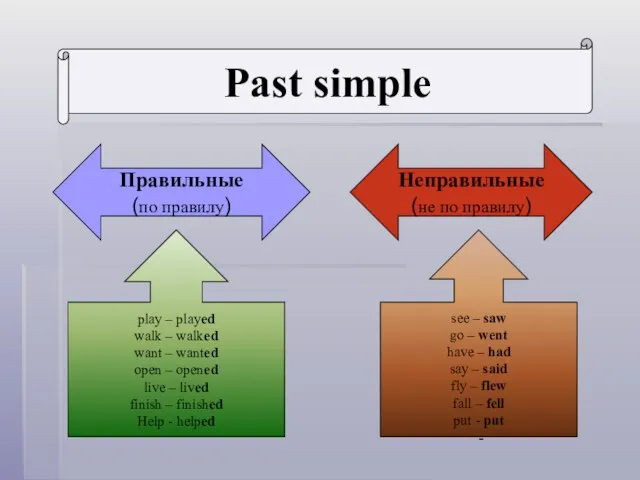 Past simple
Past simple Понятие сентиментализм
Понятие сентиментализм Синонимия
Синонимия  Презентация на тему Скандинавская мифология
Презентация на тему Скандинавская мифология  Поговорим о школьном питании
Поговорим о школьном питании 6_Презентация СКУД_WinkHaus
6_Презентация СКУД_WinkHaus Презентация на тему АПК Кировской области
Презентация на тему АПК Кировской области  Ситуация с отоплением и горячим водоснабжением в Мурманске
Ситуация с отоплением и горячим водоснабжением в Мурманске Недвижимость. Торги, лот №5, г. Хабаровск
Недвижимость. Торги, лот №5, г. Хабаровск Высвобождение персонала
Высвобождение персонала Подводим итоги Фестиваля проектов - 2012
Подводим итоги Фестиваля проектов - 2012 Презентация на тему Геоэкология
Презентация на тему Геоэкология  Леонард Эйлер
Леонард Эйлер Сила трения
Сила трения Ликвидация несанкционированных врезок
Ликвидация несанкционированных врезок Новые подходы к организации повышения педагогического мастерства учителей округа
Новые подходы к организации повышения педагогического мастерства учителей округа Если знаний у вас нет,обращайтесь в Интернет
Если знаний у вас нет,обращайтесь в Интернет Шлюпка. Виды шлюпок
Шлюпка. Виды шлюпок Места под замену. Текущее места размещения
Места под замену. Текущее места размещения Сравнительная характеристика героев. Как писать сочинение
Сравнительная характеристика героев. Как писать сочинение Rod_sobr_Det_agressivnost (1)
Rod_sobr_Det_agressivnost (1) История одежды: как одевались Древние Египтяне
История одежды: как одевались Древние Египтяне Коробочка для подарка
Коробочка для подарка Предыстория человечества (10 класс)
Предыстория человечества (10 класс) Презентация на тему Моя семья
Презентация на тему Моя семья г.Йошкар-Ола,2008г.
г.Йошкар-Ола,2008г.