Содержание
- 2. Цель урока: Повторить и закрепить знания учащихся о свойствах кислотных оксидов и кислот. Рассмотреть свойства соединения
- 3. Получение оксидов 1. Горение веществ (Окисление кислородом) а) простых веществ Mg +O2=2MgO S+O2=SO2 б) сложных веществ
- 4. 1)Сероводород горит на воздухе голубым пламенем при этом образуется сернистый газ или оксид серы(IV) 2H2S-2 +
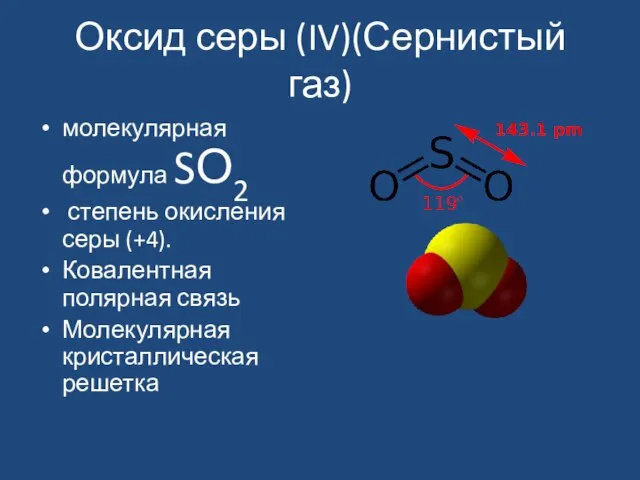
- 5. Оксид серы (IV)(Сернистый газ) молекулярная формула SО2 степень окисления серы (+4). Ковалентная полярная связь Молекулярная кристаллическая
- 6. Электронный баланс 1)S-2 -6е→ S+4 Восстановитель O2+4е → 2O -2 Окислитель 2) S0 -4е→ S+4 Восстановитель
- 7. Определение плотности по воздуху. Д воздух -? М(Воздух)= 29 г/моль М(H2S)=64г/моль Д воздух = 64:29=2,21 Д
- 8. Получение сернистого газа в промышленности. сжигание серы или обжиг сульфидов, в основном — пирита: 4FeS2+ 11O2
- 9. Получение оксида серы (IV) в лабораторных условиях воздействием сильных кислот на сульфиты и гидросульфиты. Образующаяся сернистая
- 10. Физические свойства. Оксид серы (IV), или сернистый газ, при нормальных условиях представляет собой бесцветный газ с
- 11. Нахождение в природе
- 12. Химические свойства кислотных оксидов ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТНЫХ ОКСИДОВ 1. Кислотный оксид +Вода= Кислота (р. соединения) СO2
- 13. Химические свойства оксида серы (IV) 1. Кислотный оксид +Вода= Кислота SO2 + H2O = H2SO3 2.
- 14. Химические свойства кислот 1. Изменяют окраску индикатора. 2.Реагируют с металлами в ряду активности до H2 (искл.
- 15. Уравнение диссоциации сернистой кислоты. H2SО3 → H+ + HSО3 - HSО3 - ↔ H+ + SО3
- 16. Качественная реакция на сульфиты. Взаимодействие соли с сильной кислотой, при этом выделяется газ с резким запахом
- 17. Окислительные свойства оксида серы (IV). 2H2S-2 + S +4O2 → 2H2O + 3S 0 S+4 +4е→
- 18. Восстановительные свойства оксида серы (IV) 2SO2+ O2 = 2SO2 SO2 + Br2 + 2H2O = H2
- 19. Применение оксида серы (IV). Большая часть оксида серы (IV) используется для производства серной кислоты. Используется также
- 20. Физиологическое действие на организм. SO2 очень токсичен. Симптомы при отравлении сернистым газом — насморк, кашель, охриплость,
- 21. Воздействие на атмосферу. Из-за образования в больших количествах в качестве отходов диоксид серы является одним из
- 23. Скачать презентацию



















 Бессмертная комедия А. С. Грибоедова «Горе от ума»
Бессмертная комедия А. С. Грибоедова «Горе от ума» Урок коллективного посещения в 5 классе
Урок коллективного посещения в 5 классе ПЕДАГОГИЧЕСКИЙ СОВЕТОДАРЁННЫЕ ДЕТИ: реалии, проблемы, перспективы.
ПЕДАГОГИЧЕСКИЙ СОВЕТОДАРЁННЫЕ ДЕТИ: реалии, проблемы, перспективы. Ранения. Первая медицинская помощь
Ранения. Первая медицинская помощь Совершенствование сервисно-транспортной инфраструктуры придомовых территорий
Совершенствование сервисно-транспортной инфраструктуры придомовых территорий СТЕКЛЯННЫЕ ТОВАРЫ
СТЕКЛЯННЫЕ ТОВАРЫ Применение электролиза. Основная химическая промышленность
Применение электролиза. Основная химическая промышленность Маршрут прогулки по городу Борисоглебск
Маршрут прогулки по городу Борисоглебск Региональный студенческий хакатон ООО АИС город
Региональный студенческий хакатон ООО АИС город Берегите зрение
Берегите зрение Конкурентные преимущества и перспективы развития казахстанского фондового рынка
Конкурентные преимущества и перспективы развития казахстанского фондового рынка Древние восточные церкви. Православие за рубежом в xх – xxi вв
Древние восточные церкви. Православие за рубежом в xх – xxi вв Pro-психологов: психологическая служба образовательной организации
Pro-психологов: психологическая служба образовательной организации ST Main Page
ST Main Page Лекарственная аллергия
Лекарственная аллергия Знаковые модели. Моделирование и формализация
Знаковые модели. Моделирование и формализация Развитие координационных способностей у юных борцов вольного стиля
Развитие координационных способностей у юных борцов вольного стиля Диплом партнёра центра спортивного комплексного обучения по хоккею г. Сморгони
Диплом партнёра центра спортивного комплексного обучения по хоккею г. Сморгони МЕТОДИКА ПРОВЕДЕНИЯ КОРРЕКЦИОННЫХ ЗАНЯТИЙ
МЕТОДИКА ПРОВЕДЕНИЯ КОРРЕКЦИОННЫХ ЗАНЯТИЙ Политический конфликт
Политический конфликт Чемпионат и первенство города Ярославля по зимнему триатлону
Чемпионат и первенство города Ярославля по зимнему триатлону AI автомобиля в изменчивом мире на примере Ex Machina
AI автомобиля в изменчивом мире на примере Ex Machina Восприятие речи
Восприятие речи Конаково
Конаково Сударыня - Масленица
Сударыня - Масленица Візуальний контакт під час ділової комунікації
Візуальний контакт під час ділової комунікації Технологии проведения избирательной кампании
Технологии проведения избирательной кампании Общественная организацияг.Балаково Саратовской области«Попечительский совет средней школы №11»
Общественная организацияг.Балаково Саратовской области«Попечительский совет средней школы №11»