Содержание
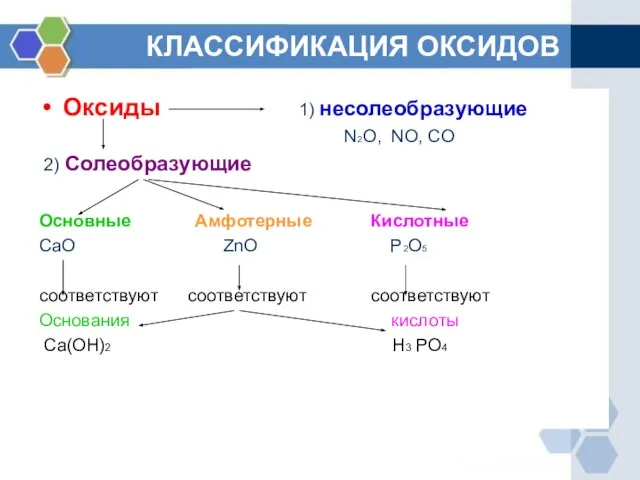
- 2. КЛАССИФИКАЦИЯ ОКСИДОВ Оксиды 1) несолеобразующие N2O, NO, CO 2) Солеобразующие Основные Амфотерные Кислотные CaO ZnO P2O5
- 3. ОПРЕДЕЛЕНИЕ ГРУПП ОКСИДОВ Основными называются оксиды, которые образуют соли при взаимодействии с кислотами или кислотными оксидами.
- 4. НАПМИСАТЬ ХИМИЧЕСКИЕ ФОРМУЛЫ ОКСИДОВ 1)Оксид серы(IV) 2)Оксид азота(V) 3)Оксид калия (I) 4)Оксид железа(II) 5)Оксид фосфора(V) 6)
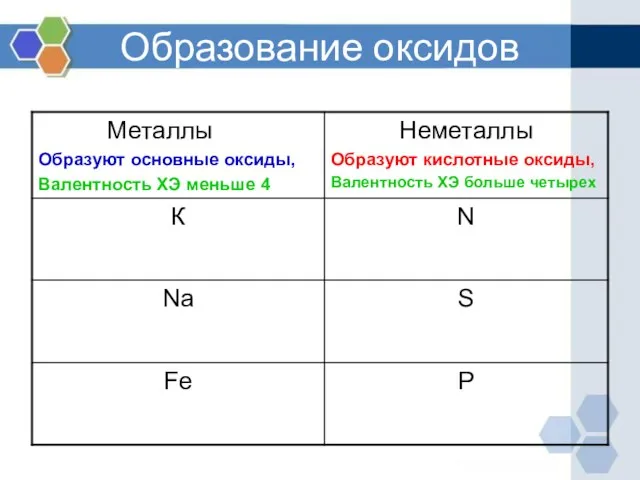
- 5. Образование оксидов
- 6. ФОРМУЛЫ ОКСИДОВ 1)Оксид серы(IV) 2)Оксид азота(V) 3)Оксид калия (I)- основной оксид 4)Оксид железа(II) – основной оксид
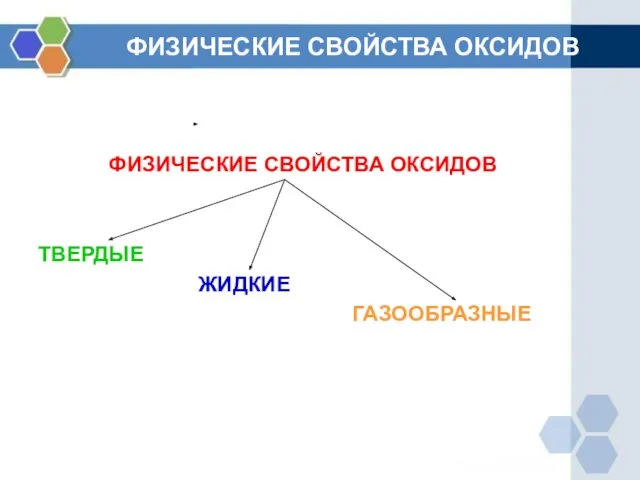
- 7. ФИЗИЧЕСКИЕ СВОЙСТВА ОКСИДОВ ФИЗИЧЕСКИЕ СВОЙСТВА ОКСИДОВ ТВЕРДЫЕ ЖИДКИЕ ГАЗООБРАЗНЫЕ
- 8. ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВНЫХ ОКСИДОВ (О.О.) 1) О.О. + кислота =соль + вода (реакция обмена) CaO +
- 9. Химические свойства кислотных оксидов (К.О.) 1) К.О. + основание = соль + вода (реакция обмена) SO3
- 10. Амфотерные оксиды 1) с кислотами как основные ZnO + 2HCl = ZnCl2 + H2O 2) с
- 12. Скачать презентацию






 или Мотивация работника – схемы материальных и нематериальных поощрений
или Мотивация работника – схемы материальных и нематериальных поощрений Freestyle сессия «Инвестиционно-банковские услуги для фарммедсектора»
Freestyle сессия «Инвестиционно-банковские услуги для фарммедсектора» По мере развития науки появляются новые признаки, и старые классификационные схемы оказываются недостаточными. Недостаточным ока
По мере развития науки появляются новые признаки, и старые классификационные схемы оказываются недостаточными. Недостаточным ока Инфразвук
Инфразвук Чрезвычайные происшествия техногенного характера. Химические аварии
Чрезвычайные происшествия техногенного характера. Химические аварии Семейное право
Семейное право Интернет-технологии на уроках информатики
Интернет-технологии на уроках информатики Гибридные ценные бумаги
Гибридные ценные бумаги Заказ в магазине Водакулершоп
Заказ в магазине Водакулершоп Накопительная система оценки в образовательном учреждении. Метод «портфолио».
Накопительная система оценки в образовательном учреждении. Метод «портфолио». Развитие рынков, бизнеса и маркетинга визменившихся условиях
Развитие рынков, бизнеса и маркетинга визменившихся условиях Саратовский государственный медицинский университет
Саратовский государственный медицинский университет Презентация на тему Австралия и океания
Презентация на тему Австралия и океания  Спортивно-патриотические мероприятие, посвященное Дню защитника Отечества “А ты готов?“
Спортивно-патриотические мероприятие, посвященное Дню защитника Отечества “А ты готов?“ Презентация на тему Определение в русском языке (8 класс)
Презентация на тему Определение в русском языке (8 класс) Выразительно – графические свойства композиции (точка, линия, пятно). Тема 1
Выразительно – графические свойства композиции (точка, линия, пятно). Тема 1 Université du troisième âge. Le français en ligne
Université du troisième âge. Le français en ligne Leading Supplier of Catering Equipment In UK
Leading Supplier of Catering Equipment In UK Гордиев узел
Гордиев узел ВОЗМОЖНАЯ ОБСТАНОВКА на территории муниципального образования в результате нападения вероятного противника
ВОЗМОЖНАЯ ОБСТАНОВКА на территории муниципального образования в результате нападения вероятного противника В. М. Гаршин «Лягушка-путешественница»
В. М. Гаршин «Лягушка-путешественница» История русского языка
История русского языка СКАЖИ КУРЕНИЮ НЕТ!
СКАЖИ КУРЕНИЮ НЕТ! Визитная карточка школы2009 – 2010 учебный год
Визитная карточка школы2009 – 2010 учебный год Структура дослідження обґрунтування актуальності і визначення теми дослідження, його мети, завдання
Структура дослідження обґрунтування актуальності і визначення теми дослідження, його мети, завдання Миссия «Безлимит без лишних условий»
Миссия «Безлимит без лишних условий»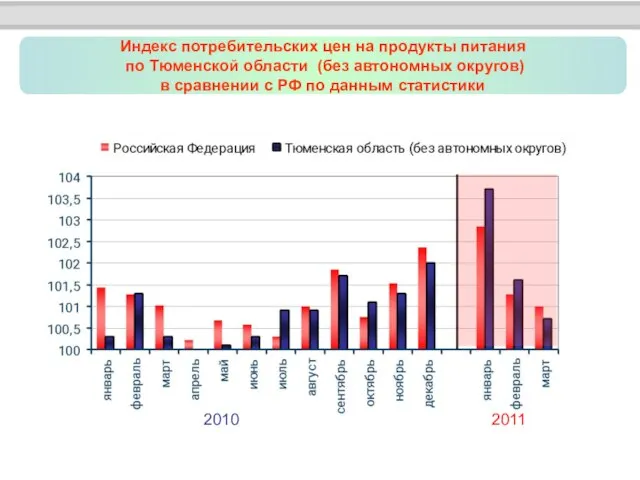 Индекс потребительских цен на продукты питания по Тюменской области (без автономных округов) в сравнении с РФ по данным статисти
Индекс потребительских цен на продукты питания по Тюменской области (без автономных округов) в сравнении с РФ по данным статисти Как добывается руда
Как добывается руда