Содержание
- 2. Литература Березин Б.Д., Березин Д.В. Курс современной органической химии. М.: Высшая школа, 1999. – 768 с.
- 3. Органическая химия Химия углеводородов и их функциональных производных Углеводороды (алифатические, ароматические, ациклические, циклические) Соединения, содержащие гетероатомы
- 4. Теория строения органических соединений А.М. Бутлерова Все атомы в молекуле органического соединения связаны друг с другом
- 5. Наглядный пример теории А.М. Бутлерова Жидкость Температура плавления –114 °C Температура кипения 78 °C Плотность 0,789
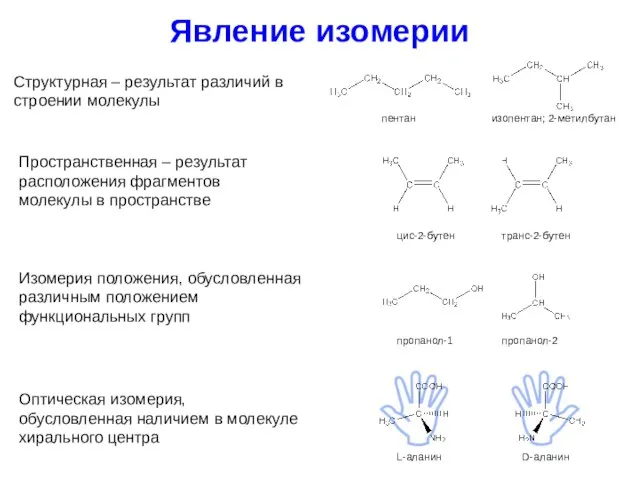
- 6. Явление изомерии Структурная – результат различий в строении молекулы Пространственная – результат расположения фрагментов молекулы в
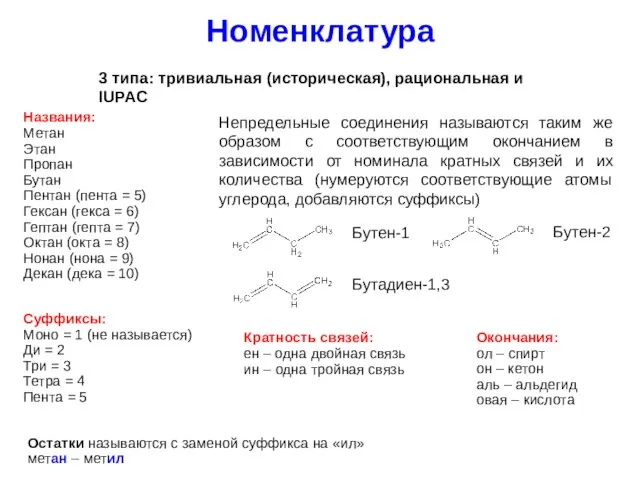
- 7. Номенклатура 3 типа: тривиальная (историческая), рациональная и IUPAC Названия: Метан Этан Пропан Бутан Пентан (пента =
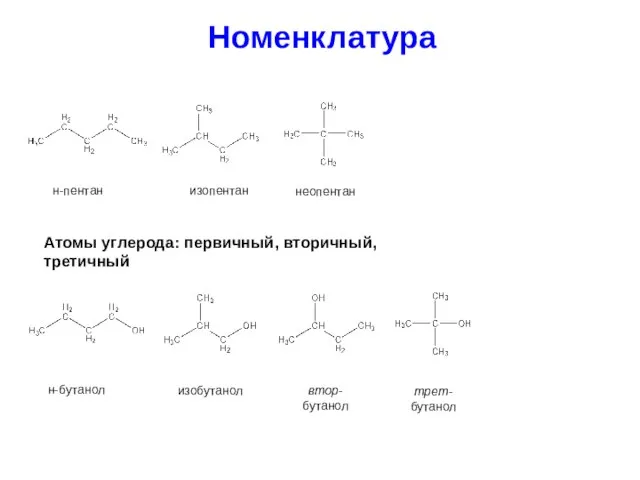
- 8. Номенклатура н-пентан изопентан неопентан Атомы углерода: первичный, вторичный, третичный н-бутанол изобутанол втор-бутанол трет-бутанол
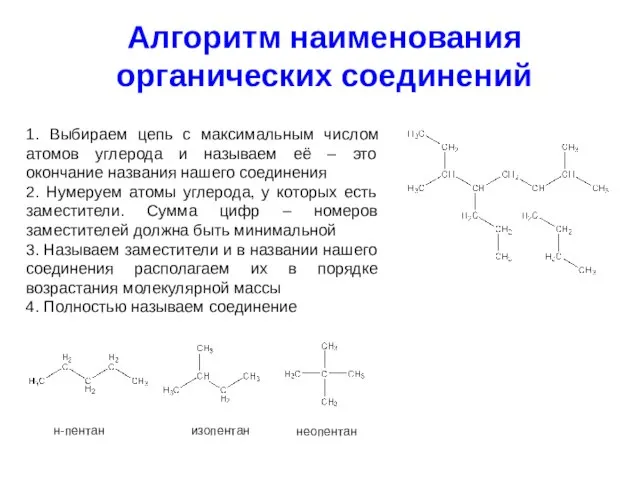
- 9. Алгоритм наименования органических соединений 1. Выбираем цепь с максимальным числом атомов углерода и называем её –
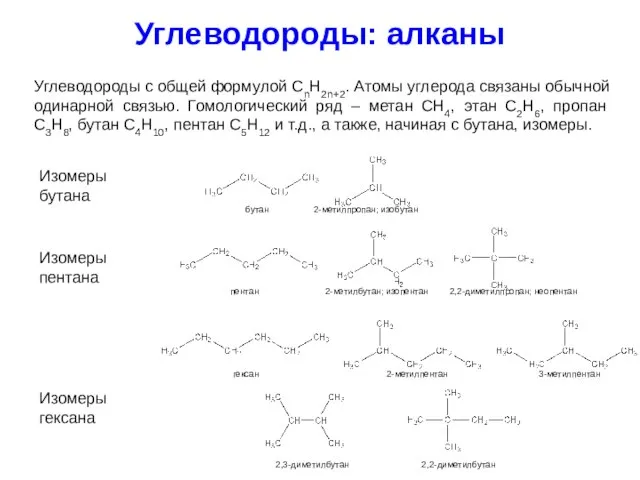
- 10. Углеводороды: алканы Углеводороды с общей формулой CnH2n+2. Атомы углерода связаны обычной одинарной связью. Гомологический ряд –
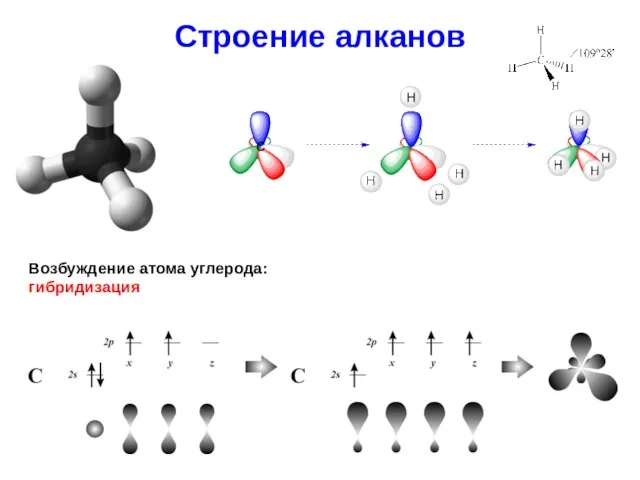
- 11. Строение алканов Возбуждение атома углерода: гибридизация
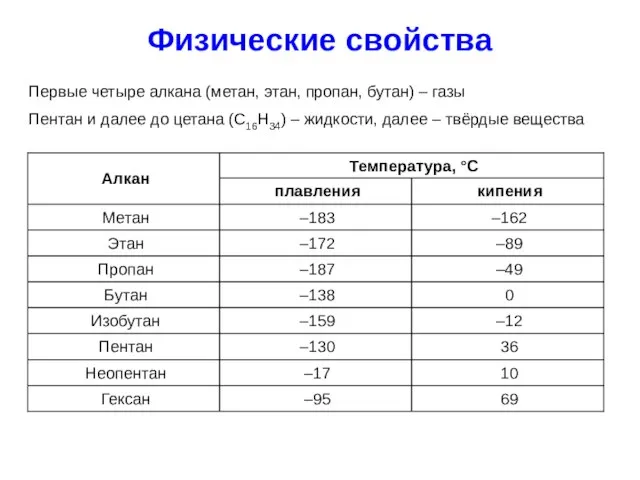
- 12. Физические свойства Первые четыре алкана (метан, этан, пропан, бутан) – газы Пентан и далее до цетана
- 13. Механизм радикальных реакций 1. Инициирование – необходимо для протекания радикальных реакций 2. Рост цепи 3. Рост
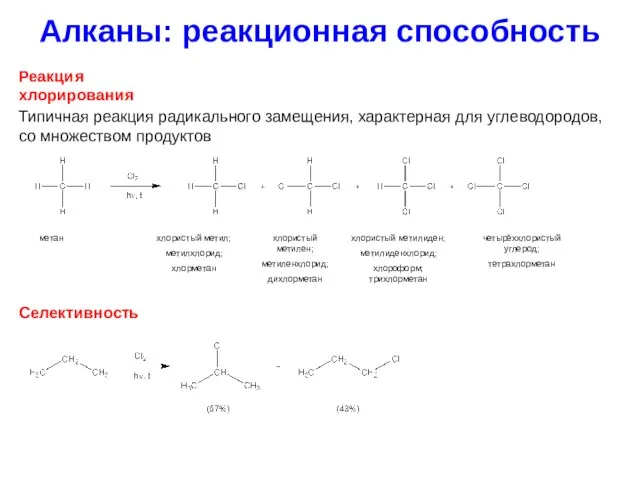
- 14. Алканы: реакционная способность Реакция хлорирования Типичная реакция радикального замещения, характерная для углеводородов, со множеством продуктов метан
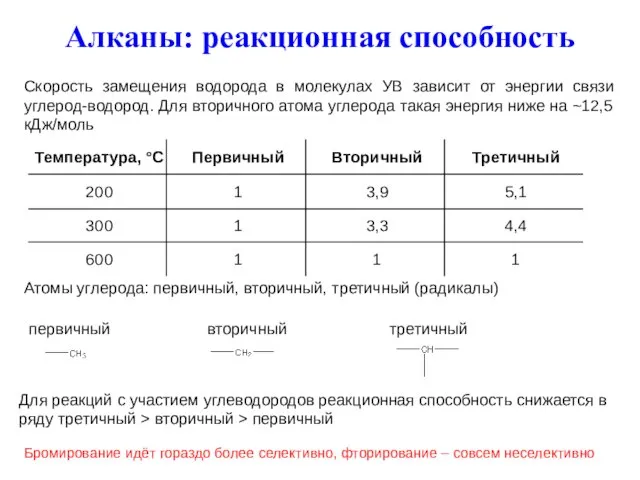
- 15. Алканы: реакционная способность Атомы углерода: первичный, вторичный, третичный (радикалы) первичный вторичный третичный Для реакций с участием
- 16. Реакции 1. Сульфохлорирование 2. Нитрование (реакция Коновалова) 3. Крекинг
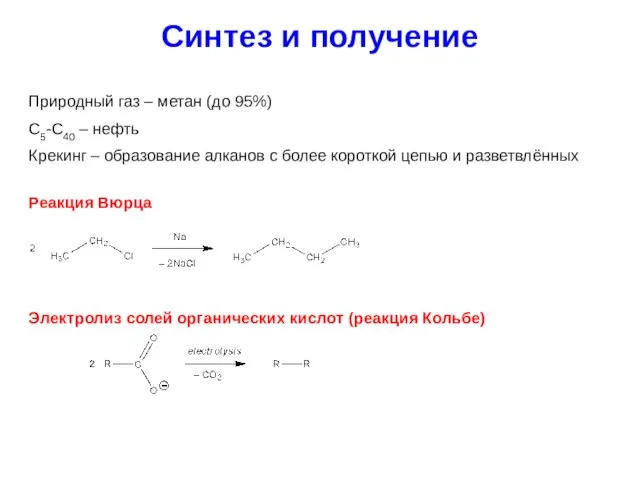
- 17. Синтез и получение Природный газ – метан (до 95%) С5-С40 – нефть Крекинг – образование алканов
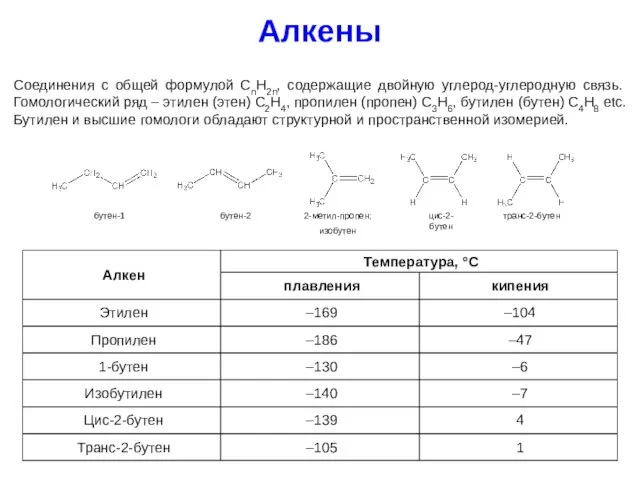
- 18. Алкены Соединения с общей формулой CnH2n, содержащие двойную углерод-углеродную связь. Гомологический ряд – этилен (этен) C2H4,
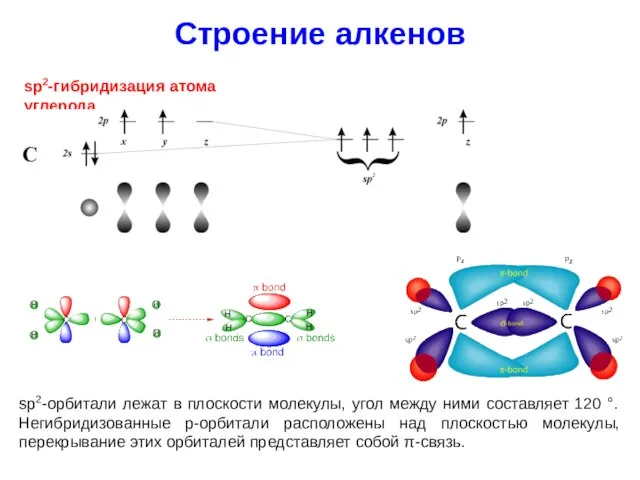
- 19. Строение алкенов sp2-гибридизация атома углерода sp2-орбитали лежат в плоскости молекулы, угол между ними составляет 120 °.
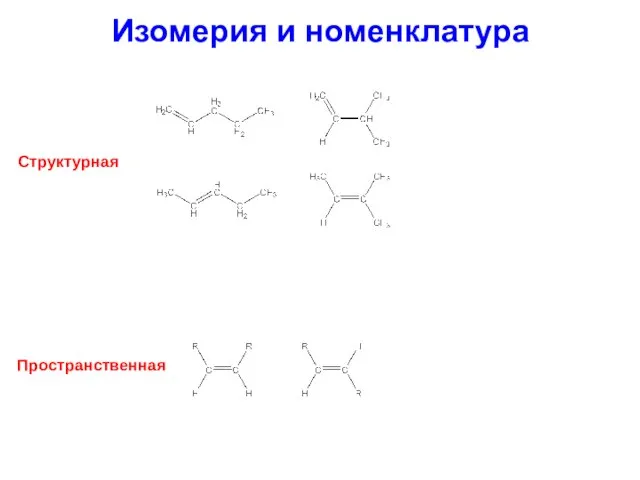
- 20. Изомерия и номенклатура Структурная Пространственная
- 21. Химические свойства алкенов Во многом обусловлены наличием двойной углерод-углеродной связи В таких реакциях участвуют галогены, галогенводороды,
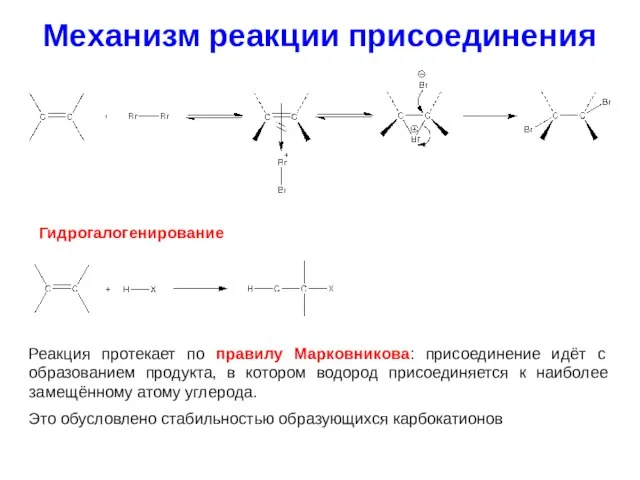
- 22. Механизм реакции присоединения Гидрогалогенирование Реакция протекает по правилу Марковникова: присоединение идёт с образованием продукта, в котором
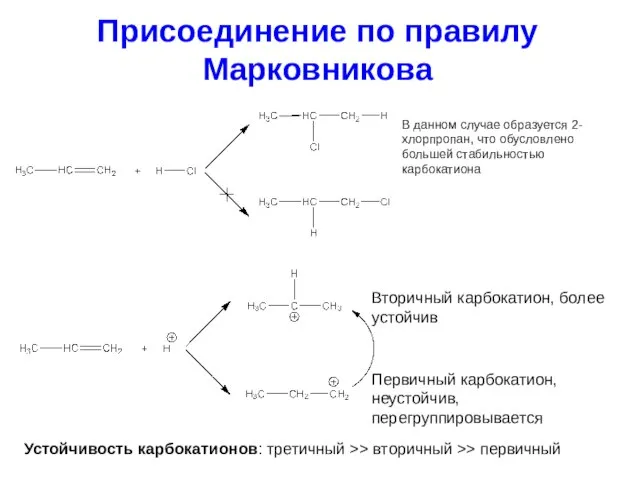
- 23. Присоединение по правилу Марковникова В данном случае образуется 2-хлорпропан, что обусловлено большей стабильностью карбокатиона Вторичный карбокатион,
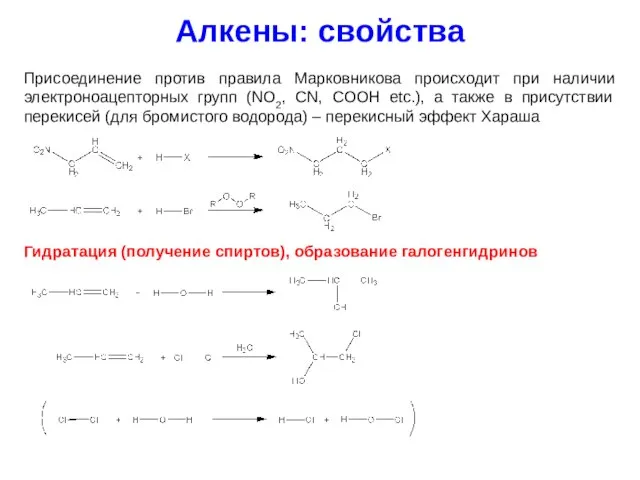
- 24. Алкены: свойства Присоединение против правила Марковникова происходит при наличии электроноацепторных групп (NO2, CN, COOH etc.), а
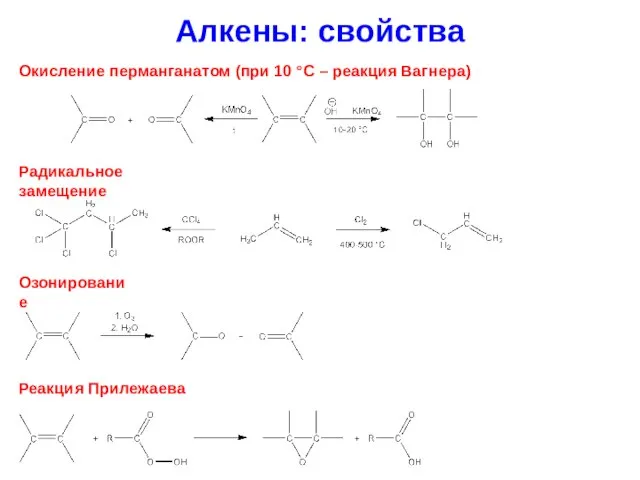
- 25. Алкены: свойства Окисление перманганатом (при 10 °C – реакция Вагнера) Радикальное замещение Озонирование Реакция Прилежаева
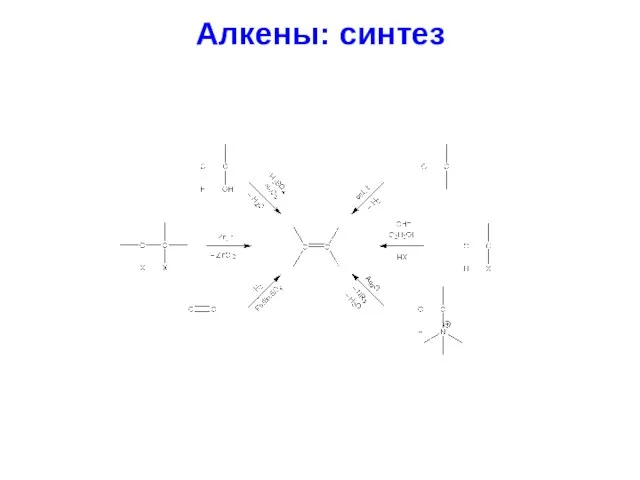
- 26. Алкены: синтез
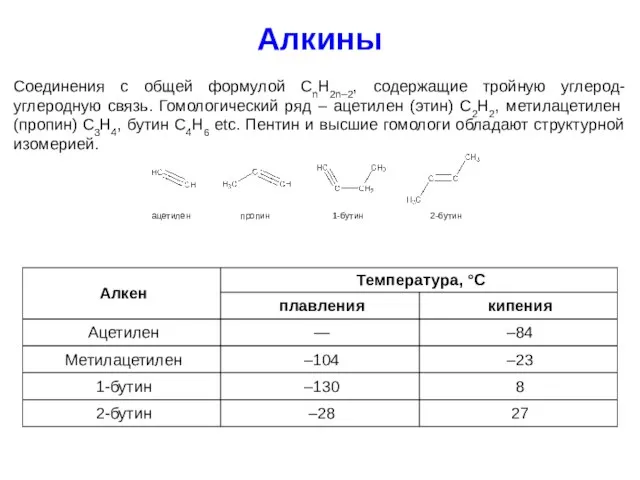
- 27. Алкины Соединения с общей формулой CnH2n–2, содержащие тройную углерод-углеродную связь. Гомологический ряд – ацетилен (этин) C2H2,
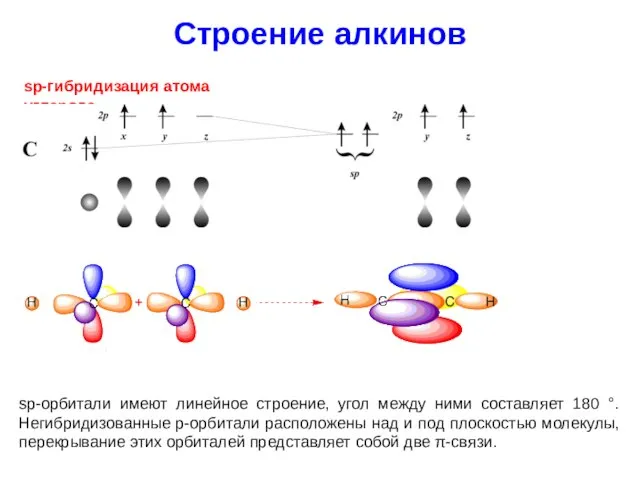
- 28. Строение алкинов sp-гибридизация атома углерода sp-орбитали имеют линейное строение, угол между ними составляет 180 °. Негибридизованные
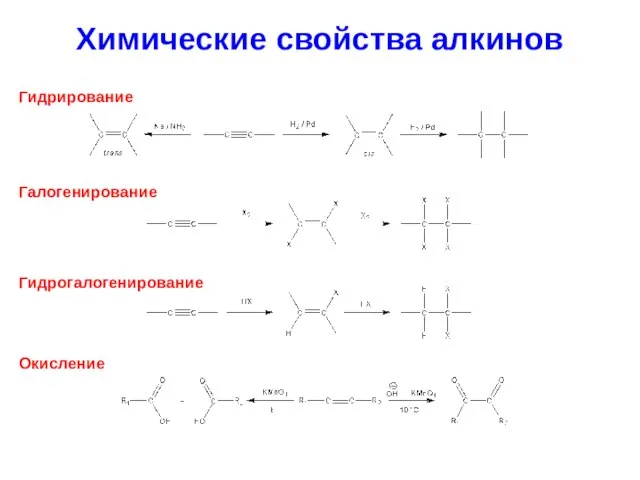
- 29. Химические свойства алкинов Гидрирование Галогенирование Гидрогалогенирование Окисление
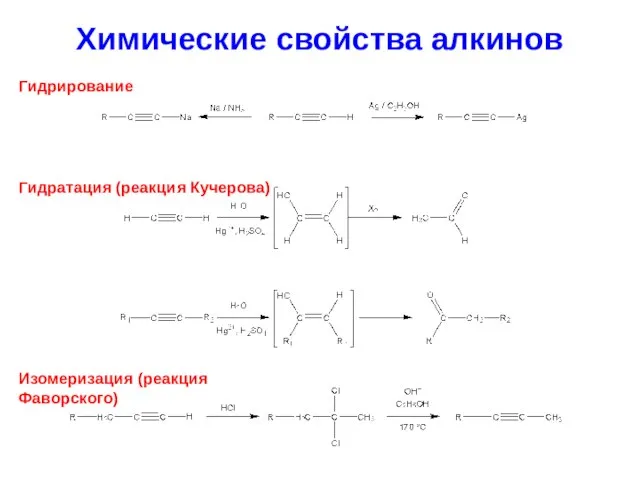
- 30. Химические свойства алкинов Гидрирование Гидратация (реакция Кучерова) Изомеризация (реакция Фаворского)
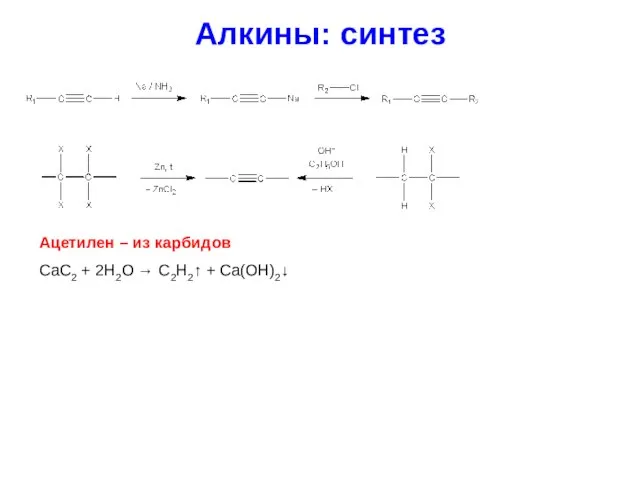
- 31. Алкины: синтез Ацетилен – из карбидов CaC2 + 2H2O → C2H2↑ + Ca(OH)2↓
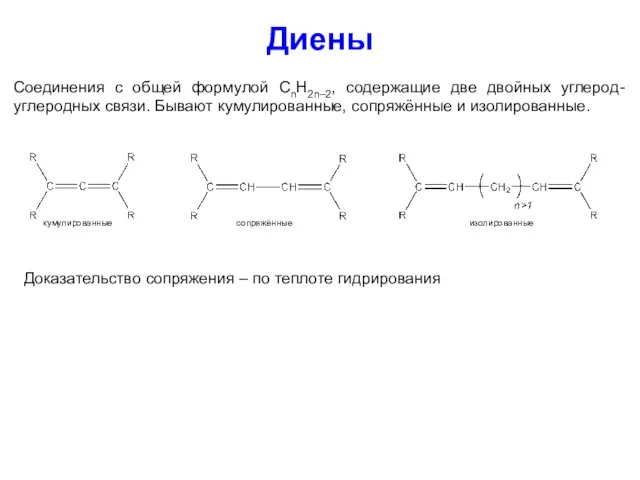
- 32. Диены Соединения с общей формулой CnH2n–2, содержащие две двойных углерод-углеродных связи. Бывают кумулированные, сопряжённые и изолированные.
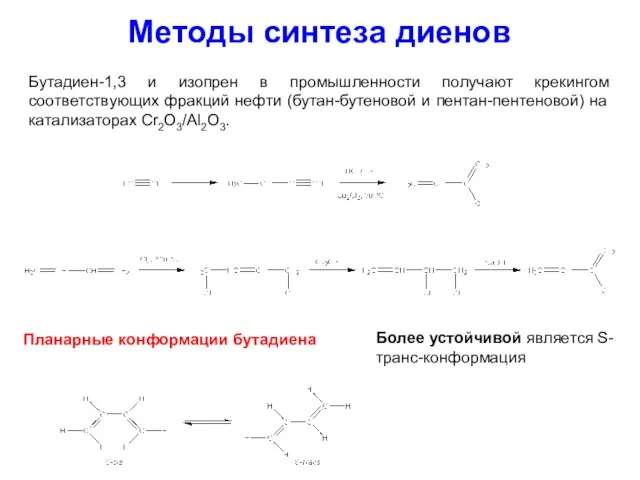
- 33. Методы синтеза диенов Бутадиен-1,3 и изопрен в промышленности получают крекингом соответствующих фракций нефти (бутан-бутеновой и пентан-пентеновой)
- 34. Химические свойства Соотношение продуктов реакции электрофильного присоединения (1,2 и 1,4) зависит от температуры Реакция электрофильного присоединения
- 36. Скачать презентацию







 Станковая скульптура: бюст
Станковая скульптура: бюст Отчёт директората цифрового телевидения Alma tv за период с 13 по 19 Октября 2017г
Отчёт директората цифрового телевидения Alma tv за период с 13 по 19 Октября 2017г Системный подход на благо людей и природы
Системный подход на благо людей и природы Живете
Живете Этико-правовые проблемы конца жизни человека
Этико-правовые проблемы конца жизни человека ПРИЧИНЫ ВОЗНИКНОВЕНИЯ ПОЖАРОВ В ЖИЛЫХ И ОБЩЕСТВЕННЫХ ЗДАНИЯХ.
ПРИЧИНЫ ВОЗНИКНОВЕНИЯ ПОЖАРОВ В ЖИЛЫХ И ОБЩЕСТВЕННЫХ ЗДАНИЯХ. УСПЕНСКИЙ СОБОР
УСПЕНСКИЙ СОБОР Опале листя: користь чи шкода
Опале листя: користь чи шкода Государственное управление в области природопользования и охраны окружающей среды
Государственное управление в области природопользования и охраны окружающей среды Магнитная гидродинамика солнечных явлений
Магнитная гидродинамика солнечных явлений Пишем проект!
Пишем проект! Этапы речевого развития
Этапы речевого развития Растения Чувашской республики
Растения Чувашской республики Эффективность стратегии диверсификации на российском рынке(эмпирическое исследование)
Эффективность стратегии диверсификации на российском рынке(эмпирическое исследование) Стресс и пути его преодоления
Стресс и пути его преодоления Интерактивные формы и методы в преподавании русского языка и литературы. Тема: Групповые формы работы на уроках русского языка и л
Интерактивные формы и методы в преподавании русского языка и литературы. Тема: Групповые формы работы на уроках русского языка и л Западный и Восточный типы культуры
Западный и Восточный типы культуры Упражнение Настроение
Упражнение Настроение Выполняй правила безопасности на дороге!
Выполняй правила безопасности на дороге! Тихонова Тамара Вячеславовна учитель истории и обществознания ГОУ лицей № 150
Тихонова Тамара Вячеславовна учитель истории и обществознания ГОУ лицей № 150 ОРКиСЭ
ОРКиСЭ Непревзойденные преимущества систем T2Red + T2Reflecta
Непревзойденные преимущества систем T2Red + T2Reflecta Модели данных
Модели данных  Модель организации внеурочной деятельности на основе краткосрочных курсов
Модель организации внеурочной деятельности на основе краткосрочных курсов История развития системы железнодорожной автоматики, применяемые на железнодорожном транспорте (АТМ) в России
История развития системы железнодорожной автоматики, применяемые на железнодорожном транспорте (АТМ) в России Высокоранговые и Низкопримативные правят миром
Высокоранговые и Низкопримативные правят миром Ртуть
Ртуть Презентация на тему: клавиатура.Авторы: Суханов Г.
Презентация на тему: клавиатура.Авторы: Суханов Г.