Содержание
- 2. 1-Е ПОЛОЖЕНИЕ ТЭД. Все вещества по их способности проводить электрический ток в растворах делятся на электролиты
- 3. ВЕЩЕСТВА В РАСТВОРАХ Электролиты (водные растворы проводят эл.ток) Неэлектролиты (водные растворы не проводят эл. ток) Вещества
- 4. ЗАДАНИЯ К I-МУ ПОЛОЖЕНИЮ ТЭД Укажите вид связи и принадлежность данных веществ к электролитам и неэлектролитам:
- 5. II-Е ПОЛОЖЕНИЕ ТЭД В РАСТВОРАХ ЭЛЕКТРОЛИТЫ ДИССОЦИИРУЮТ, Т.Е. РАСПАДАЮТСЯ НА ИОНЫ. Ионы – ЭТО ПОЛОЖИТЕЛЬНО ИЛИ
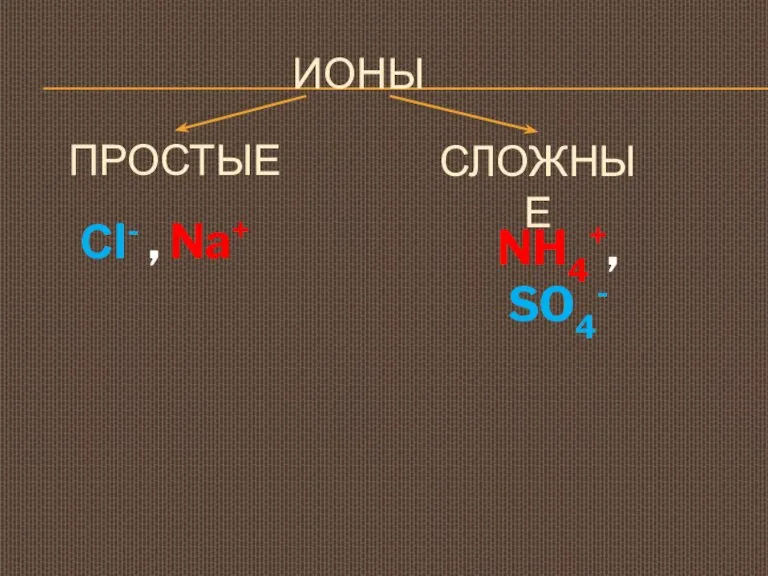
- 6. ИОНЫ ПРОСТЫЕ Сl- , Na+ СЛОЖНЫЕ NH4+, SO4-
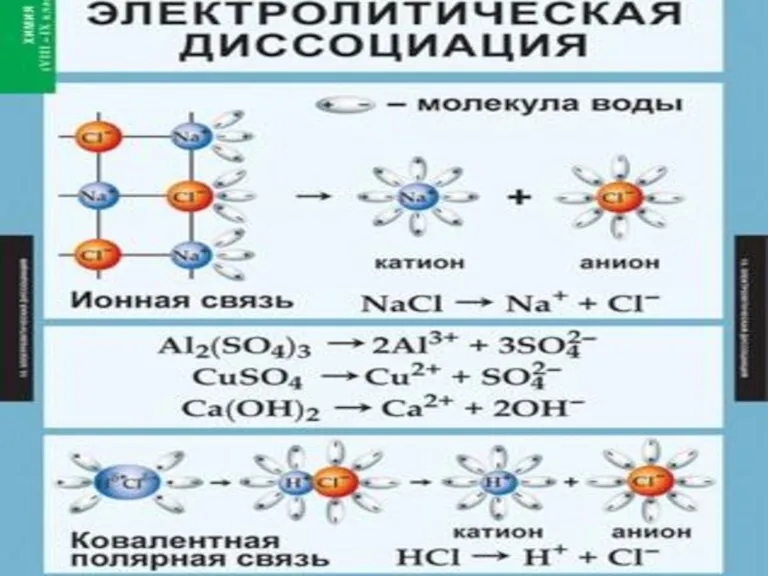
- 7. III-Е ПОЛОЖЕНИЕ ТЭД ПРИЧИНОЙ ДИССОЦИАЦИИ ЭЛЕКТРОЛИТА ЯВЛЯЕТСЯ ЕГО ВЗАИМОДЕЙСТВИЕ С МОЛЕКУЛАМИ ВОДЫ (ГИДРАТАЦИЯ). Вещества с ионной
- 9. IV-Е ПОЛОЖЕНИЕ ТЭД Под действием электрического тока положительные ионы движутся к катоду и называются катионами, а
- 10. Типы ионов По заряду: положительные, или катионы: Катионы металлов ( Мn+ ) Катион водорода (H+) Катион
- 11. Упрощённо процесс диссоциации изображают с помощью уравнений диссоциации: NaCl = Na+ + Cl- HCl = H+
- 12. ЗАДАНИЯ КО II-МУ ПОЛОЖЕНИЮ ТЭД Назовите частицы: а) H, H2 , H+ ; б) Cl2 ,
- 13. V-Е ПОЛОЖЕНИЕ ТЭД Разные электролиты по-разному диссоциируют на ионы и поэтому делятся на: Сильные (соли, щелочи,
- 14. VI-Е ПОЛОЖЕНИЕ ТЭД Свойства растворов электролитов определяются свойствами тех ионов, которые они образуют при диссоциации. По
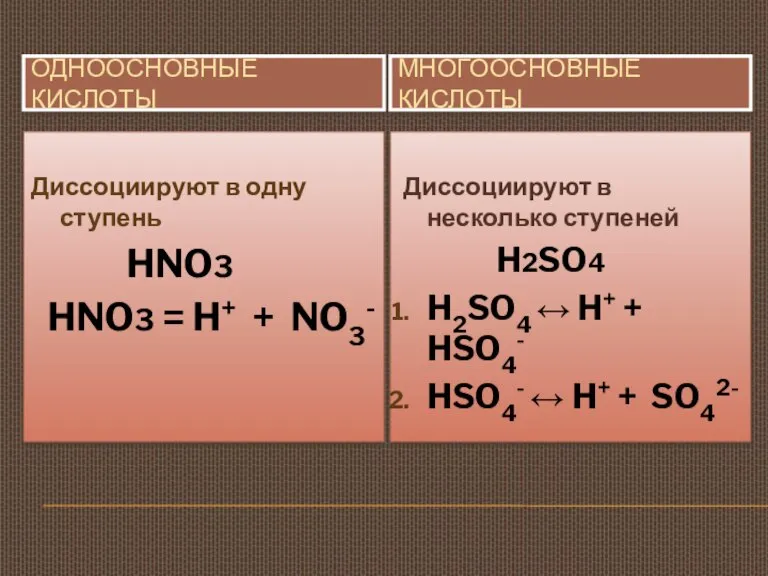
- 15. ОДНООСНОВНЫЕ КИСЛОТЫ МНОГООСНОВНЫЕ КИСЛОТЫ Диссоциируют в одну ступень HNO3 HNO3 = H+ + NO3- Диссоциируют в
- 16. 2. ОСНОВАНИЯ – ЭТО ЭЛЕКТРОЛИТЫ, КОТОРЫЕ ДИССОЦИИРУЮТ НА КАТИОНЫ МЕТАЛЛА И АНИОНЫ ГИДРОКСОГРУПП ОДНОКИСЛОТНЫЕ ОСНОВАНИЯ МНОГОКИСЛОТНЫЕ
- 17. 3. СОЛИ – ЭТО ЭЛЕКТРОЛИТЫ, КОТОРЫЕ ДИССОЦИИРУЮТ НА КАТИОНЫ МЕТАЛЛА И АНИОНЫ КИСЛОТНОГО ОСТАТКА Независимо от
- 18. ЗАДАНИЕ К 6-МУ ПОЛОЖЕНИЮ Напишите уравнения диссоциации следующих веществ: HCl, H3PO4, KOH
- 20. Скачать презентацию














 Мастер украшения помогает сделать праздник
Мастер украшения помогает сделать праздник Отчет о научно-организационной деятельности Президиума АН РБ в 2009 году
Отчет о научно-организационной деятельности Президиума АН РБ в 2009 году Глянец в дизайне. Фотоальбом
Глянец в дизайне. Фотоальбом Проблема адекватности восприятия текста
Проблема адекватности восприятия текста Презентация на тему Оборона Сталинграда
Презентация на тему Оборона Сталинграда  Красная книга России (4 класс)
Красная книга России (4 класс) Введение в техническую графику. Тест
Введение в техническую графику. Тест Этапы проектной деятельности
Этапы проектной деятельности Особенности питания детей грудного возраста
Особенности питания детей грудного возраста До свидания! До новых встреч!
До свидания! До новых встреч! Устройство компьютера
Устройство компьютера Автомат световых эффектов. Схема
Автомат световых эффектов. Схема Изменяющаяся роль медицинских представителей и фармацевтов в аптеках Евгения Домнина Руководитель проектов Москва. 7 декабря 2
Изменяющаяся роль медицинских представителей и фармацевтов в аптеках Евгения Домнина Руководитель проектов Москва. 7 декабря 2 I возрастная ступень комплекса ГТО (от 6 до 8 лет)
I возрастная ступень комплекса ГТО (от 6 до 8 лет) Сказка в картинках - презентация
Сказка в картинках - презентация Презентация на тему Применение солей
Презентация на тему Применение солей Иконопись на Смоленщине
Иконопись на Смоленщине Создание портфолио
Создание портфолио Демократическое правовое государство
Демократическое правовое государство Информационная безопасность в юриспруденции. Лекция №2
Информационная безопасность в юриспруденции. Лекция №2 Роль стандартизации в инновационной сфере
Роль стандартизации в инновационной сфере Дестабилизирующие факторы современности
Дестабилизирующие факторы современности Презентация на тему Сахарный диабет
Презентация на тему Сахарный диабет Литвин, преза, готовая
Литвин, преза, готовая Деньги и инстинкты
Деньги и инстинкты Построение Сечения объемных фигур в Paint
Построение Сечения объемных фигур в Paint Город мечты
Город мечты Страхование строительно-монтажных рисков и послепусковых гарантийных обязательств
Страхование строительно-монтажных рисков и послепусковых гарантийных обязательств