Содержание
- 2. Цели урока Обобщить сведения об ионах Закрепить умение записывать процесс диссоциации при помощи химических знаков и
- 3. ПРОВЕРЬ СВОИ ЗНАНИЯ Вещества, растворы которых проводят электрический ток, называют ……… Процесс распада электролита на ионы
- 4. ПРОВЕРЬ СВОИ ЗНАНИЯ (дополните схему) ЭЛЕКТРОЛИТЫ (по степени электролитической диссоциации )
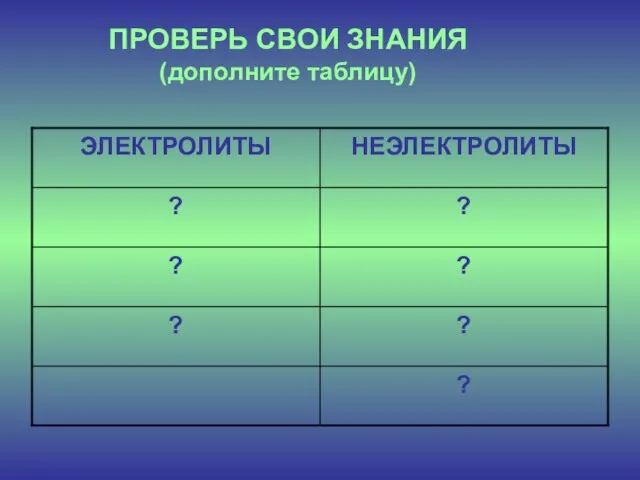
- 5. ПРОВЕРЬ СВОИ ЗНАНИЯ (дополните таблицу)
- 6. Расскажите о последовательности процессов, происходящих при диссоциации: Веществ с ионной связью Ориентация Гидратация Диссоциация Веществ с
- 7. История открытия теории электролитической диссоциации В 1887 году шведский химик Сванте Аррениус сформулировал основные положения теории
- 8. Основные положения ТЭД При растворении в воде электролиты диссоциируют (распадаются) на положительные и отрицательные ионы. NaCl
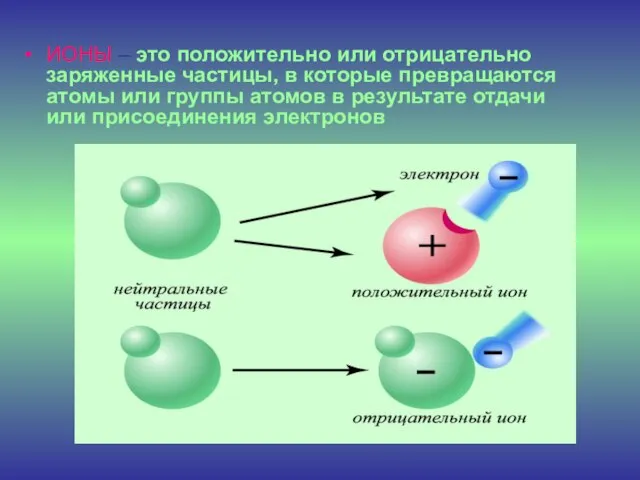
- 9. ИОНЫ – это положительно или отрицательно заряженные частицы, в которые превращаются атомы или группы атомов в
- 10. ЭЛЕКТРОННЫЕ ФОРМУЛЫ +11Na0 2ē 8ē 1ē +11Na+ 2ē 8ē атом ион +17Cl0 2ē 8ē 7ē +17Cl0
- 11. ИОНЫ (по составу) ПРОСТЫЕ Например: Cl- K+ СЛОЖНЫЕ Например: NO3- SO42-
- 12. Основные положения ТЭД 2. Причиной диссоциации электролита в водном растворе является его гидратация, т.е. взаимодействие электролита
- 13. ИОНЫ (по наличию водной оболочки) ГИДРАТИРОВАННЫЕ Например: В растворах и кристаллогидратах CuSO4 * 5H2O Na2SO4* 10H2O
- 14. Основные положения ТЭД 3. Под действием электрического тока положительно заряженные ионы движутся к отрицательному полюсу источника
- 15. ИОНЫ (по знаку заряда) КАТИОНЫ положительно заряженные частицы АНИОН отрицательно заряженные частицы
- 16. Основные положения ТЭД 4. Электролитическая диссоциация – процесс обратимый для слабых электролитов. Наряду с процессом диссоциации
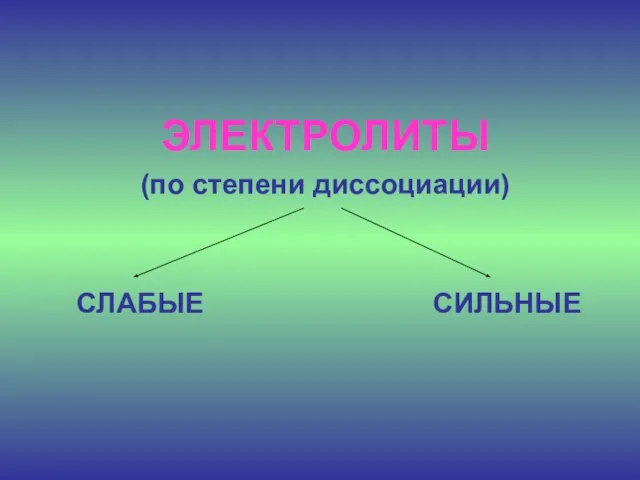
- 17. Основные положения ТЭД 5. Не все электролиты в одинаковой мере диссоциируют на ионы.
- 18. ЭЛЕКТРОЛИТЫ (по степени диссоциации) СЛАБЫЕ СИЛЬНЫЕ
- 19. Основные положения ТЭД 6. Химические свойства растворов электролитов определяются свойствами тех ионов, которые они образуют при
- 20. ЭЛЕКТРОЛИТЫ (по характеру образующихся ионов) КИСЛОТЫ ОСНОВАНИЯ СОЛИ
- 21. ЗАДАНИЕ Составьте возможные уравнения электролитической диссоциации веществ в водных растворах. 1) HCl 2) HNO3 3) Н2SiO3
- 22. ДОПИШИТЕ ОПРЕДЕЛЕНИЕ Кислоты – это электролиты, которые диссоциируют на катионы и анионы
- 23. КИСЛОТЫ электролиты, которые при диссоциации образуют катионы водорода и анионы кислотного остатка. HCl = H+ +
- 24. Многоосновные кислоты диссоциируют ступенчато H3PO4 (фосфорная кислота) 1) Образование дигидрофосфат-ионов H3PO4 ↔ H+ + H2PO4- 2)
- 25. ЗАДАНИЕ Составьте возможные уравнения электролитической диссоциации веществ в водных растворах. 1) NaOH 2) KOH 3) Fe(OH)2
- 26. ДОПИШИТЕ ОПРЕДЕЛЕНИЕ Основания – это электролиты, которые диссоциируют на катионы и анионы
- 27. ОСНОВАНИЯ электролиты, которые при диссоциации образуют катионы металла и гидроксид-анионы. NaOH = Na+ + OH- KOH
- 28. Многокислотные основания диссоциируют ступенчато Ba(OH)2 (гидроксид бария) 1) Образование гидроксо-ионов бария Ba(OH)2 ↔ OH- + BaOH+
- 29. ЗАДАНИЕ Составьте возможные уравнения электролитической диссоциации веществ в водных растворах. 1) NaCl 2) KNO3 3) BaSO4
- 30. ДОПИШИТЕ ОПРЕДЕЛЕНИЕ Cоли – это электролиты, которые диссоциируют на катионы и анионы
- 31. СОЛИ электролиты, которые при диссоциации образуют катионы металла (или аммония NH4) и анионы кислотных остатков. K3PO4
- 32. ПРОВЕРЬ СВОИ ЗНАНИЯ Пользуясь таблицей растворимости, приведите примеры трех веществ, которые в растворах образуют сульфат-ионы. Запишите
- 33. Разложение хлорида меди электрическим током
- 34. ОЦЕНКИ ЗА УРОК
- 36. Скачать презентацию






























 Об итогах реализации федеральными органами исполнительной власти и высшими исполнительными органами государственной власти суб
Об итогах реализации федеральными органами исполнительной власти и высшими исполнительными органами государственной власти суб Андрей Тарковский, фильм Зеркало (кадры из фильма)
Андрей Тарковский, фильм Зеркало (кадры из фильма) Тема практического зантия: Болезни органов пищеварительной системы 2 1- Цель занятия. Приобретение знаний об этиологии, патогенезе
Тема практического зантия: Болезни органов пищеварительной системы 2 1- Цель занятия. Приобретение знаний об этиологии, патогенезе Наш школьный двор
Наш школьный двор Одновременная генерация TE1 и TE2 мод с разными длинами волн в полупроводниковом лазере с туннельным переходом
Одновременная генерация TE1 и TE2 мод с разными длинами волн в полупроводниковом лазере с туннельным переходом Сплав по реке Быстрой
Сплав по реке Быстрой Информатизация образования
Информатизация образования Грамматическая основа предложения
Грамматическая основа предложения Демидова Татьяна кандидат психологических наук, доцент, заведующая кафедрой психологии и педагогики художественного образовани
Демидова Татьяна кандидат психологических наук, доцент, заведующая кафедрой психологии и педагогики художественного образовани Комплексная механизация очистных работ в условиях ГУП ЛНР ЦЕТРУГОЛЬ филиал Шахта Никанор-Новая
Комплексная механизация очистных работ в условиях ГУП ЛНР ЦЕТРУГОЛЬ филиал Шахта Никанор-Новая Театр ХХ века
Театр ХХ века Пасха в кубанской семье
Пасха в кубанской семье шоколадная девчонка
шоколадная девчонка Zoryan Erik’s visual resume
Zoryan Erik’s visual resume Творчество, творческая деятельность. Креативность
Творчество, творческая деятельность. Креативность Сопряжения прямых линий и окружностей
Сопряжения прямых линий и окружностей Возможности для самореализации и развития талантов в ресурсных центрах дополнительного образования
Возможности для самореализации и развития талантов в ресурсных центрах дополнительного образования Рекуперация паров в резервуарах с понтоном (РП)
Рекуперация паров в резервуарах с понтоном (РП) задача
задача К. Паустовский «Барсучий нос»
К. Паустовский «Барсучий нос» DAFNE
DAFNE Накануне второй мировой войны
Накануне второй мировой войны Знающий тайну шахмат - знает тайну жизни
Знающий тайну шахмат - знает тайну жизни Моделирование бизнес-процессов
Моделирование бизнес-процессов Путешествие капельки
Путешествие капельки THE ECONOMICS OF LABOR MARKETS
THE ECONOMICS OF LABOR MARKETS Армейский экспресс
Армейский экспресс Землетрясение
Землетрясение