Содержание
- 2. Поддубная Ольга Владимировна, канд. с.-х. наук, доцент Тел. (8-0-2233) 59489 кафедра Е-mail: [email protected] , [email protected]
- 3. Литература Химия: Учебно-методический комплекс: учебно-методическое пособие / О. В. Поддубная, И. В. Ковалева и др. –
- 4. Литература Цыганов, А. Р. Сборник задач и упражнений по химии: Учеб. пособие / А. Р. Цыганов,
- 5. Литература Химия. Учебно-методический комплекс : учебно-методическое пособие / О. В. Поддубная, И. В. Ковалева, Е. В.
- 6. Литература Химия. Общая химия с основами аналитической : учебно-методическое пособие / А. Р. Цыганов [и др.].
- 7. План: Химия как наука о веществах и их превращениях. Цели и задачи изучения дисциплины. Международная номенклатура
- 8. 1. Химия как наука о веществах и их превращениях. Цели и задачи изучения дисциплины.
- 9. Химия - наука о составе, строении, свойствах и превращениях веществ. Цель изучения химии - освоить современные
- 10. 2.Международная номенклатура неорганических соединений.
- 11. Основой химических веществ являются химические соединения. В настоящее время известно более 20 миллионов химических соединений. Несмотря
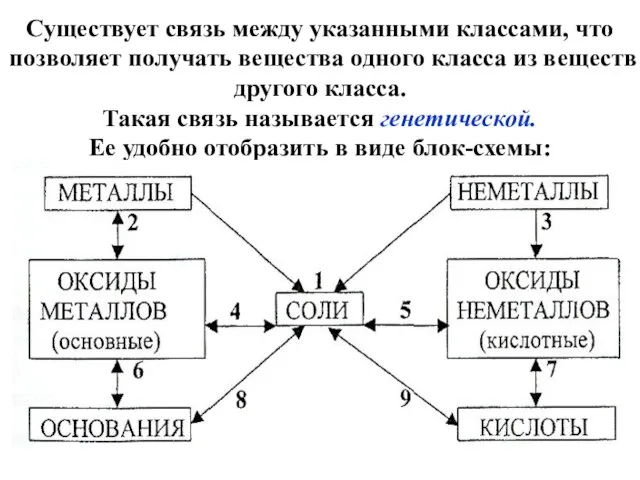
- 12. Существует связь между указанными классами, что позволяет получать вещества одного класса из веществ другого класса. Такая
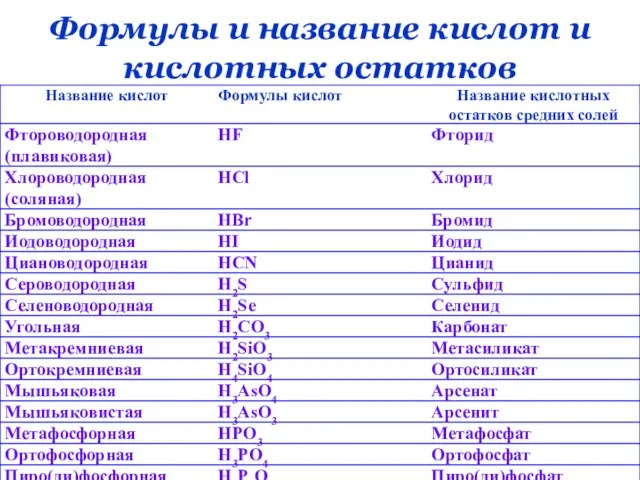
- 13. Формулы и название кислот и кислотных остатков
- 14. 3.Основные понятия химии В химических расчетах используется единица количества вещества – моль. Один моль любого вещества
- 15. 4.Основные стехиометрические законы Стехиометрия – раздел химии, который рассматривает количественные соотношения между реагирующими веществами. Теоретической основой
- 16. 4.1. Закон сохранения массы и энергии: (Ломоносов, 1748) Масса веществ, вступающих в реакцию равна массе веществ,
- 17. 4.2.Закон постоянства состава (Пруст, 1808) Любое сложное вещество молекулярного строение независимо от способа получения имеет постоянный
- 18. 4.3. Закон кратных отношений (Дальтон, 1803) Атомы в молекуле, а также их массы относятся друг к
- 19. 4.4. Закон простых объёмных отношений (Гей-Люссак, 1808) Объёмы вступающих в реакцию газов, а также объёмы газообразных
- 20. 4.5. Закон Авогадро В равных объёмах различных газов при одинаковых условиях (p,t) содержится одинаковое число молекул.
- 21. 4.6. Закон Менделеева – Клапейрона pV = nRT ; R = 8,314; если р = Па,
- 22. 5.Химический эквивалент. Закон эквивалентов. Эквивалент – условная или реальная частица вещества, которая в кислотно-основной реакции соответствует
- 23. Фактор эквивалентности (fэкв) – доля условной или реальной частицы эквивалента вещества. fэкв = 1/Z , где
- 24. При вычислении молярных масс эквивалентов веществ необходимо учесть следующее: молярная масса эквивалента оксида равна сумме молярных
- 25. Эквивалентные объёмы газов: Vэкв(½ Н2) = 11,2 л/моль; Vэкв(1/4О2) = 5,6 л/моль.
- 26. Закон эквивалентов массы веществ m, реагирующих друг с другом или получающихся в результате реакции, пропорциональны молярным
- 28. Скачать презентацию






















 Класс Земноводные или Амфибии 7 класс
Класс Земноводные или Амфибии 7 класс Правописание приставок, оканчивающихся на з (с)
Правописание приставок, оканчивающихся на з (с) Характеристика личности экстремиста
Характеристика личности экстремиста Оказание первой медицинской помощи Ожоги Отравления
Оказание первой медицинской помощи Ожоги Отравления  Информация и знания. Информационные процессы
Информация и знания. Информационные процессы Презентация Решение задач С4
Презентация Решение задач С4 Художник Шишкин Иван Иванович. Картины о зиме
Художник Шишкин Иван Иванович. Картины о зиме Это программа для семей города Луганска, которые добровольно, без материального вознаграждения, берут на себя роль новых мам, пап,
Это программа для семей города Луганска, которые добровольно, без материального вознаграждения, берут на себя роль новых мам, пап,  example
example Контраргументация. Опровержение
Контраргументация. Опровержение Цели и задачи Службы комплаенс
Цели и задачи Службы комплаенс Режиссёр – кто он? Вводное занятие
Режиссёр – кто он? Вводное занятие Карбоновые кислоты
Карбоновые кислоты Основы теории центробежных нагнетателей. Лекция 03
Основы теории центробежных нагнетателей. Лекция 03 ТИПЫ КОСТРОВ
ТИПЫ КОСТРОВ Презентация на тему Семейное древо
Презентация на тему Семейное древо  Лекция №7_2021
Лекция №7_2021 Что такое язык сценариев Action Script?
Что такое язык сценариев Action Script? Описание общего впечатления от картины
Описание общего впечатления от картины Использование синезеленых водорослей человеком
Использование синезеленых водорослей человеком  Тренировочный тест к ЕГЭ на уровень А
Тренировочный тест к ЕГЭ на уровень А Физический принцип действия оперативной памяти
Физический принцип действия оперативной памяти Click to edit Master title style Click to edit Master subtitle style
Click to edit Master title style Click to edit Master subtitle style  Презентация на тему Техногенные катастрофы
Презентация на тему Техногенные катастрофы  Основные условия аукциона
Основные условия аукциона 22222
22222 Использование хвостов позвоночными животными
Использование хвостов позвоночными животными Как вести себя, если вы стали заложником террористов
Как вести себя, если вы стали заложником террористов