Содержание
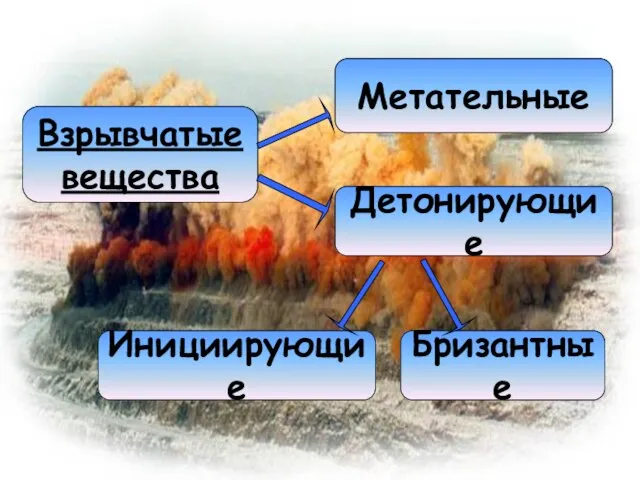
- 2. Взрывчатые вещества Детонирующие Метательные Инициирующие Бризантные
- 3. Врывчатые вещества Это устойчивый твердый или жидкий материал, который при соответствующем инициировании быстро превращается в раскаленный,
- 4. Метательные взрывчатые вещества Порох (Китай, 10-й век ) – смесь органических и (или) неорганических соединений, способная
- 5. Детонирующие взрывчатые вещества подразделяют на инициирующие и бризантные взрывчатые вещества.
- 6. Инициирующие взрывчатые вещества требуют предельно осторожного обращения, более чувствительны, чем бризантные вещества. Такие материалы мгновенно взрываются
- 7. Бризантные взрывчатые вещества менее чувствительны и способны гореть без взрыва. Они детонируют только при резком ударном
- 8. В 1846 г. Асканио Собреро синтезировал нитроглицерин – взрывчатое вещество настолько высокой чувствительности, что его невозможно
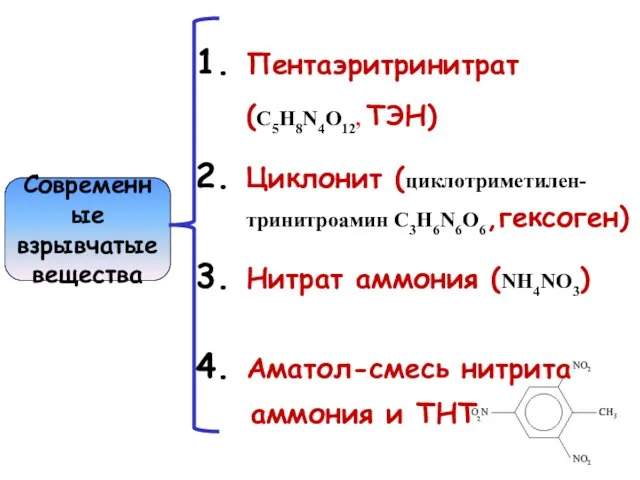
- 9. Современные взрывчатые вещества Пентаэритринитрат (C5H8N4O12, ТЭН) Циклонит (циклотриметилен- тринитроамин C3H6N6O6,гексоген) Нитрат аммония (NH4NO3) Аматол-смесь нитрита аммония
- 10. Применение взрывчатых веществ Пробивка горных тоннелей Расчистка территории при строительных работах Вскрытие карьеров Подземные шахтные работы
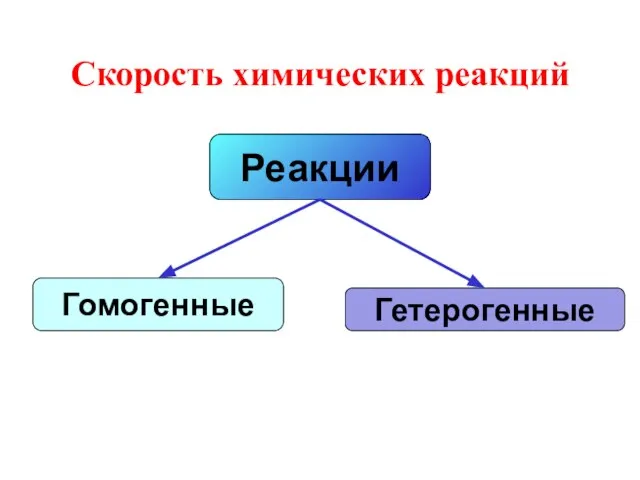
- 11. Реакции Гомогенные Гетерогенные Скорость химических реакций
- 12. Гомогенные реакции - реакции, протекающие в одной фазе. Т.е. все реагирующие вещества находятся в одной фазе.
- 13. Гетерогенная реакция – реакция, в которой реагенты находятся в разных фазах. Zn(тв) +2HCl(ж) = ZnCl2 +H2(г)
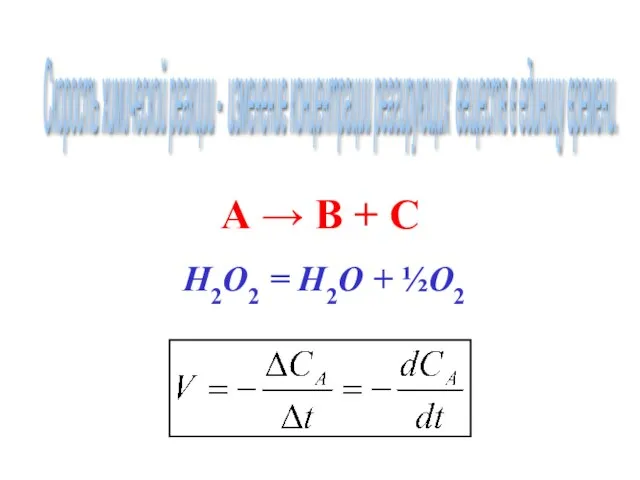
- 14. Скорость химической реакции - изменение концентрации реагирующих веществ в единицу времени. А → В + С
- 15. Химическая кинетика – раздел химии, изучающий функциональные зависимости скоростей химических реакций.
- 16. Концентрация [A] – молярная концентрация вещества А, моль/л
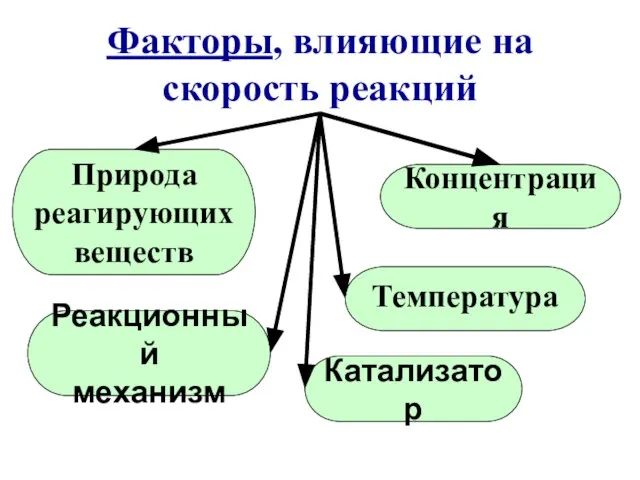
- 17. Факторы, влияющие на скорость реакций Природа реагирующих веществ Концентрация Реакционный механизм Температура Катализатор
- 18. Теория столкновений Протекание реакций обусловлено столкновениями между реагирующими частицами. Каждое столкновение может приводить к реакции только
- 19. Природа реагирующих веществ HCl + KOH = KCl + H2O Реакции между ионами в растворе, протекающие
- 20. 2 KMnO4 + 3 H2SO4 + H2O2 = K2SO4 + 2 MnSO4 + 4 H2O +
- 21. Скорость химической реакции обычно возрастает при увеличении концентрации одного или нескольких реагентов. В случае гетерогенных (гетерофазных)
- 22. Скорость химической реакции прямо пропорциональна концентрации реагирующих веществ. А → продукт Концентрация реагирующих веществ k -
- 23. Порядок реакции Для более сложного случая: aA + bB + сС → . . . N
- 24. Порядок реакции по данному веществу - это показатель степени при концентрации данного вещества в кинетическом уравнении.
- 25. Константа скорости реакции k зависит от природы реагирующих веществ, температуры и катализатора, но не зависит от
- 26. Молекулярность реакции – число химических частиц, принимающих участие в элементарной стадии реакции. NH4+ = NH3 +
- 27. Мономолекулярная стадия – стадия реакции, в которой принимает участие всего одна реагирующая частица. Бимолекулярная стадия –
- 28. Для элементарных стадий реакции порядок - целочисленная величина, совпадающая с молекулярностью этой стадии. Для всех других
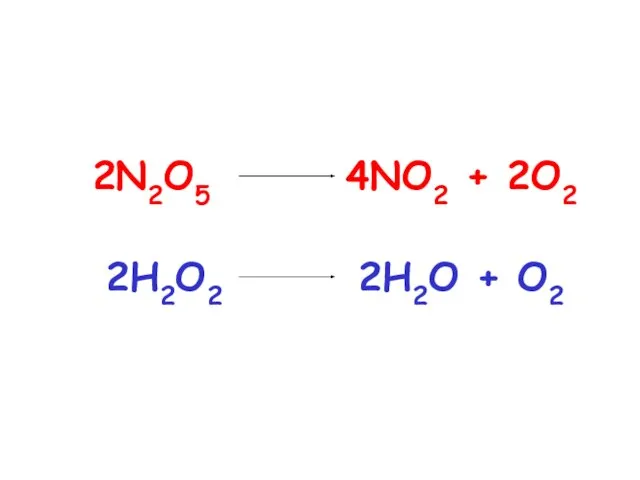
- 29. Число молекул, распадающихся в результате мономолекулярного процесса в единицу времени, будет пропорционально числу присутствующих молекул. Скорость
- 30. Если объем системы постоянный, то концентрация молекул А будет уменьшаться со скоростью, пропорциональной этой концентрации. k
- 32. Для реакции aA + bB → . . . выражение скорости:
- 33. ln[A] – ln[A]0 = ln([A]/[A]0) = – kt + kt0
- 35. Реакции нецелочисленного порядка V = k [СН3СНО]1,5 СН3СНО(г) СН4(г) + СО(г) t=720K Реакция имеет порядок 1,5
- 36. Соотношение между скоростью реакции и температурой впервые установил шведский химик Аррениус в 1889г. Зависимость константы скорости
- 37. Уравнение Аррениуса
- 38. Еа – минимальная энергия, которой должна обладать молекула, чтобы произошло превращение: Всегда положительная величина Зависит от
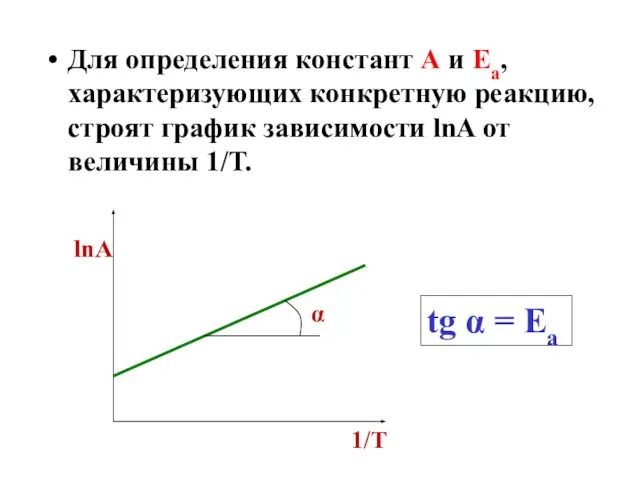
- 39. Для определения констант А и Еа, характеризующих конкретную реакцию, строят график зависимости lnA от величины 1/Т.
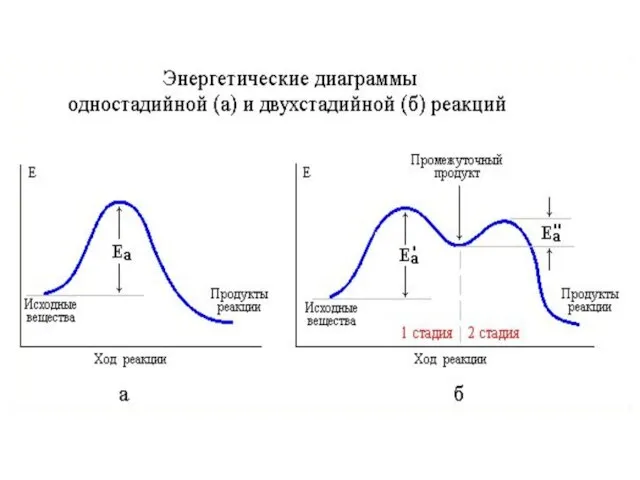
- 40. Механизмы реакций Механизм реакции – последовательность элементарных стадий реакции. Молекулярность реакции обсуждается именно для элементарных стадий.
- 41. Скорость реакции А → D будет равна скорости второй (лимитирующей) стадии. А → D 1. А
- 42. 1. NO2 + NO2 → [NO3] + NO 2. CO + [NO3] → CO2 + NO2
- 43. Сначала нужно определить лимитирующую стадию реакции. После этого нужно изучать, что происходит на этой стадии с
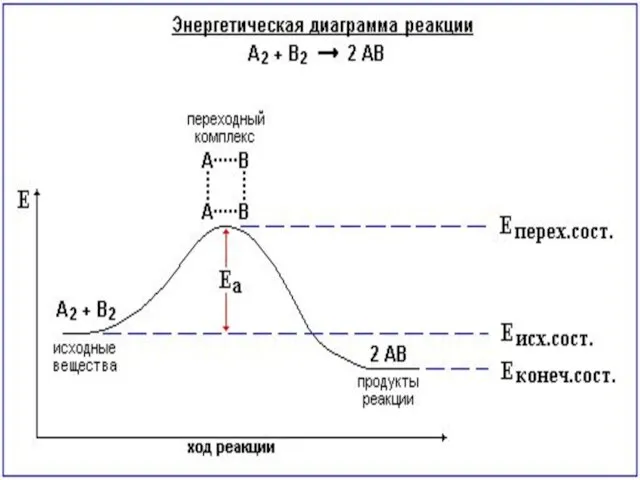
- 44. Теория переходного состояния Теория переходного состояния рассматривает реагирующие молекулы как единую систему. Геометрическое расположение атомов в
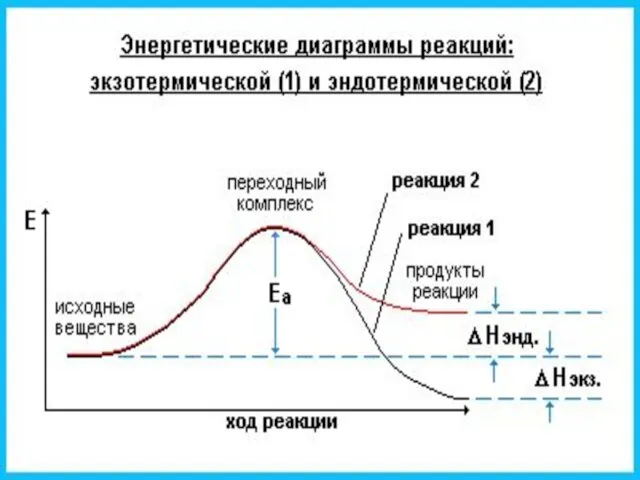
- 45. Экзотермическая реакция Эндотермическая реакция
- 47. Теория переходного состояния может использоваться для прогнозирования постоянных А и Еа в уравнении Аррениуса. Использование этой
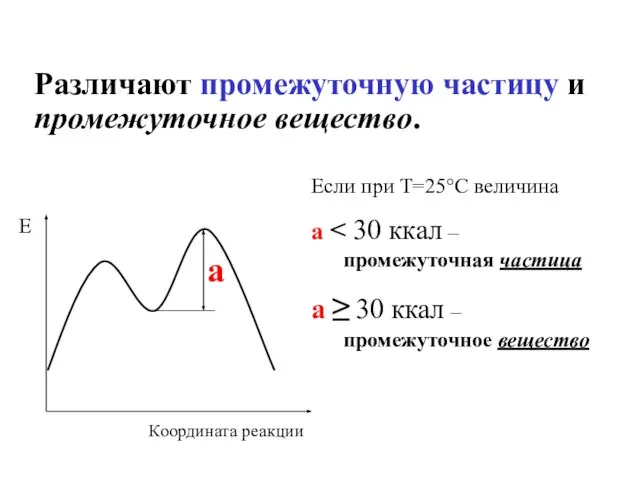
- 48. Различают промежуточную частицу и промежуточное вещество. а Е Координата реакции Если при Т=25°С величина а промежуточная
- 50. Цепные реакции Цепная реакция – это самоподдерживающаяся химическая реакция, при которой первоначально появляющиеся продукты принимают участие
- 51. В цепных реакциях выделяют три стадии: зарождение цепи (иницирование) происходит под воздействием светового, радиационного, термического или
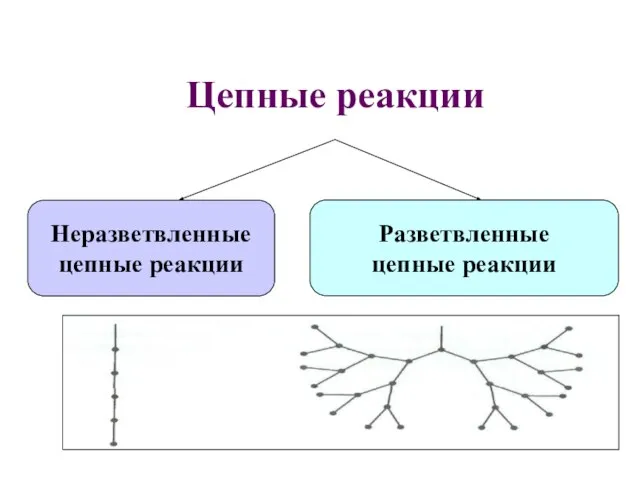
- 52. Цепные реакции Неразветвленные цепные реакции Разветвленные цепные реакции
- 53. В неразветвленной цепной реакции количество радикалов не увеличивается! В разветвленной цепной реакции количество радикалов увеличивается в
- 54. Неразветвленные цепные реакции Включают стадии зарождения и развития цепи, на которых происходит образование радикалов, а также
- 55. H2 + Br2 = 2HBr иницирование: рост цепи (развитие): обрыв цепи:
- 56. Горение водорода относится к разветвленным цепным реакциям
- 57. ВЗРЫВЫ Смесь водорода с хлором при поджигании взрывается. Н2+Cl2 = 2HCl В результате реакции высвобождается такое
- 58. Взрыв смесей водорода и кислорода имеет другой характер, он называется разветвленно-цепным взрывом. Очень важными цепными реакциями,
- 59. Катализ – это явление, в котором инородный материал, названный катализатором, присутствуя в относительно малом количестве и
- 60. Каталитическая реакция – это замкнутая последовательность элементарных стадий. А = С А+Х = В В =
- 61. Катализатор обладает следующими особенностями: Катализатор не влияет на общую стехиометрию реакции. Катализатор одинаково ускоряет как прямую
- 62. Катализатор влияет на механизм реакции, открывая новый путь протекания реакции. Энергия активации на этом новом пути
- 63. Катализатор может увеличивать скорость одной реакции, но не увеличивать скорость другой, сходной с ней реакции. Катализатор
- 64. Автокатализ Катализ реакции каким-либо из ее продуктов. Реакция вначале протекает медленно, но по мере образования продуктов
- 65. 2MnO4- + 5C2O42- +16H+→2Mn2+ +10CO2 + 8H2O При комнатной температуре эта реакция протекает очень медленно. Однако
- 66. Теория промежуточных соединений для объяснения действия катализаторов 1889г. Аррениус. Предположение об образовании промежуточного соединения (интермедиатов). С
- 67. S Е Координата реакции [СS] P Е Координата реакции NO2Cl2 = NO2 + Cl2 + Cl2
- 68. Для реакции, в которой участвуют 2 реагента: С + A = [CA] [CA] + B =
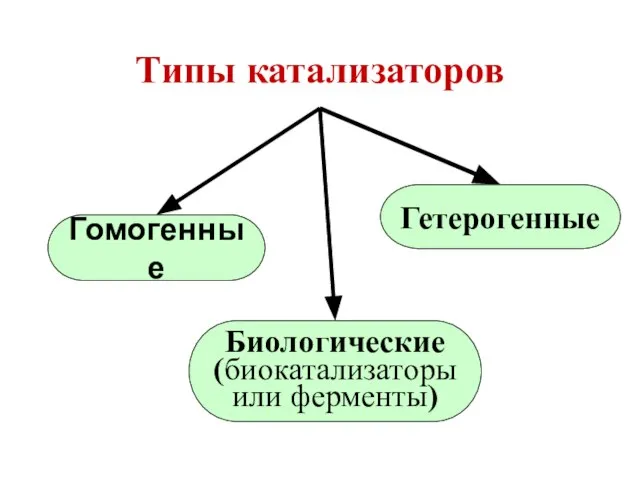
- 69. Типы катализаторов Гетерогенные Биологические (биокатализаторы или ферменты) Гомогенные
- 70. Ингибиторы – вещества, которые уменьшают скорость химической реакции. Они препятствуют обычному пути протекания химической реакции, вступая
- 71. Гомогенный катализ Гомогенный катализ осуществляется, когда катализатор и реагирующая система находятся в одинаковом фазовом состоянии.
- 72. Примером гомогенного катализа является разложение пероксида водорода в присутствии ионов йода: При гомогенном катализе действие катализатора
- 73. Гетерогенный катализ Гетерогенный катализ осуществляется в том случае, когда катализатор и реагирующая система находятся в различных
- 74. Адсорбционная теория гетерогенного катализа Адсорбция – накопление молекул на поверхности раздела фаз. Абсорбция – проникновение молекул
- 75. Различают адсорбцию двух типов: Физическая адсорбция происходит, когда молекулы связываются с активными центрами на поверхности твердого
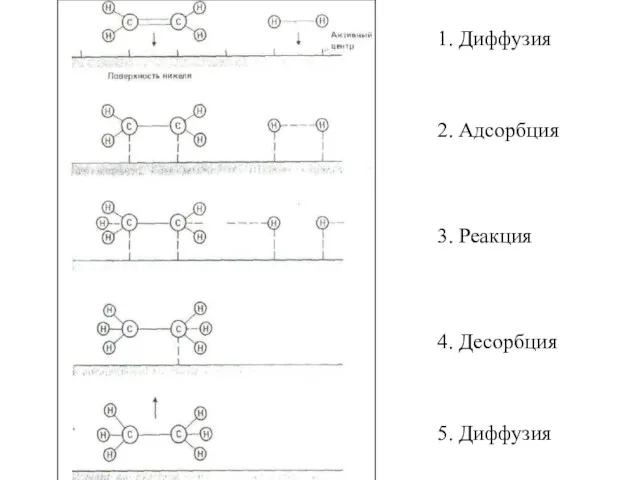
- 76. Механизм гетерогенного катализа включает пять стадий, причем все они обратимы. 1. Диффузия реагирующих веществ к поверхности
- 77. Реакция каталитического гидрирования этилена с использованием тонкоизмельченного никелевого катализатора: С2Н4(г) + Н2(г) = С2Н6(г) t=400K
- 78. 1. Диффузия 5. Диффузия 2. Адсорбция 4. Десорбция 3. Реакция
- 80. Скачать презентацию










![Концентрация [A] – молярная концентрация вещества А, моль/л](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/376860/slide-15.jpg)














![ln[A] – ln[A]0 = ln([A]/[A]0) = – kt + kt0](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/376860/slide-32.jpg)

![Реакции нецелочисленного порядка V = k [СН3СНО]1,5 СН3СНО(г) СН4(г) + СО(г) t=720K Реакция имеет порядок 1,5](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/376860/slide-34.jpg)





![1. NO2 + NO2 → [NO3] + NO 2. CO + [NO3]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/376860/slide-41.jpg)



















![S Е Координата реакции [СS] P Е Координата реакции NO2Cl2 = NO2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/376860/slide-66.jpg)
![Для реакции, в которой участвуют 2 реагента: С + A = [CA]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/376860/slide-67.jpg)








 Презентация на тему Екатерина Великая
Презентация на тему Екатерина Великая  «Стимулирование экономической активности на 2012-2016 гг.»
«Стимулирование экономической активности на 2012-2016 гг.» Учет возрастных психологических особенностей детей и подростков
Учет возрастных психологических особенностей детей и подростков Презентация на тему Перевод чисел в десятичную систему счисления 11 класс
Презентация на тему Перевод чисел в десятичную систему счисления 11 класс  Требования к оформлению презентации
Требования к оформлению презентации Презентация на тему Лес - природное сообщество 3 класс
Презентация на тему Лес - природное сообщество 3 класс Биомедикал системс
Биомедикал системс Презентация на тему Блокада Ленинграда. Дети, война
Презентация на тему Блокада Ленинграда. Дети, война Кафедра лучевой диагностики и лучевой терапии
Кафедра лучевой диагностики и лучевой терапии Эксплуатация МТ. Основные задачи. Приемка в эксплуатацию
Эксплуатация МТ. Основные задачи. Приемка в эксплуатацию ООО ИнтерТех, Новосибирск. Проектирование, монтаж и комплексное обслуживание инженерных сетей
ООО ИнтерТех, Новосибирск. Проектирование, монтаж и комплексное обслуживание инженерных сетей Предоставление платных образовательных услуг
Предоставление платных образовательных услуг Профессия столяра
Профессия столяра Крылатые выражения
Крылатые выражения Мифологема Мировое Древо
Мифологема Мировое Древо Лизинговые продукты
Лизинговые продукты Справится ли местоимение с ролью обращения?
Справится ли местоимение с ролью обращения? Законы термодинамики
Законы термодинамики Ровеньковский горный колледж
Ровеньковский горный колледж 2ca34114d08bf472 (1)
2ca34114d08bf472 (1) Франція: пам’ятки архітектури
Франція: пам’ятки архітектури Метод проекций. Проекции точки. Лекция 1
Метод проекций. Проекции точки. Лекция 1 Удмуртское национальное блюдо шаньги
Удмуртское национальное блюдо шаньги Что такое бёрдинг?
Что такое бёрдинг? Гибриды больших кошек
Гибриды больших кошек Какой бывает транспорт? 2 класс
Какой бывает транспорт? 2 класс «Масленица…»
«Масленица…» Модулі нагріву МН-500 Укрінтерм на базі конденсаційного теплообмінника
Модулі нагріву МН-500 Укрінтерм на базі конденсаційного теплообмінника