Содержание
- 2. Системы выращивания культур клеток высших растений Колбы на качалке Роллеры Аппаратное культивирование (биореакторы). Преимущества биореакторов: -
- 3. Выращивание суспензионных культур клеток в колбах на качалке и биореакторах
- 4. Особенности аппаратного глубинного выращивания растительных клеток: Культивирование в биореакторе: дозированное поступление в аппарат определенных потоков (инокулята,
- 5. Основные типы биореакторов: Главные задачи при выборе биореакторов: стерильность процесса культивирования, обеспечение необходимой для клеток скорости
- 6. Общий признак – аэрация и перемешивание клеточной суспензии осуществляется сжатым воздухом, подаваемым в биореактор под определенным
- 7. Обычно-цилиндрическая емкость, снабженная механическими перемешивающими устройствами, а также барботером, который устанавливается, как правило, под нижним ярусом
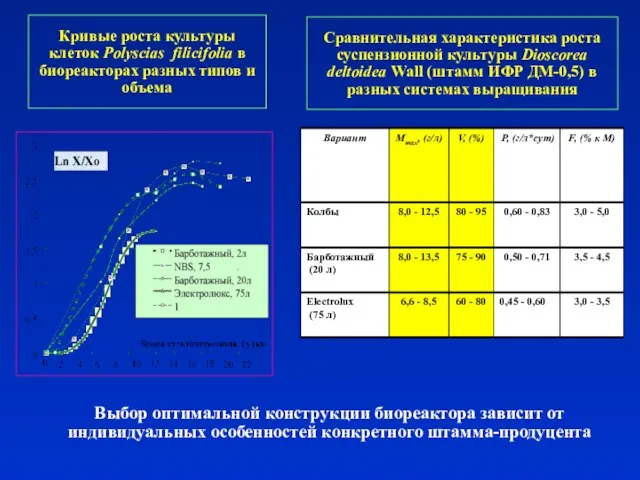
- 8. Кривые роста культуры клеток Polyscias filicifolia в биореакторах разных типов и объема Выбор оптимальной конструкции биореактора
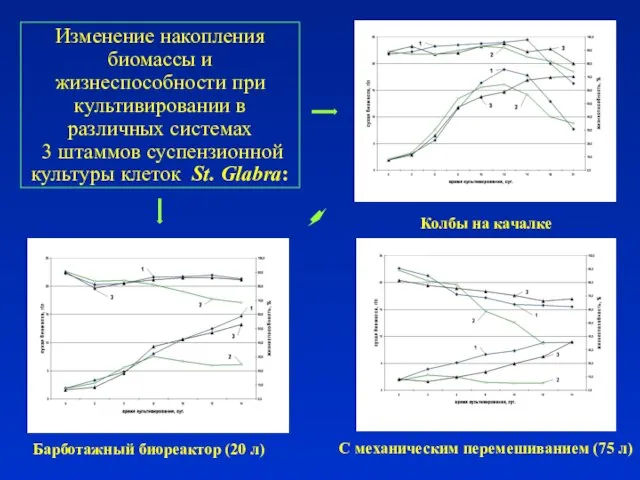
- 9. Изменение накопления биомассы и жизнеспособности при культивировании в различных системах 3 штаммов суспензионной культуры клеток St.
- 10. Прочие типы биореакторов:
- 11. Использование биореакторов для крупномасштабного выращивания суспензионных культур растительных клеток Колбы (2 L) Лабораторный барботажный биореактор(20 L)
- 12. Пример получения лекарственных препаратов и пищевых добавок на основе культур клеток высших растений. Совместно с НПФ
- 13. Биореакторы промышленного объема и получаемая биомасса культуры клеток женьшеня
- 14. для каждого конкретного используемого штамма определяют: оптимальные условия непрерывной аэрации; оптимальные условия непрерывного перемешивания; оптимальный режим
- 15. размеры и сложность конфигурации используемой системы культивирования (возникновение температурных градиентов, флуктуаций концентраций субстратов, образование «застойных зон»,
- 16. Снижение жизнеспособности Снижение содержания внутриклеточных метаболитов Изменения метаболизма (изменение скорости поглощения О2, дыхательной активности, содержания АТФ,
- 17. Типы мешалок:
- 18. Непрерывная аэрация: непрерывная аэрация суспензионных культур растительных клеток необходима: для обеспечения аэробных условий выращивания для отвода
- 19. В настоящее время для аэрации суспензионных культур растительных клеток при выращивании в биореакторах используют: точечные газораспределяющие
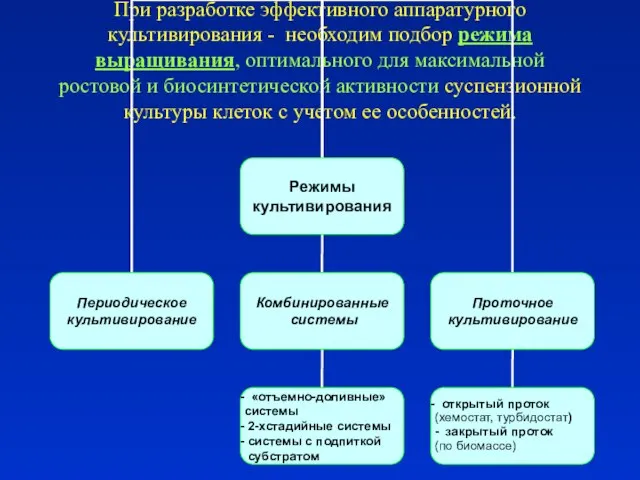
- 20. При разработке эффективного аппаратурного культивирования - необходим подбор режима выращивания, оптимального для максимальной ростовой и биосинтетической
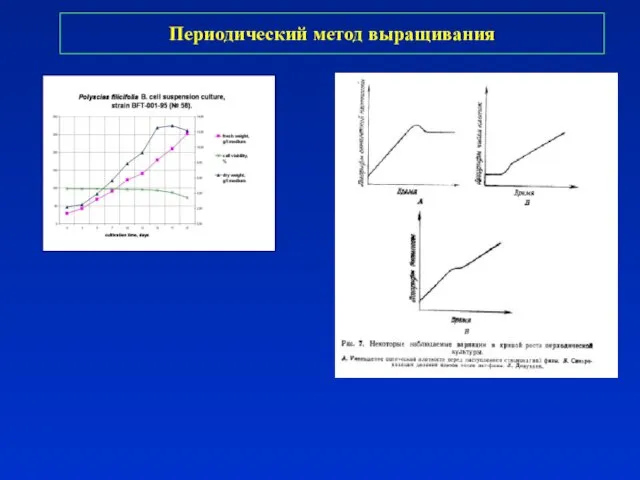
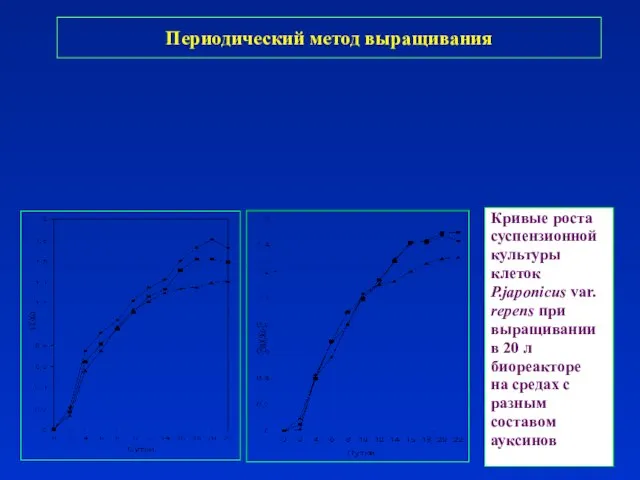
- 21. Периодический метод выращивания
- 22. Периодический метод выращивания
- 23. Кривые роста суспензионной культуры клеток P.japonicus var. repens при выращивании в 20 л биореакторе на средах
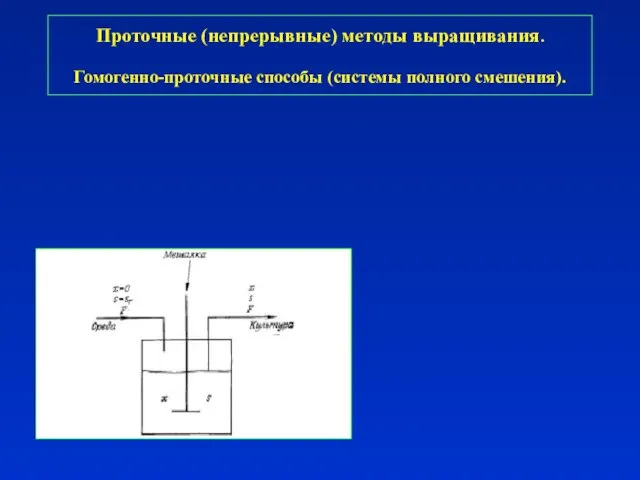
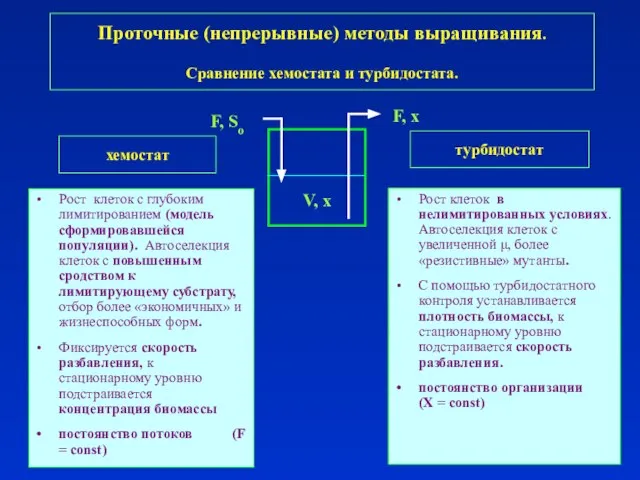
- 24. Проточные (непрерывные) методы выращивания. Гомогенно-проточные способы (системы полного смешения).
- 25. Проточные (непрерывные) методы выращивания. Гомогенно-проточные способы (системы полного смешения).
- 26. Рост клеток с глубоким лимитированием (модель сформировавшейся популяции). Основан на измерении и регуляции входящих потоков. Для
- 27. 3 возможных результата в хемостатной культуре: (Скорость прироста биомассы (Х) ограничена концентрацией (S) лимитирующего субстрата) 0
- 28. Хемостат позволяет изучать популяцию клеток в фазе интенсивного роста, а также выделять фактор (чаще всего концентрацию
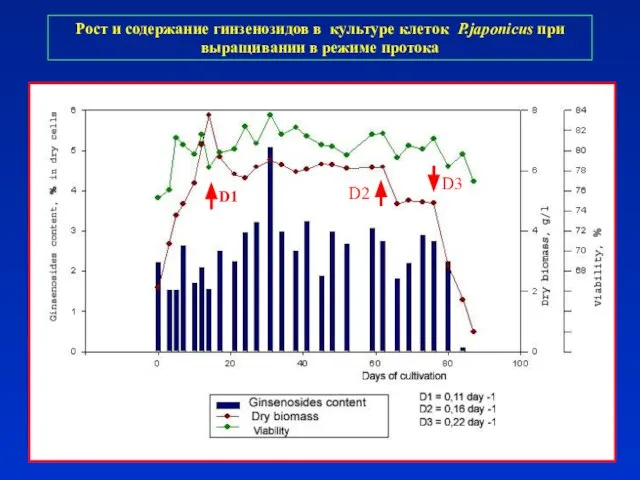
- 29. Рост и содержание гинзенозидов в культуре клеток P.japonicus при выращивании в режиме протока D1 D2 D3
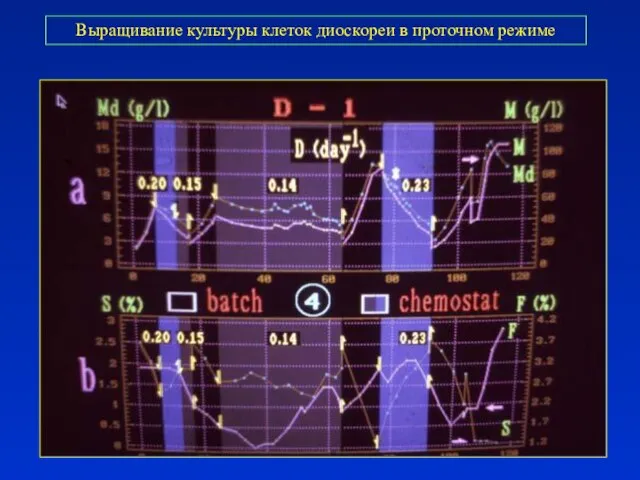
- 30. Выращивание культуры клеток диоскореи в проточном режиме
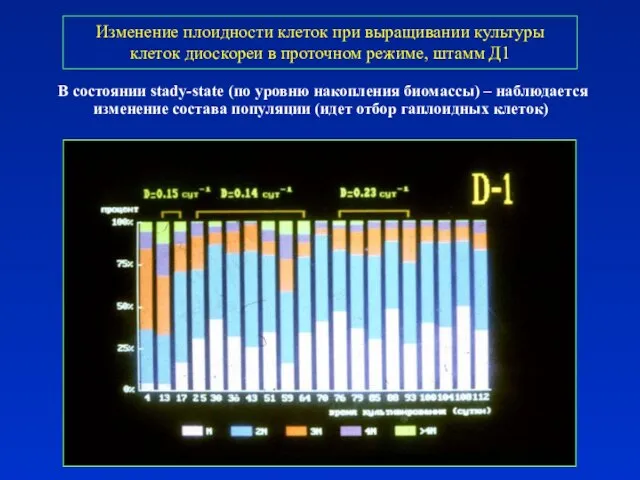
- 31. Изменение плоидности клеток при выращивании культуры клеток диоскореи в проточном режиме, штамм Д1 В состоянии stady-state
- 32. Основан на измерении мутности выходящего потока (снабжен фотоэлектрическим элементом, чувствительным к мутности суспензии). Изменение оптической плотности
- 33. Рост клеток с глубоким лимитированием (модель сформировавшейся популяции). Автоселекция клеток с повышенным сродством к лимитирующему субстрату,
- 34. Отличительная особенность - необходимость непрерывной подачи питательной среды и отбора бесклеточной культуральной жидкости. В техническом плане
- 35. Позволяет изучать популяции (состоящие преимущественно из специализированных клеток) в фазах замедления роста или стационара. основные регулирующие
- 36. Проточные (непрерывные) методы выращивания. Закрытое по биомассе проточное культивирование («закрытый проток»).
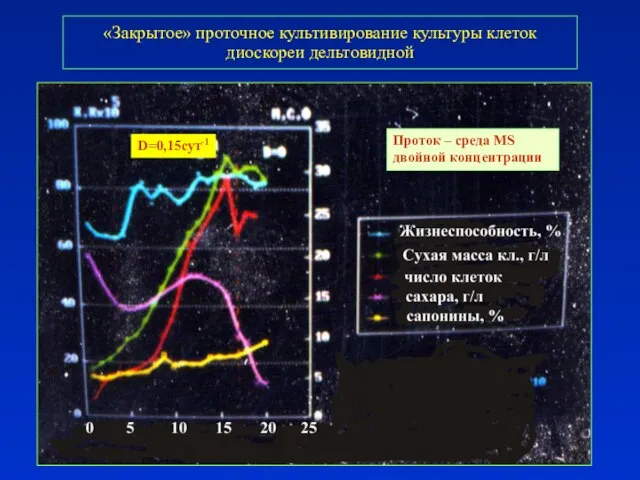
- 37. «Закрытое» проточное культивирование культуры клеток диоскореи дельтовидной D=0,15сут-1 Проток – среда MS двойной концентрации
- 38. К ним относят: периодические культуры с подпиткой субстратом (периодическое или непрерывное добавление питательной среды или отдельных
- 39. просты в аппаратурном оформлении и сочетают преимущества проточных и периодических методов: более широкие возможности для контроля
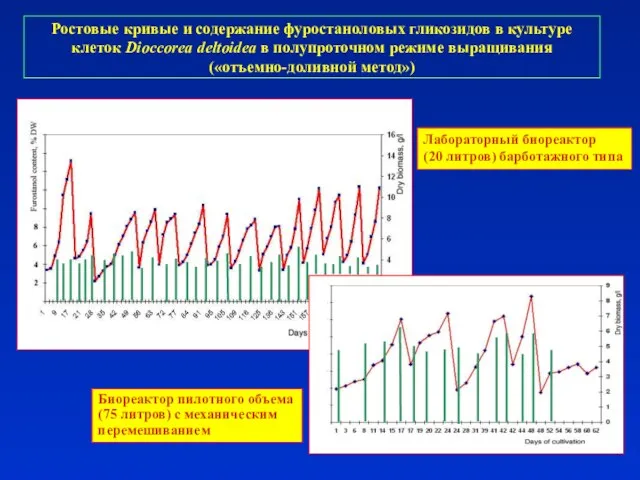
- 40. Ростовые кривые и содержание фуростаноловых гликозидов в культуре клеток Dioccorea deltoidea в полупроточном режиме выращивания («отъемно-доливной
- 41. Комбинированные системы широко используют при масштабировании культивирования объектов, для которых применение периодических и проточных методов менее
- 43. Скачать презентацию




























 Это сладкое слово свобода
Это сладкое слово свобода Мастер украшения помогает сделать праздник
Мастер украшения помогает сделать праздник Имидж современного педагога как условие повышения профессиональной компетентности учителя
Имидж современного педагога как условие повышения профессиональной компетентности учителя Презентация на тему Скорость еденицы скорости
Презентация на тему Скорость еденицы скорости  Workflow-template
Workflow-template Malashenkova_Darina
Malashenkova_Darina Содержание предмета "Технология" с точки зрения нового образовательного стандарта
Содержание предмета "Технология" с точки зрения нового образовательного стандарта Зимний пейзаж
Зимний пейзаж Искусство Пскова XII-XV вв
Искусство Пскова XII-XV вв Презентация на тему день независимости России
Презентация на тему день независимости России 10. Третий шаг – определение методов исследования. Для полного совершенства надо, чтобы подготовка была труднее самого дела. Бэко
10. Третий шаг – определение методов исследования. Для полного совершенства надо, чтобы подготовка была труднее самого дела. Бэко Условия реализации компетентностного подхода в образовательном пространстве школы
Условия реализации компетентностного подхода в образовательном пространстве школы Важнейшие соединения щелочных металлов, их свойства и применение
Важнейшие соединения щелочных металлов, их свойства и применение Властелины суши
Властелины суши Нумерация. Счёт предметов. Разряды
Нумерация. Счёт предметов. Разряды Организация как функция менеджмента
Организация как функция менеджмента В поисках Веб-3.0 Андрей Хветкевич http://andriy.tel. - презентация
В поисках Веб-3.0 Андрей Хветкевич http://andriy.tel. - презентация Управление охраной труда в Вологодской области с учетом международного опыта
Управление охраной труда в Вологодской области с учетом международного опыта Принципы логистики
Принципы логистики Экологический календарь
Экологический календарь Замена придаточных предложений причастными оборотами
Замена придаточных предложений причастными оборотами «Система оплаты труда в организациях электроэнергетики. Особенности регулирования отношений с работниками и их представителями
«Система оплаты труда в организациях электроэнергетики. Особенности регулирования отношений с работниками и их представителями  Презентация проектов «Знание – сила»
Презентация проектов «Знание – сила» Рисунок деревьев. Наброски разных пород деревьев
Рисунок деревьев. Наброски разных пород деревьев Материалы и рендер. 3D моделирование
Материалы и рендер. 3D моделирование Частица как часть речи Правописание частиц
Частица как часть речи Правописание частиц События, характеризующие надежность объектов энергетики
События, характеризующие надежность объектов энергетики Where there is love there is life
Where there is love there is life