Содержание
- 2. 1. Два принципа первого закона термодинамики Первый закон термодинамики является частным случаем всеобщего закона о превращении
- 3. Примечание. В данном уравнении и в дальнейшем удобнее расчет вести на единицу вещества – кг, м3,
- 4. 2. Внутренняя энергия газа Внутренняя энергия – это сумма кинетических энергий частиц (молекул, атомов) газа и
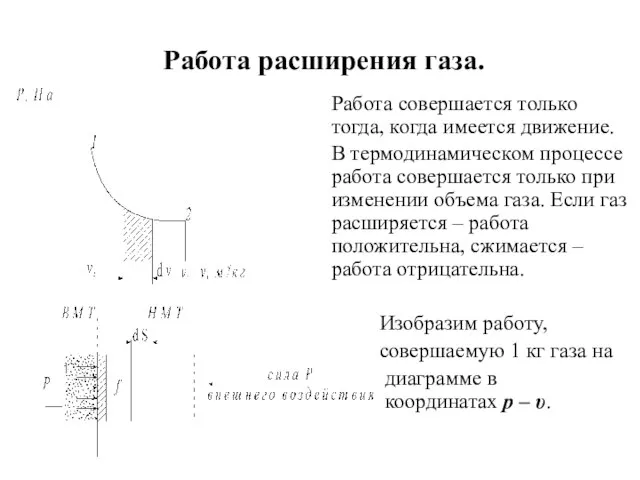
- 5. Работа расширения газа. Работа совершается только тогда, когда имеется движение. В термодинамическом процессе работа совершается только
- 6. Пусть в процессе 1-2 поршень перемещается из положения 1 – верхней мертвой точки (ВМТ) в положение
- 7. Учитывая, что fdS=dv, работа расширения газа на всем участке от v1 до v2 будет равна: При
- 8. 3. Энтальпия газа Энтальпия газа h, Дж/кг равна сумме внутренней энергии газа и произведения давления на
- 9. Изменение энтальпии равно: Учитывая, что получим: После интегрирования в пределах от Т1 до Т2 получим:
- 10. Энтропия газа Не всегда количество подведенной можно определить через изменение температуры тела. Например, вода кипит, а
- 11. Если количество подведённой теплоты не характеризуется соответствующим изменением температуры, то выражение (1) можно превратить в полный
- 13. Скачать презентацию









 Особенности проектирования печатных плат на металлическом основании
Особенности проектирования печатных плат на металлическом основании Роботы R2D2, BB-8, C3PO
Роботы R2D2, BB-8, C3PO Светофорик приглашает
Светофорик приглашает Здоровьесберегающие технологии для детей 6-7 лет
Здоровьесберегающие технологии для детей 6-7 лет Бутерброды 5 класс
Бутерброды 5 класс Обзор типовых решений «1С-Рарус». Новые программные продукты
Обзор типовых решений «1С-Рарус». Новые программные продукты Воронеж – город Воинской Славы. . В Воронеже будет отмечается День города – традиционно день народных гуляний, выступлений на площ
Воронеж – город Воинской Славы. . В Воронеже будет отмечается День города – традиционно день народных гуляний, выступлений на площ Зеленые проектыМурманской области
Зеленые проектыМурманской области Налоговая задолженность
Налоговая задолженность Техника бросков мяча в движении, методика обучения
Техника бросков мяча в движении, методика обучения Проектная деятельность учащихся (материалы к педагогическому совету)
Проектная деятельность учащихся (материалы к педагогическому совету) Мастерицы России. Надежда Федоровна Кочетова
Мастерицы России. Надежда Федоровна Кочетова БЕЗОПАСНЫЙ ИНТЕРНЕТ
БЕЗОПАСНЫЙ ИНТЕРНЕТ  Фартуки
Фартуки Презентация на тему Бесполое размножение (6 класс)
Презентация на тему Бесполое размножение (6 класс)  Отряд ЮИД в действии. стр 3
Отряд ЮИД в действии. стр 3 Презентация на тему Зелёный пояс Славы
Презентация на тему Зелёный пояс Славы Искусство
Искусство Еңбек нормасы. Өнім нормасы
Еңбек нормасы. Өнім нормасы Месторасположение офисного помещения, сдаваемого в аренду: г. Москва, 1ый Зачатинский переулок, д. 4 (10 минут пешком от метро Кропотк
Месторасположение офисного помещения, сдаваемого в аренду: г. Москва, 1ый Зачатинский переулок, д. 4 (10 минут пешком от метро Кропотк наш 9 класс
наш 9 класс 26.09.22 Фізичне тіло. Матеріал. Речовина. Молекула. Атом
26.09.22 Фізичне тіло. Матеріал. Речовина. Молекула. Атом Сравнение сюжета сказок В.А. Жуковского «Спящая царевна» и Ш. Перро «Спящая красавица»
Сравнение сюжета сказок В.А. Жуковского «Спящая царевна» и Ш. Перро «Спящая красавица» Последовательная политика в отношении инвалидов. Рекомендация N (R) 6 Комитета министров от 09.04.1992
Последовательная политика в отношении инвалидов. Рекомендация N (R) 6 Комитета министров от 09.04.1992 Игра С 8 марта
Игра С 8 марта 2 белки - копия
2 белки - копия Правила гигиены и здорового образа жизни
Правила гигиены и здорового образа жизни Решение физических задач графическим способом
Решение физических задач графическим способом