Содержание
- 2. Тема: Общие химические свойства металлов
- 3. Цель: Систематизировать сведения о химических свойствах металлов Осознать химическую функцию металлов как восстановителей
- 4. Задачи: Знать отношение металлов к неметаллам. Взаимодействие с водой, кислотами, солями. Научиться применять знания. Формирование познавательного
- 5. О б о р у д о в а н и е: Компьютер, проектор, экран
- 6. Что характерно для атомов металлов?
- 7. Для атомов металлов характерно: Небольшое число электронов на внешнем слое. С увеличением радиуса атома сила удерживания
- 8. Поэтому в химических реакциях атомы металлов отдают электроны и являются восстановителями.
- 9. На пример: Na0 - 1ē → Na+1 Al0 - 3ē → Al+3
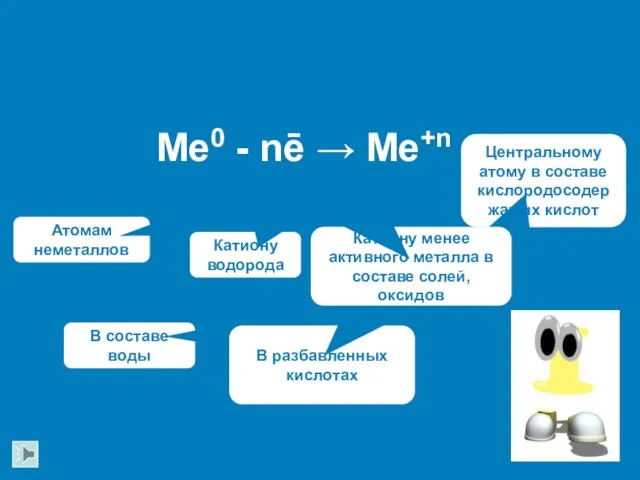
- 10. Me0 - nē → Me+n Атомам неметаллов Катиону водорода В составе воды В разбавленных кислотах Катиону
- 11. Взаимодействие металлов с водой t0
- 12. З а п о м н и!!! С водой взаимодействует только амальгамированный алюминий (лишенный оксидной пленки)
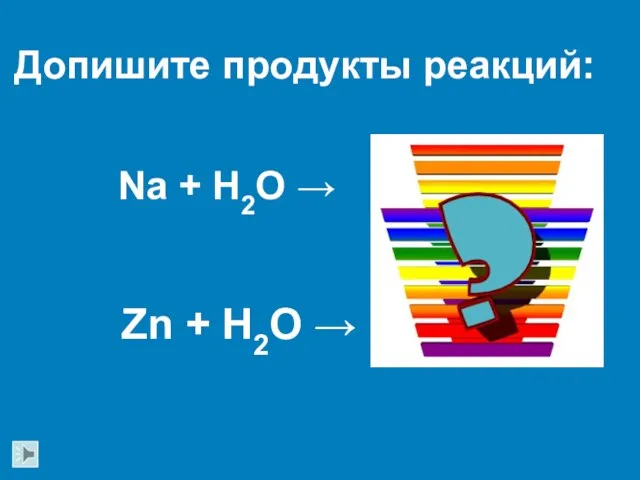
- 13. Na + H2O → Zn + H2O → Допишите продукты реакций:
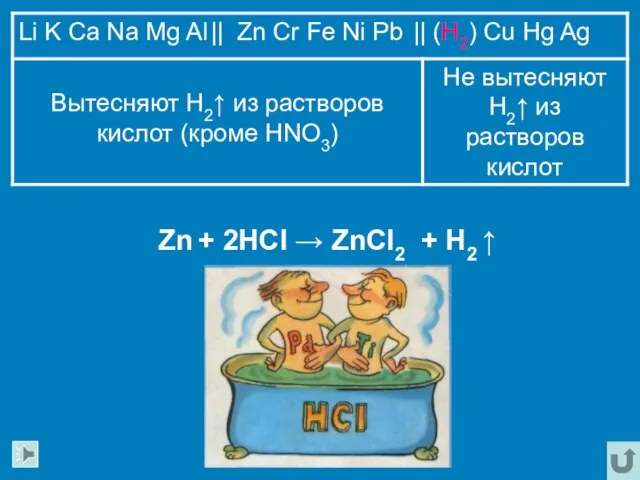
- 14. Zn + 2HCl → ZnCl2 + H2 ↑
- 15. Металлы могут восстанавливать и катионы менее активных металлов Zn0 +Cu+2Cl2 → Cu0 + Zn+2 Cl2
- 16. Все металлы на основании их восстановительной способности по отношению к ионам металлов в водных растворах расположены
- 17. Окислителями металлов являются неметаллы: Кислород, сера, галогены…
- 18. С кислородом воздуха легко взаимодействуют щелочные и щелочно-земельные металлы. 4 Li0 + O20 → 2 LI+120-2
- 19. Железо, цинк, медь окисляются только при нагревании 3Fe + 2O2 → Fe3O4 to
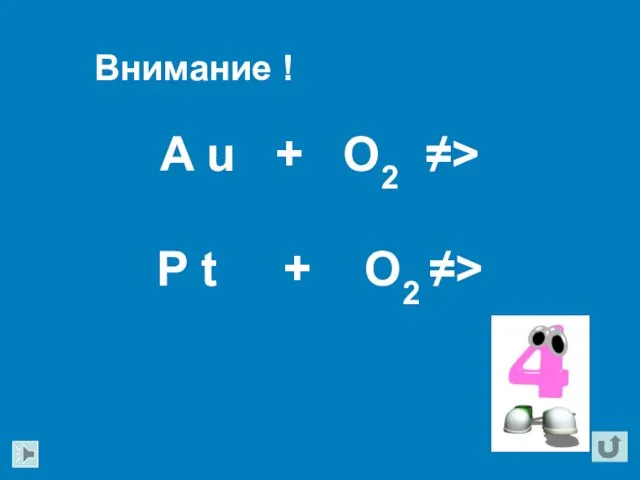
- 20. A u + O2 ≠> P t + O2 ≠> Внимание !
- 21. Металлы с неметаллами образуют бинарные соединения Хлориды – AlCl3 Сульфиды – PbS Фосфиды – Na3 Р
- 22. А теперь ты должен закрепить приобретенные знания, выполнив Упражнение УДАЧИ ТЕБЕ!!!
- 23. Если ты испытываешь трудности при выполнении этих заданий то обратись к предыдущим слайдам!
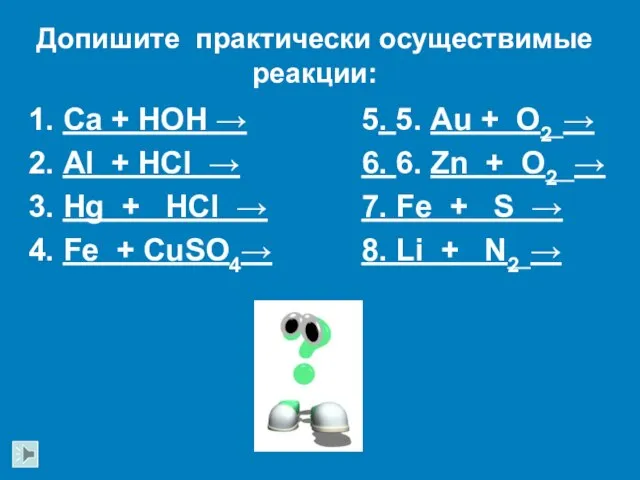
- 24. Ca + HOH → Al + HCl → Hg + HCl → Fe + CuSO4→ 5.
- 25. 2ē Ca + 2HOH →Ca(OH)2 + H2 6ē 2Al + 6HCl →2AlCl3 + H2 2ē Fe
- 27. Скачать презентацию



















 Реализация долгосрочных целевых программ:«Профилактика преступлений и иных правонарушений в городе Барнауле на 2010-2012 годы»«Ком
Реализация долгосрочных целевых программ:«Профилактика преступлений и иных правонарушений в городе Барнауле на 2010-2012 годы»«Ком Викторина по стихам Агнии Барто
Викторина по стихам Агнии Барто Календарь
Календарь Проект на тему:«Шапито». Новый танцпол
Проект на тему:«Шапито». Новый танцпол Трансформация формы
Трансформация формы Третий урок
Третий урок Изобретение велосипеда
Изобретение велосипеда Метод персон
Метод персон Геральдика. Герб Англии
Геральдика. Герб Англии Психология вождения
Психология вождения Алгоритм выхода в туристский поход детской группы образовательной организации
Алгоритм выхода в туристский поход детской группы образовательной организации Чистая вода- залог здоровья
Чистая вода- залог здоровья Декоративный натюрморт
Декоративный натюрморт Мастер-класс Рождественский ангел
Мастер-класс Рождественский ангел «Как вдохновлять мужчину, чтобы получать от него подарки, комплименты и цветы»
«Как вдохновлять мужчину, чтобы получать от него подарки, комплименты и цветы» База отдыха Семинская поляна
База отдыха Семинская поляна 1 сентября - День знаний
1 сентября - День знаний Тема урока: Война и её образ в симфонии №7 Дмитрия Дмитриевича Шостаковича.
Тема урока: Война и её образ в симфонии №7 Дмитрия Дмитриевича Шостаковича. Почвы и почвенные ресурсы
Почвы и почвенные ресурсы Экологическая проблема Мы живем в эпоху стремительного прогресса цивилизации. Развитие промышленности, энергетики, а вместе с тем
Экологическая проблема Мы живем в эпоху стремительного прогресса цивилизации. Развитие промышленности, энергетики, а вместе с тем 1.Т2 -1ПЗ
1.Т2 -1ПЗ Рабочее время и отдых
Рабочее время и отдых Три подружки
Три подружки Введение компетентностного подхода в современное образование
Введение компетентностного подхода в современное образование Олимпийские игры
Олимпийские игры История медицины
История медицины  Компетентностный подход в обучении химии
Компетентностный подход в обучении химии Приёмы целеполагания.
Приёмы целеполагания.